2021 年 70 巻 4 号 p. 766-772
2021 年 70 巻 4 号 p. 766-772
Mycobacterium fortuitum complexによるカテーテル関連血流感染症の症例を経験したので報告する。患者は61歳女性,発熱,倦怠感を主訴に来院した。4病日目に血液培養が陽性となり,グラム染色で難染性を示すグラム陽性桿菌を認めたため抗酸菌染色を行ったところ陽性であった。5%羊血液寒天培地にてコロニー形態の異なる2菌株の抗酸菌が発育し,中心静脈カテーテル表面の付着物(痂皮),皮下埋め込み型中心静脈アクセスポートからも同様の2菌株が発育した。発育の速さより迅速発育抗酸菌によるカテーテル関連血流感染症が疑われた。2菌株は両方ともDDH(DNA-DNA hybridization)法でM. fortuitum,質量分析法でM. fortuitum complexと同定され,ブロスミックNTMにて薬剤感受性試験を測定したところ同一のMICパターンを示した。Imipenem/Cilastatin(IPM/CS)とAmikacin(AMK)による治療が6週間行われ,全身状態が改善したため退院となった。非結核性抗酸菌の同定,薬剤感受性試験は重要であり,稀な菌が想定される場合や難治性の場合などは特に医師との情報交換が必要だと再認識した。
We report a case of catheter-associated bloodstream infection caused by the Mycobacterium fortuitum complex of two different strains that were in a colony form. The patient was a 61-year-old female, whose chief complaints were fever and lassitude. The blood culture became positive in four days of illness, and the Gram stain of the blood sample showed Gram-positive bacilli. Owing to our suspicion of Mycobacterium species, we conducted Ziehl–Neelsen staining, which revealed Mycobacterium species. The Mycobacterium species of two different strains that were in a colony form grew in 5% sheep blood agar, and both strains were detected from an encrustation (crust) on the central venous catheter surface and from the implantable central venous access port. The catheter-associated bloodstream infection caused by rapidly growing mycobacteria was suspected from the speed of growth. The two strains were identified as M. fortuitum by DNA–DNA hybridization and as a M. fortuitum complex by mass spectrometry. The results of susceptibility tests of both strains were the same. Treatment with Imipenem/Cilastatin (IPM/CS) and Amikacin (AMK) was continued for six weeks, after which, the patient’s symptoms resolved. The identification of the nontuberculous mycobacteria and the choice of the method for susceptibility tests are important. In intractable or rare nontuberculous mycobacteria cases, the information exchange with the doctor in charge is important.
Mycobacterium fortuitum complexは約10菌種からなる迅速発育抗酸菌であり1),Run yon分類のIV群に含まれる。土壌,水などの自然環境に存在する菌であり,皮膚,軟部組織,骨などに病巣を形成することが多い。また,本菌を含む迅速発育抗酸菌は非結核性抗酸菌の中でもカテーテル関連血流感染症の原因として一般的である1)。今回,我々はM. fortuitum complexによるカテーテル関連血流感染症を経験したので報告する。
患者:61歳女性。
既往歴:子宮頸癌術後,放射線腸炎,空腸横行結腸バイパス術後,皮下埋め込み型中心静脈アクセスポート(CVポート)留置状態であり,自宅にて高カロリー輸液管理中であった。
臨床経過:発熱,倦怠感を主訴に来院。入院時体温37.9℃,血液検査より炎症反応の軽度上昇,血小板減少,低ナトリウム血症,肝機能障害,低栄養が見られた(Table 1)。感染症と副腎皮質機能不全を想定し,抗菌薬Cefazolin(CEZ),ステロイド等にて治療開始された。来院時にCVポート部周囲の発赤を認め,CVポート感染が疑われたが,ルート確保が難しい患者であったため,他の感染源が除外されるまではそのまま留置されていた。心エコー検査も行われたが,感染性心内膜炎は否定的であり感染源は不明であった。なお,入院時より2年前に行われたHIV抗体検査は陰性であった。
| 血液算定検査 | 生化学検査 | ||
|---|---|---|---|
| WBC | 3.7 × 103/μL | TP | 6.3 g/dL |
| Neut | 83.3% | ALB | 2.7 g/dL |
| Lymp | 13.7% | T-Bil | 1.93 mg/dL |
| Mono | 1.9% | AST | 127 IU/L |
| Eosi | 0.5% | ALT | 173 IU/L |
| Baso | 0.5% | LDH | 350 IU/L |
| RBC | 3.11 × 106/μL | CHE | 140 IU/L |
| Hb | 10.2 g/dL | AMY | 107 IU/L |
| Hct | 30.6% | BUN | 14.5 mg/dL |
| MCV | 98.3 fL | CRE | 0.85 mg/dL |
| MCH | 32.8 pg | CHO | 94 mg/dL |
| MCHC | 33.4 g/dL | Na | 124 mEq/L |
| PLT | 79 × 103/μL | K | 4.0 mEq/L |
| 凝固検査 | Cl | 94 mEq/L | |
| Fibrinogen | 298 mg/dL | IP | 3.0 mg/dL |
| PT時間 | 12.4 sec | CRP | 4.02 mg/dL |
| PT% | 93% | GLU | 136 mg/dL |
| PT INR | 1.04 | eGFR | 53 |
| APTT時間 | 34.4 sec | TTR | 8.4 mg/dL |
| D-dimer | 17 μg/mL | ||
| FDP | 39.5 μg/mL | ||
入院後,凝固異常や肝機能低下は改善傾向にあったが,解熱が不十分であった。4病日目,入院時採取の血液(末梢静脈血)培養好気ボトル2本が陽性となり,抗酸菌染色陽性であった。5病日目,中心静脈カテーテル(CVC)表面の付着物(痂皮)を培養に提出しようとしたところ,シリコンが露出していたため,CVポートは抜去された。CVC表面の付着物とCVポートの両方が抗酸菌染色陽性であったため,抗酸菌のCVポート感染による敗血症と診断された。3日連続で喀痰の抗酸菌培養も提出されたが全て抗酸菌染色陰性であり,培養も陰性であった。CVポート抜去後,解熱したためCEZは終了となった。血液培養好気ボトル,CVC表面の付着物,CVポートの全てからコロニー形態の異なる2菌株の抗酸菌と思われる菌の発育が見られ,血液培養好気ボトルから発育した2菌株を同定した結果M. fortuitum complexと同定された。CVポート抜去後,14病日目以降3回血液培養が提出されたがいずれも陰性であった。
Imipenem/Cilastatin(IPM/CS)(0.5 g × 3回)とAmikacin(AMK)(400 mg × 1回)による治療が6週間行われ,全身状態が改善したため退院となった(Figure 1)。

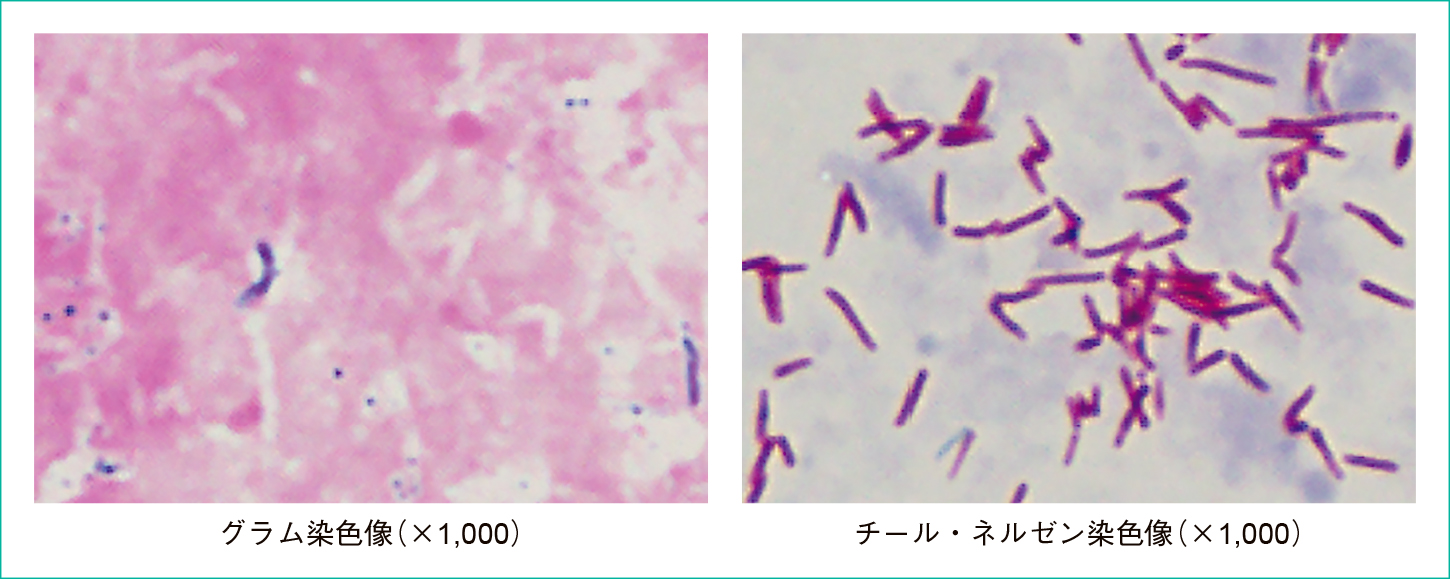
当検査室では血液培養はBacT/ALERT3D(ビオメリュージャパン)にて培養し,7日間培養で陽性とならなかったものを陰性としている。また,抗酸菌用ボトルは使用していない。本症例では入院中合計6回血液培養が提出されたが,いずれも2セットずつ提出された。入院時採取の血液培養は培養開始から4日目で好気ボトル2本が陽性となった。血液培養の培養液を約10 mL抜き取り,15分間遠心したものの沈査をグラム染色(Bartholomew & Mittwer変法)した。グラム染色にて,染まらず白く透けて見える桿菌と,まばらにグラム陽性に染まった桿菌が見られた。抗酸菌を疑い,チール・ネルゼン染色を行ったところ陽性であったため(Figure 2),抗酸菌の可能性があることを主治医に報告した。結核の可能性も考え,血液の結核菌PCRが提出されたが陰性であった。
血液培養陽性検体の培養液を5%羊血液寒天培地(日水製薬)に塗抹し,37℃,6% CO2環境下で培養した。培養1日目から微小なコロニーが発育し始め,培養2日目には白色で艶のあるCorynebacteium属様のスムース型コロニー(菌株1)と,灰白色で乾燥したBacillus属様のラフ型コロニー(菌株2)の2菌株が発育していることが分かった(Figure 3)。2菌株とも工藤PD培地(日本BCG)にも発育が見られたが,工藤PD培地でのコロニー形態は,菌株2が若干顆粒状を呈していたものの,2菌株とも黄色で艶のあるスムース型のコロニーであり,見分けるのは困難であった(Figure 4)。CVC表面の付着物(痂皮)とCVポートもそれぞれから同様の2菌株が発育した。また,血液培養が陽性となったのは入院時採取の好気ボトル2本だけでなく,CVポート抜去前採取の好気ボトル2本,CVポート抜去後採取の好気ボトル1本も陽性となったが,いずれも入院時採取と同様の2菌株が発育した。


当検査室は抗酸菌の同定・薬剤感受性試験は外部委託しており,入院時採取の血液培養から分離された2菌株の同定を依頼した。2菌株ともDDHマイコバクテリア‘極東’(DDH,極東製薬)ではM. fortuitum,質量分析(MALDI Biotyper,ブルカー・ダルトニクス社)ライブラリーバージョン4.0ではM. fortuitum complexと同定された。薬剤感受性試験はブロスミックNTM(極東製薬)にIPM/CS,Minocycline(MINO),Ciprofloxacin(CPFX)を追加して依頼したが,結果は2菌株とも同一のMICパターンを示した(Table 2)。
| 薬剤 | MIC(μg/mL) | |
|---|---|---|
| 菌株1 | 菌株2 | |
| Streptomycin(SM) | 32 | 32 |
| Ethambutol(EB) | 128 | 128 |
| Kanamycin(KM) | 8 | 8 |
| Rifampicin(RFP) | 16 | 16 |
| Rifabutin(RBT) | 2 | 2 |
| Levofloxacin(LVFX) | 1 | 1 |
| Clarithromycin(CAM) | 0.125 | 0.125 |
| Ethionamide(TH) | > 16 | > 16 |
| Amikacin(AMK) | 1 | 1 |
| Imipenem/Cilastatin(IPM/CS) | > 100 | > 100 |
| Ciprofloxacin(CPFX) | 3.13 | 3.13 |
| Minocycline(MINO) | 1.56 | 1.56 |
今回の症例では,血液,CVC表面の付着物(痂皮),CVポートから抗酸菌染色陽性の菌が検出され,発育の速さから迅速発育抗酸菌が疑われた。迅速発育抗酸菌は環境中に存在する菌であり,入院時にCVポート部周囲の発赤を認めたことなどから,CVポートの穿刺部が感染源となったカテーテル関連血流感染症と推測された。血液,CVC表面の付着物(痂皮),CVポートの全てから5%羊血液寒天培地上でスムース型とラフ型の2菌株が検出されており,両方の菌株が原因菌と考えられた。
5%羊血液寒天培地上でラフ型を示した菌株2は,工藤PD培地上では若干顆粒状を呈していたものの,もう一方のスムース型の菌株1との違いが明確ではなかった。これは,5%羊血液寒天培地に純培養したコロニーを直接白金線で工藤PD培地に接種したため,菌量が多くなりすぎてしまい明確な単独コロニーを作れなかったことが原因の一つとして考えられた。また,工藤PD培地はゴム栓をするため5%羊血液寒天培地と比べるとより湿潤環境にあったことも影響したのではないかと考えられた。
当検査室では,結核菌,Mycobacterium avium-intracellulare complexのPCRが陰性だった場合はDDHまたは質量分析を依頼している。
検出された2菌株は,両者ともDDHではM. fortuitum,質量分析ではM. fortuitum complexと同定された。外部委託先に問い合わせたところ,質量分析の結果は2菌株ともMycobacterium farcinogenes,M. fortuitum subsp. fortuitum,Mycobacterium porcinum,Mycobacterium senegalenseの可能性があるが,質量分析ではこれ以上の同定はできないためM. fortuitum complexとしたということであった。
M. fortuitum complexは約10菌種からなり,今回質量分析で可能性があるとされたM. farcinogenes,M. fortuitum subsp. fortuitum,M. porcinum,M. senegalenseは全てM. fortuitum complexに属する1)~3)。この4菌種に加え,M. fortuitum subsp. acetamidolyticumもMALDI Biotyperでの鑑別は困難である4)。M. fortuitum complexは骨,皮膚,軟部組織感染症の原因菌として重要な位置を占め,皮膚損傷,爪損傷,自動車事故による開放創や骨折部位による感染が多く,肺疾患を起こす頻度は低いとされる1)。また,非結核性抗酸菌によるカテーテル関連血流感染症は,迅速発育抗酸菌が原因菌であることが多く,その中でもM. fortuitumが最も一般的だとされている1)。
今回我々は2形態のコロニーを認めたことから2菌種の迅速発育抗酸菌による混合感染を疑った。非結核性抗酸菌の混合感染は,HIV患者の免疫抑制に関連した症例5)や,珪肺症と慢性閉塞性肺疾患の病歴のある患者に生じた症例6)などが報告されている。そして,種々の非結核性抗酸菌はコロニー形態がよく似ているため,混合感染が見逃されたり1菌種の非結核性抗酸菌感染症と誤診された結果,不適当な抗菌薬の処方がされてしまう可能性が示唆されている6)。
また,非結核性抗酸菌は同一菌種であってもスムース型,ラフ型の両方の形態をとることが知られている7)。Mycobacterium abscessusを用いた研究で,スムース型はラフ型から自然発生的に生じた変異体であり,スムース型からラフ型に戻ることもあるとされる7)。M. abscessusは顕微鏡下でコード構造が見られ8),この構造を持つ菌はラフ型コロニーを作ることが分かっている7)。そしてコード構造には,細胞壁に存在するglycopeptidolipid(GPL)が関連しているとされ,GPLを産生しない菌はコード構造を持ちラフ型コロニーを作るが,GPLを産生する菌はコード構造を作らないためスムース型コロニーを作ると言われている7)。
本症例で検出された2菌株は,質量分析でも正確な菌種名までは同定できなかったことから,異なる2菌種である可能性も完全に否定はできなかったが,感受性の結果が2菌株とも同一のMICパターンを示したことより,M. fortuitum complexに属する同一菌種,または類縁菌である可能性が高いと考えられた。
非結核性抗酸菌は菌種あるいは菌株によって薬剤感受性が異なり,迅速に同定することは治療方針の決定だけでなく,疫学面からも極めて重要であるとされ4),American Thoracic Society(ATS)/Infectious Disease Society of America(IDSA)(ATS/IDSA)のガイドライン9)では,species levelまでの同定を推奨している。
DDHは結核菌群を含む18菌種の同定が可能だが,迅速発育抗酸菌はMycobacterium abscessus,M. fortuitum,Mycobacterium chelonae,Mycobacterium peregrinumの4菌種に限られている4)。また,菌種間で交差し,誤同定してしまうこともある10)。
現状では,通常行われる16S rRNA遺伝子解析,相同性の高い菌種では更にrpoB(RNAポリメラーゼサブユニット遺伝子B),hsp65(ヒートショック蛋白65)などのハウスキーピング遺伝子解析が必要となるが11),これらの方法は煩雑で,時間的にも経済的にも負担が大きいという問題がある10),11)。
質量分析による非結核性抗酸菌の同定は,鈴木ら12)によると,比較的稀な非結核性抗酸菌を対象としたMALDI Biotyperの測定結果と遺伝子解析結果は属レベルでは96.0%(48/50株)一致し,種レベルまで一致したのは84.0%(42/50株)だったとしている。遺伝子解析と比較しても良好な同定精度が報告されているが,判別が困難な菌種もあるとされ12),今後のデータベースの充実が望まれる。
迅速発育抗酸菌には,erm遺伝子によるCAM耐性誘導を示すものがあり,特にM. abscessus groupを原因菌とする感染症では,感受性のある薬剤が乏しく,治療が困難だとされる13)。今回の症例では正確な同定はできなかったがM. abscessusの可能性は低く,患者の状態も安定していたため遺伝子検査による同定は行われなかった。
M. fortuitumの感受性は,ATS/IDSAのガイドライン9)によると,AMK,CPFX,Ofloxacin(OFLX),IPM/CS,Sulfonamidesに100%,Clarithromycin(CAM)に80%,Cefoxitin(CFX),Doxycycline(DOXY)に50%であり,感受性薬剤を少なくとも2剤以上を菌陰性化後,肺疾患では12か月以上,皮膚,軟部組織感染症では4か月,骨感染症では6か月投与することを推奨している9)。また,カテーテル関連血流感染症の治療は,通常カテーテルの抜去と適切な抗菌薬を6~12週間投与するとされる1)。
本症例の薬剤感受性試験はブロスミックNTMにて行った。本邦では,非結核性抗酸菌の薬剤感受性検査方法の標準法が確立していないため,大半の施設がこの方法で非結核性抗酸菌の薬剤感受性試験を実施しているとされる13)。迅速発育抗酸菌は,35~37℃より42~45℃でよく発育するといった培養条件が異なることもあり13),ブロスミックNTMでは迅速発育抗酸菌は対象外菌種とされている13)。当時は販売されていなかったため実施できなかったが,現在は迅速発育抗酸菌用のMICプレートであるブロスミックRGM(極東製薬)が販売されており,迅速発育抗酸菌の場合はこちらを使用すべきである。また,ATS/IDSAのガイドライン9)に提唱されているように,CAMを除く他の薬剤については薬剤感受性試験と臨床効果との間には関連性がないことから,薬剤感受性試験の結果は参照にとどめるのが望ましいとされる13)。今回の症例でも,MIC値の高かったIPM/CSを併用していたが治癒に至っている。薬剤感受性試験の結果の解釈は慎重に行わなければならない。
迅速発育抗酸菌感染症については,診断基準,病態,治療法,治療効果,予後いずれも不明確な点が多い9)。HIV感染末期のような重度の免疫不全患者では,通常ヒトには病原性を発揮しないような環境常在菌の感染,発病が起こり,非結核性抗酸菌も稀な菌種での発病が多く報告されてきた14)。また,関節リウマチ治療にTNFα阻害薬が投入され,明らかに希少菌種例は増加しつつある14)。それに加え,事例はまだ少ないものの,非結核性抗酸菌は水環境へ混入し医療関連感染症の原因となりうるとして重要視されている15)。患者の病態,背景などからDDHや質量分析では同定困難な菌が検出される可能性がある場合や,治療を急ぐ場合など,状況によっては初めから遺伝子検査を提案することも必要ではないかと思われる。
今回の症例のように,複数菌株,または複数菌種が検出された場合,検査費用がさらに高額になるため,どこまで詳しく検査するか医師との情報交換が重要となる。また,抗酸菌の同定,感受性試験は詳細な結果が求められる場合に検査を依頼できる施設を確認しておくことが必要だと再認識した。
コロニー形態の異なる2菌株のM. fortuitum complexによるカテーテル関連血流感染症の症例を経験したので報告した。非結核性抗酸菌の同定,薬剤感受性の測定方法の選択は重要であり,稀な菌が想定される場合や難治性の場合などは特に医師との情報交換が重要だと考えられる。
本症例は前勤務先国立病院機構小倉医療センターで経験した症例である(倫理審査受付番号20180405)。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。