2021 年 70 巻 4 号 p. 676-684
2021 年 70 巻 4 号 p. 676-684
LEBER遺伝性視神経症(LHON)は,2015年にミトコンドリア病の一種として難病認定された。本疾患におけるミトコンドリアDNA(m.DNA)の変異は,3460G>A・11778G>A・14484T>C(三大変異)が約90%以上を占めている。MITOMAPのLHON mutationsに登録されているPrimary及びOther candidate LHON mutationsの変異(他変異)の検出を目的として,三大変異をMGB (minor groove binder)-probe法で測定し9領域36箇所の解析法を実施した結果,シーケンス解析は時間と試薬コストがかかりデータ量も膨大になることが明らかとなった。今回,検査の効率化を目的として,診断区分に合わせたm.DNA検査を実施してその効果を精査した。63例の三大変異の内訳は,医師により作成された臨床診断におけるLHONらしき水準(L1~L3)に基づいた診断レベルL1が1例,L2が9例,L3が10例であり,診断レベルが高いほど検出率が高かった。なお,9例の他変異の内訳は,診断レベルL1が3例,L2が3例,L3が4例であった。以上より,検査依頼医との連携に基づく診断レベルに合わせたm.DNA検査を導入することで,検査の省力化及び報告日数の短縮,ならびに他変異の解析も同時に行うことが可能であった。したがって,2015年難病認定基準改定に基づいたLHON診断を確実に実施するためにも,本解析法は臨床的に有用であると考えられた。
Leber’s hereditary optic neuropathy (LHON), one of the mitochondrial diseases, was specified as an intractable disease in 2015. The first three mutations (m.11778G>A, m.3460G>A, m.14484T>C) account for approximately 90% or more of the mitochondrial DNA mutations present in LHON. To detect the primary and other candidate LHON mutations registered in the LHON mutations category of MITOMAP, using Minor Groove Binder (MGB-probe), we measured three primary mutations and conducted sequence analysis at 36 points in nine regions. The results clarified that this type of analysis required time and cost of reagents and generated vast data. In light of the above finding, aiming to improve the investigation efficiency, we conducted the mitochondrial DNA gene investigation in accordance with the diagnostic classification and closely examined the obtained results. Using LHON-like standards in clinical diagnosis prepared by doctors, we judged the breakdown of sixty-three cases. The first three mutations were level L1 for one case, level L2 for nine cases, and level L3 for ten cases, suggesting that the detection rate becomes higher as the diagnostic level increases. The breakdown of nine other mutations showed mutations of level L1 for three cases, level L2 for three cases, and level L3 for four cases. Thus, we achieved labor-saving, shortened reporting frequency (days), and concurrent analysis of the primary and other mutations in the investigation by introducing the mitochondrial DNA gene investigation in accordance with the diagnostic levels in cooperation with the requesting physician. For this reason, the analysis method reported in the present study is expected to be clinically useful in ensuring definitive LHON diagnosis as per the 2015 revision of “Certification Criteria for Intractable Diseases.”
LEBER遺伝性視神経症(LHON)は,母系遺伝形式により若年男子好発の両眼性視神経症である1)。LHONの遺伝については,1988年にWallaceら2)によりLHONにおけるミトコンドリアDNA(m.DNA)の11778塩基の点変異が明らかにされた。本疾患におけるミトコンドリア遺伝子変異はm.3460G>A,m.11778G>A,m.14484T>C(三大変異)が約90%以上を占めており,本邦ではm.11778G>Aへの変異が約90%に認められる3)~6)。厚生労働省の2015年難病認定基準改定に伴い,LHONもミトコンドリア病の一種として難病認定が行われ,日本神経眼科学会及び厚生労働省網膜脈絡膜・視神経萎縮症に関する調査班により,LEBER遺伝性視神経症の認定基準が策定された7)。しかし,診断基準のm.DNA遺伝子検査は保険適用となっていない。
今回,公開されているミトコンドリアDNAに関するデーターベースMITOMAP(http://www.mitomap.org)及び日本人のミトコンドリアDNAに関するデーターベースMITOMAP: A human mitochondrial genome database(http://www.mitomap.org,2019)を用いてLHON mutationsに登録されているprimary及びother candidate LHON mutationsの変異(他変異)の検出を目的として,三大変異をminor groove binder (MGB)-probe法で測定し9領域36箇所の解析法を必要に応じて実施した。しかし,the revised cambridge sequence(rCRS)と一塩基多型(single nucleotide polymorphism; SNP)を比較した場合,LHON mutationsに登録されていないSNPも検出される。これらLHONとの関連性が低いハプログループに関わるSNPも検出されるため,遺伝子診断の解釈を的確に判定するため患者ハプログループを決定し,残されたLHONと関連性が高いSNPを解析する必要性が生じる。解析の結果,シーケンス解析は時間と試薬コストがかかりデータ量も膨大になることが明らかとなった。
今回,診断レベル別に合わせたm.DNA検査を導入することで,検査の省力化及び報告日数が約3日間の短縮,ならびに他変異のSNP解析が可能となった。以上より,2015年難病認定基準改定に基づいたLHON診断を確実に行うための効率的な解析法が確立されたので報告する。
北里大学病院眼科及び井上眼科病院を受診したLHONの疑いと診断された患者から採取した血液63検体を対象とした。血液は,眼科医師の説明後,遺伝子検査の同意を得て,EDTA添加の採取管(EDTA管)に5 mL採取した。なお,本研究は北里大学医学部・病院倫理委員会の承認を得て患者情報保護法の適応に準じた(G15-11)。
2. 方法 1) DNA抽出DNAはEDTA管で採取した全血5 mLから末梢血単核細胞(PBMC)を採取した。そのPBMC液1 mLにRed Blood Cell Lysis Solution(CLB: Promega)を2 mL加えて混和後,2,500 rpm,5分間,遠心した。その上清を滅菌スポイトで吸い取り,その遠心沈殿物にCLB液,1 mLを加え,その200 μLをHigh Pure PCR Template Preparation Kit(Roche)を用いて核酸抽出した。DNA量を測定し0.1 μg/μLに調整し抽出DNAとした。なお,各操作法は添付書の指示に従った。
2) MGB-probe Realtime PCR法(MGB-probe法)MGB-probeはTm EnhancerであるMGB構造により,Tm値70℃のプローブを20塩基以下の長さで設計することができ,短いProbe長により1塩基置換のTm差がより顕著に出るため,SNP解析に最適である。使用するプライマーおよびプローブをTable 1に示す。測定装置は,増幅産物生成過程をモニターリング解析するLight Cycler 96(Roche)を使用して,m.11778の野生型(G),変異型(A)およびm.3460の野生型(G),変異型(A),m.14484の野生型(T),変異型(A)を特異的に検出するMGB-probe(Applied Biosystems)を使用し,SNPを測定した。

測定感度は,m.11778G>A,m.3460G>A及びm.14484T>Cの合成プラスミド(50 ng/μL)を用いて変異の割合が100%,50%,25%,12.5%,6%,3%となるように混合液を作製しMGB-probe法で測定し変異DNAの検出感度を測定した。
3) シーケンス解析抽出したDNAは,m.16569塩基配列の33領域を増幅するprimer(Table 1)を設計し,TAKARA LA Taq(タカラバイオ)を用いて,94℃ 1分後,25サイクル(98℃ 10秒,68℃ 7分),72℃ 10分の長鎖の条件で増幅した(LA-Taq法)。DNAの増幅の判定は,DNA分子量マーカー DNA Ladder(タカラバイオ)を陽性の対象として,電気泳動後,GelRed染色(Wako)を行い,3領域の増幅DNAが陽性であることを目視判定した。m.16569の全塩基配列PCR産物は,PCR産物精製キットNucleospin Gel and PCR Clean-up(タカラバイオ)を用いて添付説明書に従い精製した。LHONと関連性の高い9領域を12種類のシーケンスprimerを用いてPCR増幅した(Table 1)。その精製産物を鋳型として,シーケンスPCRキット:BigDye Terminator v 1.1 Cycle Sequencing Kit(Applied Biosystems)を用いて添付説明書に従いシーケンス反応した。シーケンス産物は,精製キットBigDyeR Xterminator Purification Kit(Applied Biosystems)を用いて添付説明書に従い精製した。精製済みのシーケンスPCR産物は,シーケンサー3500XL GenticAnalyzer装置(Applied Biosystems)を用いて塩基配列を解析した。
LHONに関わるSNPとハプログループの検索得られた塩基配列はMITOMAPのThe revised Cambridge Sequnce(rCRS: haplogroup H2a2)のNC012920によりアライメントを行い,SNPを判定した。ハプログループはMITOMAPの「PhyloTree mt」(mtDNA tree Build17: 18 Feb 2016)を用いて比較し判定した(精密法)。その判定は患者m.DNAとrCRSを比較し,MITOMAPのLHON mutationsに登録されいるSNPを確認した(Table 2)。登録されていないSNPは,ハプログループL0とL1'2'3'4'5'6の間の推定シーケンスであるReconstructed Sapiens Reference Sequence(RSRS)と比較しハプログループを決定した。ハプログループに関わるSNPは削除し,残ったSNPはLHONに関わるmDNA変異として解析し,その手順をFigure 1に示した。
| TOP 19 Primary LHON mutations | Other cadidate mutations | ||
|---|---|---|---|
| Locus | Nucleotide Position | Nucleotide Change | |
| The first 3 mutations (95%) | ND4 | m.11778G>A | R340H |
| ND1 | m.3460G>A | A52T | |
| ND6 | M.14484T>C | M64V | |
| Primary mutations LHON mutations | ND1 | m.3376G>A | E24K |
| m.3635G>A | S100N | ||
| m.3697G>A | G131S | ||
| m.3700G>A | A112T | ||
| m.3733G>A | E143K | ||
| m.4171C>A | L289M | ||
| ND3 | m.10197G>A | A47T | |
| ND4L | m.10663T>C | V65A | |
| ND5 | m.13051G>A | G239S | |
| m.13094T>C | V253A | ||
| ND6 | m.14459G>A | A72V | |
| m.14482C>A | M64I | ||
| m.14482C>G | M64I | ||
| m.14495A>G | L60S | ||
| m.14502T>C | I58V | ||
| m.14568C>T | G36S | ||
| Other candidate LHON mutations | ND1 | m.3472T>C | F56L |
| m.4025C>T | T240M | ||
| m.4160T>C | L285P | ||
| ND2 | m.4640C>A | I57M | |
| m.5244G>A | G259S | ||
| ATP6 | m.9101T>C | I192T | |
| CO3 | m.9804G>A | A200T | |
| ND3 | m.10237T>C | I60T | |
| ND4 | m.11253T>C | I165T | |
| m.11696G>A | V312I | ||
| ND5 | m.12811T>C | Y159H | |
| m.12848C>T | A171V | ||
| ND6 | m.14279G>A | S132L | |
| m.14325T>C | N117D | ||
| m.14498T>C | Y59C | ||
| m.14596A>T | I26M | ||
| CytB | m.14831G>A | A29T | |
MITOMAP: LHON Mutaitons
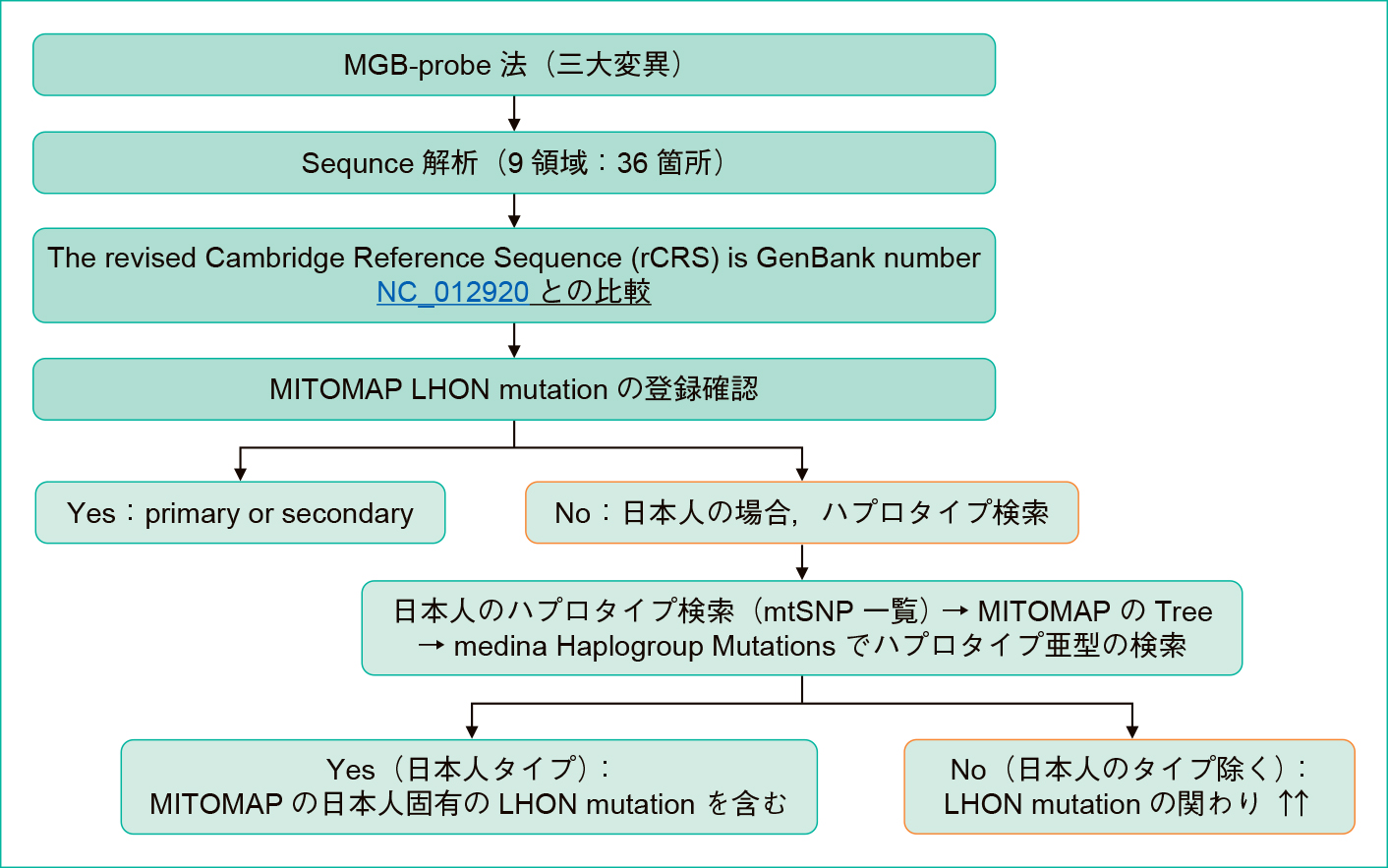
レベル1は主徴候①もしくは③あるいは,家族例から母性遺伝あり(保因者)など,レベル2は主徴候①と②,①と③を満変異として解析した。
Lightcycler 96を用いた三大変異の測定時間は,DNA抽出から約2時間以内に検出が可能であった。検査費用の請求は検査の実作業時間の人件費を含めMGB-probe法は9,000円,9領域36箇所のシーケンス法(精密法)は26,000円とした。旧法はABI PRISM310装置(ABI)とPhastGel(GH Healthcare)を用いたSingle Stand Conforaition Polymorphism(SSCP法)によりSNPを検出し,その測定時間は変異が検出された場合,3~5日間であった。検査費用は,変異7箇所(三大変異,とmt1460 mt9101,mt9804,mt15257)で約17,000円であった。
2) 変異感度試験合成プラスミドを用いたm.11778G>A,m.3460G>A及びm.14484T>Aの感度試験は野生型と変異型の3%~100%の混合液を作製し再現性を測定した。変異型の検出感度は(n = 5),m.11778Aが3%,m.3460Aが6%,m.14484Aが12.5%であり,目視判定によるシーケンス法のヘテロプラスミーの判定を30%とすると,2倍~10倍ほど高感度であった。
2. 臨床検体におけるMGB-Probe法とシーケンス法との比較LHONの遺伝子診断のためm.DNA検査が依頼された全血63例を用いたMGB-probe法とシーケンス法について比較しTable 3に示した。26例のm.11778G>Aの一致率は100%であった。18例のm.3460G>Aの一致率は100%,また,19例のm.14484T>Cの一致率は100%であった。ヘテロプラスミーが確認されたm.11178G>A例は,MGB-probe法がG野生30%,変異Aが70%であった。そのシーケンス法は目視判定においてG野生と変異Aの混在が確認された。
| MGB-probe PCR assay (n = 63) | ||||||||
|---|---|---|---|---|---|---|---|---|
| m.11778 | m.3460 | m.14884 | ||||||
| G | A | G | A | T | C | |||
| Sequence Analisis | m.11778 | G | 16 | 0 | ||||
| A | 0 | 10 | ||||||
| m.3460 | G | 15 | 0 | |||||
| A | 0 | 3 | ||||||
| m.14484 | T | 15 | 0 | |||||
| C | 0 | 4 | ||||||
厚生労働省網膜脈絡膜・視神経萎縮症に関する調査研究ならびに日本神経眼科学会が合同で作成したLEBER遺伝性視神経症の認定基準の1. 主要項目,1)主徴候の①に「片眼であっても,視力低下の割に対光反射が保たれている。MRIなどで視神経の炎症所見が確認できない。あるいは家族歴があるなどレーベルを疑わせる臨床的特徴があると医師が判断した場合はこれも含む」を追加して医師が診断レベルを区分判定した7)(Table 4)。レベル1は主徴候①もしくは③あるいは,家族例から母性遺伝あり(保因者)など,レベル2は主徴候①と②,①と③を満たす。レベル3は主徴候①~③すべてを満たすことを評価した。その診断レベル別の三大変異及び他変異の内訳をTable 5に示した。
| I 主徴候 | 症例数 |
|---|---|
| ①急性~亜急性,両眼性,無痛性の視力低下と中心暗点など* 「*片眼性であっても,視力低下の割りに対光反射が保たれている,MRIなどで視神経の炎症所見が確認できない,あるいは家族歴があるなどレーベルを疑わせる臨床的特徴があると医師が判断した場合はこれも含む」(井上眼科病院:若倉雅登先生 北里大学医学部客員教授) ②急性期に視神経乳頭の発赤・腫脹,視神経乳頭近傍毛細血管拡張蛇行,網膜神経線維,腫大,視神経乳頭近傍出血から1つ以上の所見 ③慢性期に乳頭黄斑繊維束を中心とした,さまざまな程度の視神経委縮 |
|
| II 検査所見 ①ミトコンドリア遺伝子変異(m.11778・m.3460・m.14484他) ②急性期には眼窩部のCT/MRIで球後視神経に異常を認めない。 ③急性期のフルオレセイン蛍光眼底造影検査で蛍光色素露出がない。 |
|
| III レーベル遺伝子検査前の診断レベル レベル1:主徴候①もしくは③ あるいは,家族例から母性遺伝あり(保因者)など レベル2:主徴候①と②,①と③を満たす。 レベル3:主徴候①~③すべてを満たす。 |
N = 63 16 34 13 |
| Top 19 mutations | Other candidate LHON (Number of cases) |
Not applicable | Haprogroup (Number of cases) |
||
|---|---|---|---|---|---|
| ①First 3 | ②Other 16 | ||||
| L1 (1/16) 6.3% |
m.11778G>A (n = 1)*1 (6.3%) |
m.12811T>C (n = 2) | m.13269G>A | M7 (6) | |
| m.3316G>A (n = 1)*2 | m.13269G>A | D4 (3) | |||
| m.3992C>T·M.15779T>C | B4/5 (2) | ||||
| m.3882G>A | Z4 (1) | ||||
| F1 (1) | |||||
| m.14632C>T | L1 (1) | ||||
| m.15779T>C | Other | ||||
| m.3398T>C | Other | ||||
| L2 (9/34) 26.4% |
m.11778G>A (n = 8) | m.12811T>C (n = 1) | m.12729A>G | D4/5 (11) | |
| m.14484T>C (n = 1) | m.9804G>A (n = 1) | m.10640T>C | A5 (5) | ||
| m.14568C>T (n = 1) | m.15449T>C | G1/2 (3) | |||
| m.11696G>A (n = 1) | m.12092C>T | M7 (3) | |||
| m.3975C>T | B4/5 (3) | ||||
| m.4315 (T)/ m.4316 (T insert) | F1/2 (2) | ||||
| m.3606C>T | N9(2) | ||||
| m.3764C>T | C5 (1) | ||||
| m.11701T>C | Other | ||||
| m.14753A>G | Other | ||||
| m.13135G>A | Other | ||||
| m.10640T>C | Other | ||||
| L3 (12/13) 92.3% |
m.11778G>A (n = 10) | m.4171C>A (n = 1) | m.12811T>C (n = 1) | m.15434C>T | B4/5 (5) |
| m.13051G>A (n = 1) | m.3497C>T (n = 1) | m.15323G>A | D4/5 (4) | ||
| m.4216T>C (n = 1) | m.3338T>C m.15061A>G | N9 (3) | |||
| m.3644T>C | M7 (1) | ||||
*1: Early LHON
*2: Examples of reports from academic papers
レベルL1と診断された16例中1例はMGB法及びシーケンス法においてm.11778A(変異),L2と診断された34例は,MGB法及びシーケンス法において8例がm.11778A(変異),1例がm.14484C(変異)であった。L3と診断された13例中10例は,MGB法及びシーケンス法でm.11778A(変異)であった。
2) 他の変異(TOP19・Other candidate LHON・論文報告例)レベルL1と診断された16例中3例はシーケンス法においてm.12811C(変異)が2例,m.3316A(変異)が1例であった。L2と診断された34例中4例はシーケンス法において,1例がm.12811C(変異),1例がm.9804C(変異),1例がm.14568T(変異),1例がm.11696A(変異)であった。L3と診断された13例中5例は,1例がm.12811C(変異),1例がm.3497T(変異),1例がm.4216C(変異),1例がm.4171A(変異),1例がm.13051A(変異)であった。また,Other candidateのm.12811T>Cの変異は,日本人のハプログループ(M7b)と判定した。
3) 未登録のSNPの判定未登録のSNPは,ハプログループを判定し,rCRSのSNPからRSRSのハプログループに関わるSNPを除外し,アミノ酸変異が認められたm.DNA変異を判定した。レベルL1と診断された16例中3例はシーケンス法においてm.13269G(変異)が2例,m.14632T(変異)が1例であった。L2と診断された34例中2例はシーケンス法において,2例がm.10640C(変異)であった。L3と診断された13例中4例は,アミノ酸変異に関わらないSNPであった。また,Other candidateのm.12811T>Cの変異は,日本人のハプログループ(M7b)と判定した。
近年の遺伝子解析の進歩により,多くの遺伝子疾患の原因遺伝子が同定されている。厚生労働省の2015年難病認定基準改定に伴い,日本神経眼科学会と厚生労働省網膜脈絡膜・視神経委縮症に関する調査研究班によりLHONの認定基準が示され,LHONもミトコンドリア病として認定された。認定基準の検査所見では,「ミトコンドリアDNAの質的,量的異常」がLEBER遺伝性視神経症に該当する。MITOMAPのLHON mutationsに登録されている38箇所のSNPは,三大変異を含む「“Top 19” Primary LHON mutations」が全症例の95%を占め,残りの「Other candidate LHON mutations」は単一家族あるいは単一症例として記載されている7)。従来のSSCP法とシーケンス法を用いた当院における解析結果においても,約90%がm.11778G>Aであった。しかし,三大変異以外のm.DNA変異に関して,同定が行われている8)~10)。また,希少変異についても,設楽・若倉らが報告している11)~16)。三大変異は検査センターでの委託検査が可能であるが,その他の変異については検査センターでの解析が難しく研究施設への依頼となる。他方,眼科医がLHONを疑って遺伝子検査を行う場合は,当院では未保険検査のため病院負担として検査を行っている。また,他変異をシーケンス解析する場合は,LHON mutationsに登録されていないSNPも検出される。さらに,その解釈やLHONとの関連性を明確にするためハプログループを決定しm.DNA遺伝子解析を解析するため,9領域36箇所についてシーケンス測定を実施している。よって,シーケンス解析は時間と試薬コストがかかり,データ量も膨大になることが問題となった。
今回,検査依頼医がLHON難病認定基準を基に診断区分したm.DNA検査を活用することで,三大変異は,旧法のSSCP法に比べMGB法は約2~4日以上の検査時間の短縮,旧法のSSCP法で変異36箇所を検査した場合に比べ約70,000円の検査費用の削減及びLHON mutaiotionsに登録されていないSNPの判定が可能となった。さらに,三大変異及び他変異を検出することにより,LHONの確実な遺伝子診断が可能となった。本方法は,MGB法と新たな9領域(ND1, ATP6, CO3, ND3, ND4L, ND4, ND5, ND6, CYTB),36箇所の変異についてシーケンス法で解析した。m.DNA検査が依頼された全血63例を用いたMGB-probe法とシーケンス法について比較した結果,m.11778G>Aは,m.11778A(変異)が63例中19例で一致率100%であった。m.3460G>Aは,63例中63例がmt.3460G(野生)で一致率100%,また,m.14484T>Cは,m.14484C(変異)が63例中1例で一致率が100%であった。また,ヘテロプラスミーが確認されたm.11178G>A例は,シーケンス法の目視判定に比べMGB-probe法はG野生30%,変異Aが70%と高感度に検出することが確認された。合成プラスミドを用いたm.11778G>A,m.3460G>A及びm.14484T>Aの感度試験より,目視判定によるシーケンス法のヘテロプラスミーの判定を30%とすると,約2倍~10倍,検出感度が高く,特異プローブを用いることによりシーケンス法に比べ感度,特異性が高いと考えられた。
しかしながら,MITOMAPには三大変異以外のPrimary LHON mutationsやOther candidate LHON mutationsの変異(他変異)が登録されている。よって,他の変異についてはm.16569を3分割しLA-PCR増幅して3分割の9領域36箇所のシーケンス解析した場合,時間,試薬コスト及び膨大なデータ量の問題点が生じた。そこで,m.DNA検査の検査時間,検査費用及びより確実なLHON診断を目的として,より確実にm.DNA変異を検出するため診断区分に合わせたm.DNA解析法について検討を行った。その結果,診断レベル別のm.DNA変異の評価は,レベルL1の16例中1例は早期LHONのm.11778G>Aで経過観察中にレベルL3となった。また,レベルL2の34例中8例がm.11778G>A,4例が他変異であった。L3の13例中10例がm.11778G>A,5例が他変異であった。三大変異のみの測定では,2014年に日本神経眼科学会で行われたレーベル遺伝性視神経症の全国疫学調査10)と同様の結果で,m.11778G>Aが95.0%(20変異中19変異)であった。しかし,検査センターへの委託が困難な三大変異以外のTOP19 mutations(other16)やOther candidate LHONの変異を測定に加えると,m.11778G>Aが占める割り合いは95.0%から59.4%(32変異中19変異)に減少した。その結果,レベルL3で三大変異が検出されない原因不明の視神経萎縮症の場合,9領域36箇所のm.DNA変異検査を行うことにより,難病認定のための遺伝子検査がより確実に診断できることが示唆された。日常検査のm.DNA解析は,MITOMAPに登録されているrCRSと比較し遺伝子変異を判定しているため,本邦においては,rCRS(欧州)と日本人との人種差におけるSNPが判定に影響する。本法は患者のm.DNAを最初にrCRSと比較し,次にハプログループを判定することにより,そのハプログループに関わるSNPのrCRSを除外し,眼科医に相談し最終報告を行っている。レベルL1の16例中2例がm.12811T>Cの他変異が確認されたが,2例のm.12811T>Cはハプログループ(M7b1a)に関連する変化である可能性が示唆され,眼科医の判定によりLHON mutaitionsとの関連性は低いと考えた。レベルL2においては三大変異以外の他変異が3例,未登録のSNPでアミノ酸変異が2例検出されて検出率が14.7%向上し,より的確な遺伝子診断が可能となったことより,精密法によるm.DNA変異検査を行うことが必要であると考える。しかし,LEBER遺伝子検査を依頼された全例について9領域36箇所のシーケンス解析を行うと保険収載が認められていない現状においては,関連診療科との連携強化及び検査体制を整備した診断レベル別にMGB-probe法とシーケンス解析を組み合わせることにより,日常検査に導入可能な遺伝子検査である。しかし,MITOMAPに登録されていない新たなm.DNA変異は,結果の解釈・報告など専門的知識を要する指導医師との連携が重要である。
以上より,MGB-probe法を用いた三大変異の検出は迅速性および良好な感度を示し,診断レベルに合わせたm.DNA解析は,レーベル病患者推計調査などの疫学調査や確実な診断に有用と考えられた。現在は,LEBER病遺伝子検査を含む各種遺伝子検査は保険収載されていない検査が多く,病院検査室で導入するには簡便性及び費用対効果の面から克服すべき問題は多く残されている。現時点ではLEBER病の9領域36箇所の解析を行う場合,検査依頼医との連携強化,情報交換を高め解析作業の簡易的及び検査コストの軽減に努めることにより,診断率の向上や確実な疫学統計に繋がることが考えられた。今後は日本人のm.DNAのレファレンスシーケンスの開示,実質的に費用対効果が得られる保険収載及び次世代シークエンス装置が低コストで検査が行える体制の整備が望まれる。
MGB-probe法を用いた三大変異の検出は迅速的で良好な感度を示し,診断レベルに合わせたm.DNA解析は日常検査においてより確実な診断が可能である。LHONは環境因子の関与など依然として不明点も多いが,診断レベルがL2以上の場合,9領域36箇所のm.DNA変異検査を進めることにより,三大変異以外のm.DNA変異の検出率が向上し,LHONの的確な遺伝子診断が可能となった。今後も検査依頼医との連携を強化して検査体制の改善を進め,m.DNAの解析および疫学的な検討に努めていく。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。