2022 年 71 巻 J-STAGE-1 号 p. 216-240
2022 年 71 巻 J-STAGE-1 号 p. 216-240
女性生殖器には,子宮以外にも膣,卵管,卵巣が含まれ,女性ホルモンを分泌し,卵子を作り,妊娠に関与する。年代によって月経,出産,閉経後とそれぞれの組織・細胞像が変化する。女性生殖器の疾患では,感染症,良性疾患(膣炎,子宮下垂,子宮脱,子宮筋腫,子宮内膜症),悪性疾患(子宮頸癌,子宮体癌,卵巣癌),および機能性疾患(月経,機能性性器出血,更年期障害,不妊症)がある。
Female genital organs include the uterus, vagina, fallopian tubes, and ovaries. They are involved in the secretion of female hormones, production of eggs, and pregnancy. Tissues and cells in female genital organs vary in appearance depending on the age owing to the effects of menstruation, childbirth, and menopause. Female genital diseases are classified into benign (vaginitis, hysteroptosis, prolapse of uterus, uterine fibroid, and endometriosis), malignant (uterine cervical cancer, uterine body cancer, and ovarian cancer), and functional disorders (menstrual disorders, functional genital bleeding, climacteric disorder, and infertility).
LSILという用語は感染症と腫瘍性の2つの病態を意味している。1つがいわゆる平坦型コンジローマ(flat condyloma)で,コイロサイトーシスを特徴とし,多量のHPV粒子が複製されている病変である。大量のHPV-DNAが存在し感染源となる。感染するHPVの80%がハイリスクとされる。LSILの60%は消退,30%は遷延し,10%がHSILに進展する。LSILには実質的にHSILに相当するものも含まれることがある1)。
2) コルポスコピー所見・組織学的所見コルポスコピー所見では,比較的透明感のある白色上皮が軽度にみられ,その辺縁は不規則・地図状に観察される(Figure 10.1)。組織学的には,重層扁平上皮の中層以上ではHPV感染による形態異常であるコイロサイトーシスが顕著にみられることがある。上皮の基底側1/3で軽度の核腫大を認めても核分裂は少ない1)(Figure 10.2)。

比較的透明性のある軽度の白色上皮やモザイクが広範囲に観察され,それらの境界辺縁部は不規則である。

核の腫大と大小不同,核形不整,スマッヂ核,すりガラス様核,核周囲明庭などの特徴を有するコイロサイトーシスが重層扁平上皮の表層部で顕著に認められる。核はくびれにより2核や多核もみられる。
成熟した表層型あるいは中層型の核異常扁平上皮細胞をいう。核は正常の中層細胞核の3倍以上の腫大があり,不整を伴う。核クロマチンは比較的均一に分布し,細顆粒状,スマッジ状(泥状無構造濃染核)を呈する。核のくびれによって2核または多核細胞にみえることもある(Figure 10.3)。コイロサイトーシスはHPV粒子の複製に伴う細胞傷害の結果で,核の腫大,大小不同,形状不整,核周囲明庭(ハロ( halo))といった所見を呈する。これに伴ってハロの周囲(細胞膜に相当する領域)が肥厚したように観察される(Figure 10.4)。また,LSILでは錯角化などもみられる2),3)。

正常中層細胞核の3倍以上の腫大,不整を伴う表層型あるいは中層型の核異常扁平上皮細胞。核クロマチンは細顆粒状,スマッジ状を呈し,核はくびれにより2核または多核細胞にみえることがある。

核の腫大,大小不同,核形不整,核周囲明庭を特徴とするコイロサイトーシスが観察される。核周囲明庭の辺縁は明瞭で周囲の細胞質が肥厚したように観察される。
核異型を伴わないグリコーゲンによる核周囲の空胞化(偽コイロサイトーシス),感染症などの炎症による小さく不明瞭な核周囲明庭,放射線治療に伴う反応性異型はときにLSILとの鑑別を要し,ASC-USと判定されることがある2),3)。
2. HSIL/CIN2/moderate dysplasia 1) 概要重層扁平上皮の基底側1/3~2/3の範囲で異型が認められる。30%が消退,60%が遷延し,10%がCIN3に進展する。ほぼ全例でハイリスクHPVが検出される。コイロサイトーシスをみる例も少なくない1)。CIN2は3~6ヶ月ごとに細胞診とコルポスコピーを併用し厳重な管理が求められる。HPVタイピング検査によりハイリスクHPV16,18,31,33,35,45,52,58のいずれかが陽性の病変では進展リスクが高いため,それ以外のHPVタイプや陰性例とは区別して管理がなされる。ハイリスクHPV陽性ではレーザー蒸散/円錐切除などが考慮される4)。
2) 組織学的所見核・細胞質比が高く,核クロマチン増量,核の大小不同や多形性,不整を示す異型細胞が重層扁平上皮の基底側2/3の範囲で認められる。核分裂が増加し異常核分裂がみられることがあり,中層付近にも出現する。しばしば表層部でコイロサイトーシスも認められるが,LSILでみられるコイロサイトーシスに比べると核が腫大し核・細胞質比が高い(Figure 10.5)。基底側でp16INK4aがびまん性に強陽性を呈し表層側にいくほど減弱する。Ki-67で標識される細胞もほぼp16INK4aの陽性域に一致する(Figure 10.6)1)。

核・細胞質比が高く,核クロマチン増量,核の極性・配列の乱れ,核形不整を示す異型細胞が重層扁平上皮の基底側2/3の範囲で認められる。核分裂像が増加し中層付近に異常核分裂がみられる。

p16INK4aはハイリスクHPV関連腫瘍マーカーとして用いられ,免疫組織化学的に基底側でびまん性に強陽性を呈し,表層側にいくにしたがい徐々に減弱する。
中層型の核異常細胞が主体を占める。核・細胞質比は40~50%程度とLSILより高い。核クロマチンは細または粗顆粒状で一様に分布し,核小体は認めない。多辺形または紡錘形を呈することが多い。コイロサイトーシスがみられることが少なくない(Figure 10.7, 10.8)2),3)。

核腫大,核形不整を伴う中層型の核異常細胞を主体に認める。核クロマチンは細または粗顆粒状に増量し,細胞質は多辺形または紡錘形を呈する。

中層~傍基底型の扁平上皮細胞に核腫大,核の大小不同,核形不整が認められる。核クロマチンは細または粗顆粒状で,核小体は目立たない。
CIN2程度の異型細胞が上層側1/3の範囲にも認められる病変,あるいは明らかにCIN2の異型を越えた病変とされる。従来,異型が全層に及ぶ場合は上皮内癌CISと定義されてきた。細胞診異常を契機にコルポスコピー検査が行われ生検にて診断が確定される。ほぼ全例にハイリスクHPVが感染しており,HPV-ISHでは,HPV-DNAが宿主DNAに組み込まれている状況が観察される1)。診断確定には円錐切除術を行うことが基本とされ,摘出標本断端陰性のCIN3は最終治療とすることが治療ガイドラインで推奨される4)(後述のAISとの違いがある)。
2) コルポスコピー所見・組織学的所見コルポスコピー所見では,やや透明感に欠け肥厚した白色上皮として認められ,大小不同のモザイク所見がみられる(Figure 10.9)。組織学的には重層扁平上皮のほぼ全層にわたって核異型や核分裂像が認められる。比較的均一な細胞で構成されるが,多形性に富む例や角化傾向が目立つ場合もある。既存の頸管腺内に進展(腺侵襲(glandular involvement))をきたすことが多いため,微小浸潤とは鑑別する必要がある(Figure 10.10, 10.11)1),3)。上皮の全層にわたってKi-67陽性細胞が分布し,p16INK4aはびまん性に強陽性を呈する。p16INK4aは未熟化生や萎縮,反応性異型との鑑別に有用である。Ki-67も診断確定には有用性が高い(Figure 10.12)1)。

全体的に肥厚し,透明感の欠如した高度な白色上皮が観察される。大小不同のモザイクもみられる。

重層扁平上皮のほぼ全層にわたって核異型や核分裂像が認められる。頸管腺内に進展し,既存の円柱上皮を置換している。辺縁は明瞭かつ平滑である(腺侵襲(glandular involvement))。

核・細胞質比の高い細胞がほぼ全層性に増殖している。表層ではわずかに分化がうかがわれる。核の大小不同や多形性,核の極性・配列の乱れ,核分裂像が増加する。
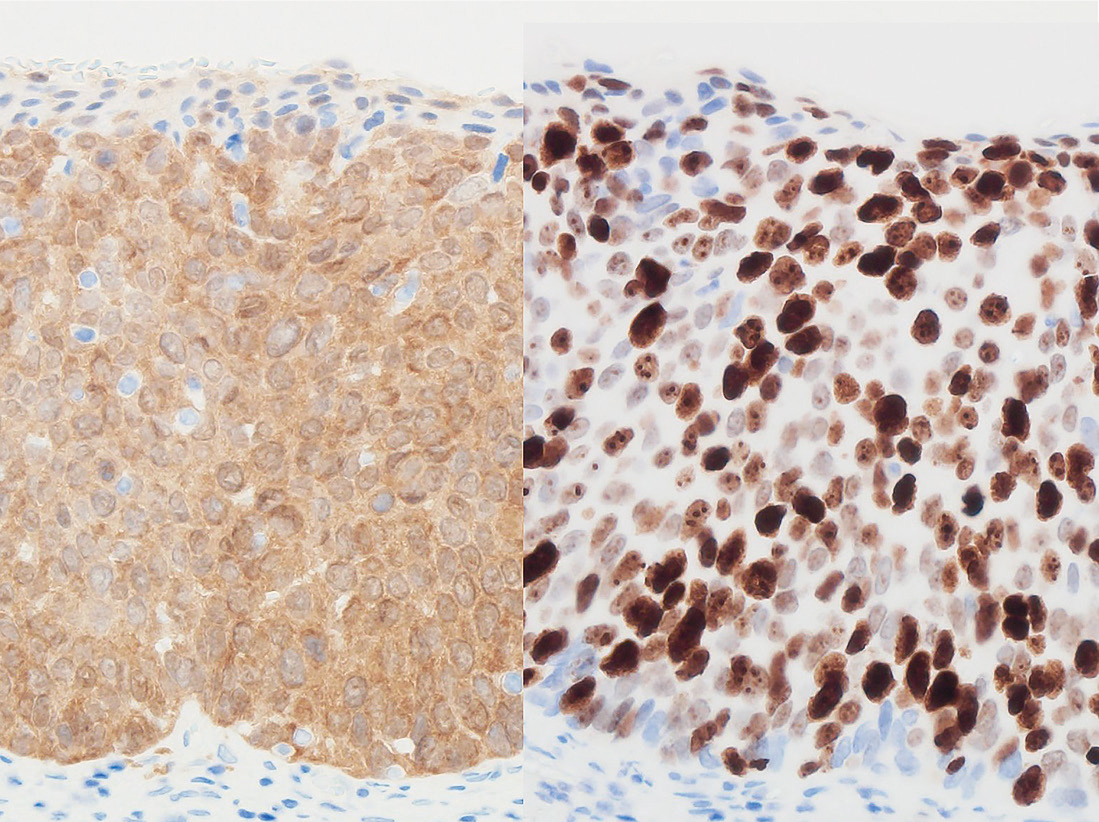
免疫組織化学的にp16INK4aが上皮のほぼ全層にわたりびまん性に陽性を呈する。またKi-67陽性細胞がほぼ全層にわたって分布し,標識率は50%を超える。
高度異形成では傍基底型の核異常細胞が主体を占め,核・細胞質比は60~80%程度とかなり高い。核形は不整や切れ込み,皺がみられることが多い。核クロマチンは細または粗顆粒状に一様に分布している。核縁は不規則に肥厚し,核小体は通常みられない(Figure 10.13)。上皮内癌になると核・細胞質比は80%を超え,細胞質は極めて狭小である。核クロマチンは細顆粒状または細網状で密に充満している。核は緊満感を呈し,裸核状としてみられることがある。集塊状で出現する場合では,核密度が高く,集塊内に核分裂像が観察されることがあり,分化傾向を示す細胞はみられない(Figure 10.14)2),3)。

核・細胞質比が70~80%の傍基底型の核異常細胞を認める。核縁は不整で切れ込みや皺がみられ,核クロマチンは細~粗顆粒状に一様に分布する。核小体は目立たない。

核・細胞質比が高く,核形不整,核クロマチンの増量した異型細胞が密な集塊として認める。細胞質は乏しく,集塊内に分化傾向を示す細胞はみられない。核分裂像を観察することがある。
傍基底細胞,予備細胞,未熟化生は小型で核・細胞質比の高い細胞として出現する。また,萎縮性変化,内頸部腺細胞,子宮内膜細胞,脱落膜間質細胞などは核密度の高い集塊としてみられることが多いため,HSILとの鑑別が問題となりしばしばASC-Hとして判定される(Figure 10.15)。核・細胞質比,クロマチンパターン,核の重なりに着目することが肝要である2),3)。

核腫大,核・細胞質比増大がみられるが,核クロマチンは微細で一様である。核の重なりや不整は明らかではないためASC-Hと判定された。
p16INK4aはハイリスクHPVのE7が宿主のDNAに組み込まれた場合に強い発現が誘導されるマーカーでありHSILの検出に有用とされている。細胞診おいてもp16INK4aとKi-67の二重染色はHSILの検出感度,特異度が高まり,未熟化生,萎縮,反応性異型などとの判別に有用である(Figure 10.16)2)。

p16INK4a(茶色)が細胞質と核に陽性,Ki-67(赤色)が核に陽性を呈する。両者が同時に発現している場合はHSILの存在が強く示唆される。
重層扁平上皮への分化を示す異型細胞が浸潤性に増殖する腫瘍で,子宮頸癌の約8割を占める。早期の場合は細胞診を契機に診断されるが,進行例では性交後出血,無痛性の間欠性あるいは有痛性の持続的出血がみられる。血中腫瘍マーカーであるSCCが上昇する例もある。ほぼ全例がハイリスクHPV関連腫瘍である1)。治療は,IAに対しては単純子宮全摘出術が,IB,II期では広汎子宮全摘出術あるいは根治的放射線治療が選択される。III,IV期の進行癌では同時化学放射線療法(CCRT)が一般的である4)。
2) 肉眼的所見・組織学的所見肉眼的には腫瘍の主座や発育様式によって異なり,種々の程度に外向性や内向性にみられる(Figure 10.17)。組織学的に扁平上皮癌は通常型と特殊型からなり,通常型は角化の多寡/程度に応じて角化型と非角化型に分けられる。角化型は同心円状の層状角化を特徴とする癌真珠(cancer pearl)がみられるものを指す。細胞境界は明瞭で,細胞間橋(intercellular bridges)を容易に認める。非角化型は個細胞角化,細胞間橋がみられても角化真珠を欠き,腫瘍細胞は比較的大型で多形性が目立ち,核分裂が多い。核が小型なものでは小細胞癌と鑑別する必要がある(Figure 10.18)1),3)。

外子宮口に約3 cm大の腫瘤が外向性に発育し突出している。

異型細胞が充実性胞巣を形成して浸潤性に増殖している。一部では個細胞角化,細胞間橋が認められる。腫瘍細胞は多形性が目立ち,核分裂像が多くみられる。
出血や腫瘍性の背景に,細胞質に厚みをなす層状構造を呈する腫瘍細胞を認める。角化型ではオレンジG好性の細胞質を有する異常角化細胞や紡錘形やオタマジャクシ型などの奇怪な形状を呈する腫瘍細胞や癌真珠様配列の集塊を認める。非角化型ではライトグリーンに好染し散在性または合胞性に出現する。腫瘍細胞は流れるような配列を呈する。核は腫大し,大小不同や不整を伴い,核クロマチンは粗状で不均等分布を示す(Figure 10.19, 10.20)2),3)。

背景には壊死物質がみられる。核の大小不同,核形不整,クロマチン濃染性を呈する腫瘍細胞を認め,異常角化や短紡錘形細胞も観察される。

核の大小不同,核形不整,クロマチン増量を伴う異型細胞が重積集塊状に認める。集塊内には核分裂像が散見され,核の長軸方向へ流れるような配列を呈する。
悪性の腺上皮を含む上皮内病変で,高異型度頸部腺上皮内腫瘍(high-grade cervical glandular intraepithelial neoplasia; CGIN)と同義語である。細胞診異常を契機として診断される。およそ半分がHSILと併存し,CIN3に対して行われた円錐切除検体で偶然に見つかる例も少なくない。円錐切除術後,残存病変が存在する例や非連続的に病変が存在することがあるため,厳重な経過観察および単純子宮全摘出術が推奨される。通常型の他,腸型,胃型,類内膜型,明細胞型,漿液型,重層型粘液産生上皮内腫瘍(stratified mucin-producing intraepithelial lesion; SMILE)などの変異型が存在する1)。
2) 組織学的所見腺上皮細胞が正常の頸管腺の構造を保ったまま上皮を置換増殖し,間質浸潤を示さない(Figure 10.21)。正常頸管腺上皮との境界は明瞭でフロント(front)形成をみることがある。異型上皮は正常の頸管腺が存在する範囲内に限局する。通常型上皮内腺癌は細胞質内粘液に乏しい異型円柱細胞で構成され,核は腫大し,クロマチン増量,重積を示す。また核分裂像,アポトーシスも認められる(Figure 10.22)1)。

正常の頸管腺の構築を保ったまま,上皮が異型円柱細胞で置換されている。正常頸管腺上皮との境界は明瞭でフロント形成を認める。間質への浸潤は示さない。

細胞質内粘液に乏しい異型円柱上皮で構成され,中等度~高度の核の腫大,核重積,クロマチン増量を示す。また核分裂像やアポトーシスも観察される。
シート状,あるいはロゼット様の配列をとり,一部には核密度の高い重積性集塊としてみられる。蜂巣状の所見はみられない。細胞核は柵状に配列し,細胞集団の辺縁部から核や細胞質の紐状の突出が観察される(羽毛状変化)。核は卵円形または長楕円形で,軽度の腫大,大小不同を伴い偽重層化している。核クロマチンは細顆粒状で均一に分布し,核小体は通常小型で不明瞭である。一般的に粘液は乏しい。核分裂像やアポトーシスをよくみる(Figure 10.23, 10.24)2),3)。

ロゼット様,花冠状配列をとり核密度の高い重積集塊状として認められる。核は柵状に配列し,細胞集塊辺縁部から核の突出像が観察される。

核は卵円形または長楕円形を呈し,腫大および偽重層化を示す。核クロマチンは細顆粒状で均一に分布し,核小体は小型で不明瞭である。集塊内には核分裂像やアポトーシスを認める。
腺侵襲を伴うHSILでは集塊状でみられる場合,しばしば腺系病変との鑑別が問題となる。細胞配列や集塊辺縁の細胞所見が鑑別のポイントとなり得る。約半数例がHSILを併存することから,注意深い観察が必要である。また,AISの基準に満たない腫瘍性を示唆する異型腺細胞はAGCと判定されることがある2),3)。
6. 腺癌(adenocarcinoma) 1) 概要腺上皮への分化を示す異型細胞が浸潤性に増殖する腫瘍で,近年増加傾向にある。子宮頸癌全体の20%程度を占める。ハイリスクHPV(とりわけ18型)に関連して発生するものと,HPV非関連のものがある。HPV関連腫瘍には通常型内頸部腺癌および腸型粘液性癌が,一方で胃型粘液性癌,漿液性癌,類内膜癌,明細胞癌,中腎癌はHPV非関連腫瘍とされ,ハイリスクHPVの検出率が低いか陰性となる。HPV非関連腺癌は関連腺癌に比べると予後が不良とされ,放射線感受性も低い。すわわち,胃型粘液性癌や漿液性癌は予後不良で化学療法抵抗性が示唆されている1),4)。
2) 肉眼的所見・組織学的所見早期では扁平上皮癌に比べて不明瞭で,病変を肉眼的に指摘できないことも少なくない。進行癌では外向性に乳頭状,隆起性に突出する(Figure 10.25)。通常型内頸部腺癌が最も頻度が高い。組織学的には細胞質内粘液に乏しい高円柱細胞で構成され,複雑に分岐する管状,乳頭状,篩状構造を示す(Figure 10.26)。腫瘍細胞に粘液空胞が認められても僅かなことが多い。核は重層化を示し,多数の核分裂像,アポトーシスを認める(Figure 10.27)。扁平上皮癌と同様にHPV関連腺癌ではp16INK4aが陽性となるが,非関連腺癌でも一部に陽性を示すことがある1),3)。

外子宮口に約1.5 cm大のポリープ状に隆起した病変を認める。

細胞質内粘液に乏しい高円柱状からなる異型細胞で構成され,複雑に分岐する管状,乳頭状,篩状構造を示す。

核は楕円形で,腫大と核クロマチンの増量,大型核小体,重層化を示す。高頻度に核分裂像,アポトーシスを認める。腫瘍細胞に粘液空胞が認められても僅少である。
腫瘍性背景に構造異型を呈する立体的大型集塊として出現する。核の偽重層化,配列の乱れを伴い,腺腔様構造を認める。腫瘍細胞は類円形から卵円形の核をもち,核クロマチンは微細顆粒状,周囲明化,核膜の不整や肥厚,大型の核小体がみられる。細胞質内粘液は認めるが乏しい。また高頻度に核分裂像を認める(Figure 10.28)2),3)。

核の重層化,配列の乱れを伴い,腺腔様構造を伴う大型立体細胞集塊を認める。腫瘍細胞は類円形~卵円形核からなり核クロマチン増量,核膜の不整や肥厚,大型核小体を認める。
内膜腺と間質の増生から構成される良性の腫瘍性,非増殖性,非炎症性の隆起性病変と定義される。上皮・間質細胞とも月経周期に連動した変化を示さない。全女性の約20%にみられ,年齢層は幅広い。閉経後のホルモン補充療法や,乳癌治療におけるタモキシフェン投与よっても生じる。とりわけ,高齢者では内膜ポリープからの組織発生を示す漿液性子宮内膜上皮内癌(serous intraepithelial carcinoma; SEIC)や漿液性癌がしばしば経験され,内膜ポリープは広義の前駆病変でもある。ただし,悪性腫瘍がポリープ状をなすものとは区別する必要がある。
② 病理所見有茎性あるいは広茎性を呈し,発生部位および大きさは様々である(Figure 10.29)。腺管上皮は性ホルモン不応性で周期性変化をとらず,増殖期ないし基底層の上皮に類似する。化生性変化が種々の程度にみられる。腺管は拡張や分岐を示すこともあるが,大きな極性の乱れはない。稀ではあるが,分泌期の特徴をもつ内膜腺上皮が密に増殖する例も経験される。間質は多くの場合増殖期様であるが,線維成分が優勢で細胞成分が少ないこともある。定型例ではポリープ根部の内膜から連続する比較的太い血管が中心部に存在する(Figure 10.30)。

子宮体部背側に基部をもつ茎の長いポリープを認める。

増殖期様の腺管および間質とともに比較的太い/壁の厚い血管を認める。
エストロゲン値が高い状態で遷延する,あるいは急激に低下することで,破綻出血や消退出血をきたして排卵にはいたらないために,無排卵で月経周期を終える。ただし,黄体機能不全を特異的に捉えることは難しい。
② 病理所見多くは内膜崩壊(endometrial glandular and stromal breakdown; EGBD)に代表され,特徴的な像として腺管と間質の離解,上皮の好酸性化,間質細胞の凝集,およびアポトーシスの亢進がみられる。なお,核分裂はほとんどみられない(Figure 10.31)。

断片化した腺管と凝集した間質細胞を認める。集塊内にはアポトーシスが容易に見つかる。
背景には出血やフィブリン塊がみられ,断片化した増殖期相当の内膜腺管,間質細胞の凝集塊,好酸性化生,粘液性化生,乳頭状変化などが観察される(Figure 10.32)。

シート状の腺管上皮と凝集した間質細胞が観察される。
妊孕性温存の目的で異型増殖症や類内膜癌G1/2に対してmedroxyprogesterone acetate(MPA)/ヒスロンH®に代表される外因ホルモンが投与される。また,乳癌患者には抗エストロゲン製剤であるタモキシフェン/ノルバテックス®が用いられる。その他にも子宮筋腫や子宮内膜症,過多月経に対して加療が行われている。
② 病理所見MPA療法ではプロゲステロンの効果によって,核の円形化・縮小,細胞質の好酸性化,N/C比の低下,間質の脱落膜様変化(偽脱落膜化)といった変化が混合してみられる。細胞異型の減弱がかなり期待されるが,効果は個人差が大きく病変の完全消失が期待される一方で,復古/再発もかなり早い時期にみられる例がある(Figure 10.33)。タモキシフェンによる内膜変化は一様ではなく,増殖症や内膜ポリープなどを惹起することがある。

萎縮した腺管上皮と脱落膜様に変化した間質を認める。
MPA療法では,内膜上皮は分泌期の像に類似する,または萎縮によりシート状でみられる。泡沫状で豊富な細胞質を有する間質の脱落膜様変化,種々の化生性変化など多彩な像を認める(Figure 10.34)。タモキシフェンでは一定の変化に乏しいが,内膜ポリープや増殖症,稀に癌に遭遇することにも留意する。

豊富な細胞質を有する脱落膜様の間質細胞がみられる。MPA療法に伴う変化と捉えられる。
若年層から閉経期前後にかけて起こる。多くが可逆性で非腫瘍性病変に位置づけられる。閉経前では不規則増殖期内膜との鑑別が難しい例が少なくない。
② 病理所見内膜腺上皮は高円柱で増殖期の上皮に類似する。核は異型に乏しく,類円形ないし楕円形で大きさや形はほぼ均一である。腺管は円形や楕円形で,しばしば嚢胞性拡張(スイスチーズ様)を示す。上皮の不整な突出や陥入,分岐も軽度にみられる(Figure 10.35)。

大小の不規則に拡張した腺管を認める。腺上皮は増殖期に類似し細胞異型に乏しい。
嚢胞状拡張・分岐を示す腺管,口径の大小不同や半島状に突出した集塊が観察される。腺管上皮は高円柱状で増殖期の腺細胞に類似している。重積性に乏しく細胞異型を欠く。間質は比較的豊富である(Figure 10.36)。

内膜間質細胞とともに半島状に突出した異型に乏しい細胞集塊を認める。
類内膜癌における前駆病変あるいは初期病変で,同義語として類内膜上皮内腫瘍endometrioid intraepithelial neoplasia(EIN)が用いられる。EINでは,診断基準として細胞異型は背景の既存の内膜腺上皮との差異により決定される。大きさも1 mm以上と定義される。異型増殖症のおよそ半分に類内膜癌の合併がみられる。閉経期前後では類内膜癌(主にG1)からみると,かなりの頻度で異型増殖症を前景にもつことがわかる。なお,類内膜癌の上皮内腺癌は概念的には存在し得るが(漿液性上皮内癌のように)診断項目としては明記されておらず,異型増殖症に包括される。孕性温存療法(黄体ホルモン療法)が考慮される。
2) 病理所見限局性に,またはびまん性に起こる。核の腫大,クロマチン増量,核小体の明瞭化を示す異型腺上皮が不整な腺管を密になす。腺管の占める面積が間質よりも優勢で(EINでは診断基準に明記されている),好酸性化生やmorule(桑実胚様細胞巣形成),間質泡沫組織球の出現がしばしば観察される。類内膜癌とは間質浸潤,すなわち線維間質反応(desmoplastic reaction)を欠くことで鑑別される(Figure 10.37, 10.38)。内膜間質を認識するマーカーとしてCD10がよく使われている。ただし,moruleも陽性となることに留意する。

不規則な腺管が密に増殖している。間質には泡沫組織球が観察される。

Morule(桑実胚様細胞巣形成)が腺管を繋ぐように観察される。
拡張腺管や複雑な分岐を示す集塊や,不整形突出集塊などの構造異型をみる(Figure 10.39)。好酸性細胞化生やmoruleなどの化生性変化を伴う(Figure 10.40)。化生性変化は腺管上皮と比べて,核や細胞質の腫大が目立つため過剰評価につながらないように留意する。核分裂の多寡は有意な指標とはならない。一方で泡沫組織球の出現は有益な所見である。

複雑に多分岐した大型細胞集塊に間質の介在がみられる。

異型腺管から移行するmoruleを捉えることができる。
いずれの年齢層でも最も多い内膜癌の組織型で,子宮内膜癌の約80%を占める。閉経後に発生する頻度が高いが40歳以下の若年者発生も約5%にみられる。増殖期内膜腺上皮に類似性を示し,背景には異型のない内膜増殖症や異型増殖症を伴っていることが多く,それらとの合併率も高い。構造異型や細胞異型により3つのGrade(G)/異型度に分けられる。約2/3がG1で,G2と併せたいわゆる分化型はエストロゲンに依存性を示すI型に分類され予後良好である。一方,G3はI型かII型かは明確にされていないが,通常は予後不良で高リスク群に分類される。
大半の患者で不正性器出血が発見のきっかけとなる。長期間のエストロゲン曝露やエストロゲン産生卵巣腫瘍,タモキシフェン投与,肥満,未産,Lynch症候群といった遺伝的素因などがリスク因子に挙げられる。臨床進行期,年齢,Grade,筋層浸潤の深さ,脈管侵襲は転移や転帰を予測する因子となる。子宮内膜症/腺筋症は癌の浸潤を助長する因子でもある。G1/G2ではPTEN,ARID1A,PIK3RI,PIK3CA,KRASの遺伝子変異が高頻度にみられる。一方,G3ではTP53の変異の頻度が高い。組織発生上,G3にはG1/2から連続する延長上のものと,連続性を示さない独立したものがあると考えられている。
2) 病理所見腺管/管状構造の明瞭なものから細胞異型が強く構造的分化が曖昧なものまで幅が広い。扁平上皮への分化を示すことも特徴である。高分化型では内膜腺上皮に類似した円柱状の腫瘍細胞が単層に,ないしは重層化し基底膜に垂直に配列する。G1と異型内膜増殖症との識別は,間質浸潤の有無による。間質浸潤を示唆する所見として,間質の消失や狭小化(back-to-back構造),線維形成性間質反応(desmoplasia),腺管の癒合や篩状胞巣,間質の炎症細胞浸潤などが挙げられる。充実性胞巣の割合,あるいは核異型によってGradeが決定される(Figure 10.41–10.43)。

腺管が癒合傾向を示すが狭い間質によって腺管が独立していることがわかる。核は軽度腫大しているが均一感がある。

明瞭な扁平上皮への分化がみられるが異型は概して弱い。

密で複雑な腺管構造を示す。細胞異型が強く核分裂が高頻度にみられるためG2と判断される。
充実性で異型が強い場合は,G3,未分化癌,癌肉腫,および漿液性癌が鑑別の対象となる。明細胞癌には類内膜癌との併存例がときにみられるため,生検と手術検体で所見が乖離することがある。
亜型として,扁平上皮への分化を伴う類内膜癌(endometrioid carcinoma with squamous differentiation),絨毛腺管型類内膜癌(endometrioid carcinoma with villoglandular variant),分泌型類内膜癌(endometrioid carcinoma with secretory variant)がある。
Grade 1(G1):明瞭な腺管構造が大半を占め,充実性胞巣からなる領域が5%以下。Grade 2(G2):充実性胞巣からなる領域が5%を超えるが50%以下。ただし,充実性成分が5%以下でも核異型が強い場合。Grade 3(G3):充実性胞巣からなる領域が50%を超える。ただし,充実性成分が50%以下でも核異型が強い場合。
3) 細胞所見背景は出血性,壊死性が一般的で,好中球を主体とした炎症が目立つことがある。高分化型では細胞異型が目立たないため,構造異型・複雑な構造に注視する。すなわち,多分岐・枝分かれや不整な突出を示す腺管が重積集塊として観察される。大型内膜集塊では,腺管の密集や癒合,篩状構造などがみられる(Figure 10.43, 10.44)。内膜間質細胞の出現は乏しいが,腺管集塊の中心部には紡錘形細胞の束からなる線維性血管間質が観察されることがある。間質浸潤を示唆する腫瘍性間質とみなすことができる。

大型細胞集塊内に腺腔構造や篩状構造が観察される。

腫瘍細胞が不規則に重積した細胞集塊で腺腔構造を捉えることができる。
角化細胞や核中心性でライトグリーン好染性を示す厚い豊富な細胞質を有する扁平上皮様細胞が大なり小なりみられる(Figure 10.46)。癌の表層部では炎症などの影響を受けやすく,腫瘍細胞が種々の程度に様々な化生性変化を起こす。好酸性変化,粘液性変化,明細胞化生,合胞化などが挙げられる。好中球の取り込み像は類内膜癌に観察される頻度が高いが特異的ではない。間質の泡沫細胞を捉えることも可能である。

ライトグリーン好染性の厚い細胞質を有する扁平上皮様細胞が認められる。
G3を考える低分化型では,大小の不規則な重積集塊から結合性が低下し,ほつれがみられる。個々の細胞は比較的小型でN/C比が高く,クロマチン微細増量,核小体が目立つことがある。また,散在性の腫瘍細胞はしばしば肉腫様形態も示す(Figure 10.47, 10.48)。通常,細胞異型が高度なため悪性と判断することは難しくはないが,癌肉腫や漿液性癌,神経内分泌癌などとの鑑別に留意し,組織型推定には慎重に臨む。なお,小型細胞からなる高悪性度腫瘍では,細胞変性や出血,壊死に陥りやすく,腫瘍細胞がマスクされることがあるため過小判断に陥りやすい。
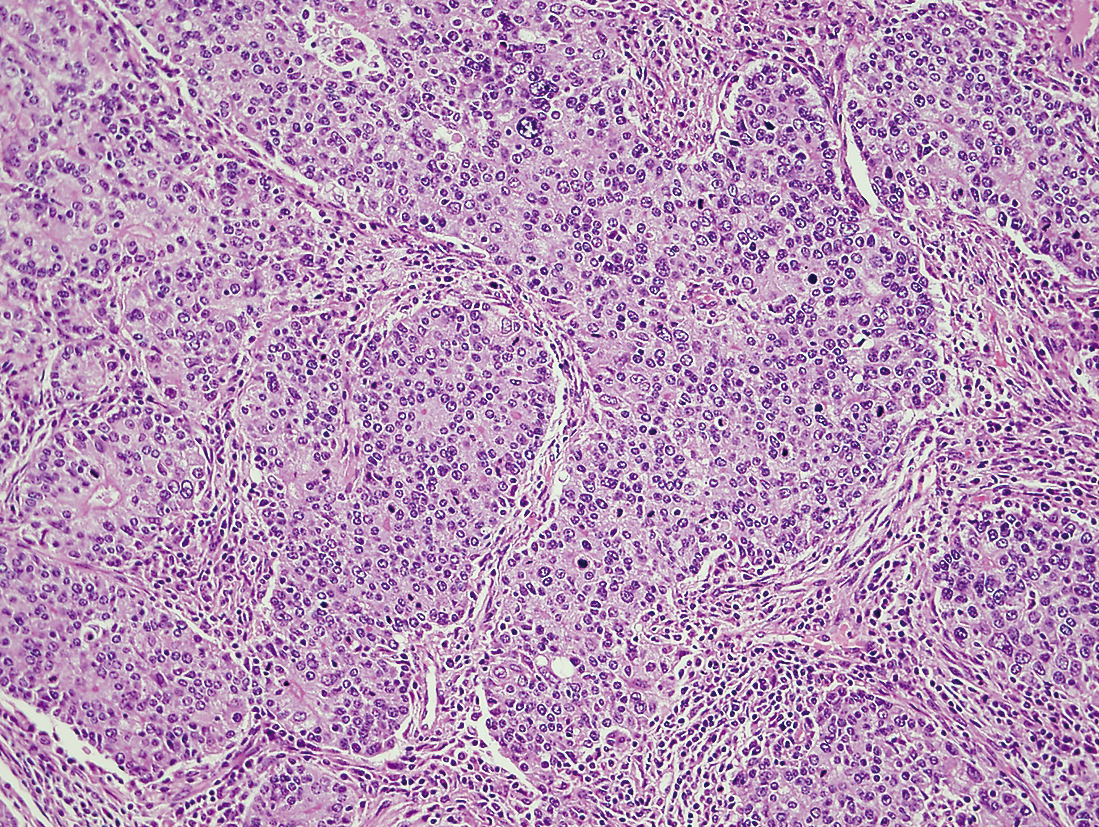
癒合ないし腺房状構造がうかがわれるが充実性増殖が主体をなしている。

小型でN/C比の高い腫瘍細胞が結合性の緩い大小の集塊をなす。個在性の腫瘍細胞も容易にみてとれる。
エストロゲン非依存性を示すII型の腫瘍で,子宮内膜癌の5~10%程度を占め,予後不良である。ほとんどが閉経後に発生する。卵巣漿液性癌のような低異型度・高異型度の分類はない。筋層浸潤がない症例でも既に子宮外に進展していることが少なくない。萎縮内膜上皮を背景に,漿液性子宮内膜上皮内癌(serous intraepithelial endometrial carcinoma; SEIC)とよばれる上皮内病変を伴う頻度が高い。組織発生上,内膜ポリープとの関連性も示唆されている。多くにTP53遺伝子の変異およびp53の高発現を認める。
2) 病理所見複雑な乳頭状構造を基本とする。N/C比が高く細胞質が狭い高度な細胞異型を示す腫瘍細胞が,血管線維性間質を軸に増殖する(Figure 10.49)。先端部では腫瘍細胞が内腔にこぼれ落ちたように観察される。腺管内で密に増殖する領域でも,しばしば狭い間隙がみられる。核分裂およびアポトーシスが高頻度に観察され,壊死も目立つことが多い。砂粒体はあまりみられない(Figure 10.50)。

血管線維性間質を軸に複雑に分岐した乳頭状構造がみられ,一部が壊死に陥っている。

腫瘍細胞はN/C比が高く,強い核異型を示し,高頻度にアポトーシスや核分裂がみられる。
ほとんどの例がp53の強陽性反応をびまん性に示すが,完全に陰性null patternのこともある。p16の異常発現も多くにみられる。ERは陰性のことが多い。WT-1,IMP3の陽性像も診断に有用である(Figure 10.51)。

腫瘍細胞がERに陰性で,p53に強い陽性反応を示す。
壊死・出血性背景に,血管線維性間質を軸にした乳頭状構造や多分岐を示す大型集塊としてみられる。N/C比が高く核の大小不同が目立ち,クロマチンは粗顆粒状に増量している。大型な核小体を認める芽出様の小型の不整形集塊では,細胞異型が強いながらも集塊の結合性は強く,集塊辺縁の細胞質がライトグリーン好染性で明瞭に観察される。(Figure 10.52)。

多分岐を示す乳頭状集塊からなり結合性が保持されている。腫瘍細胞はN/C比が高く,細胞異型は目立つ。
グリコーゲンに富む淡明な細胞質,または好酸性細胞質をもち,hobnail(鋲釘)様の形態を特徴とする。エストロゲン非依存性で漿液性癌などと同様にII型に属し,閉経後に多い。子宮内膜癌の2%程度で,卵巣癌ほどには頻度は高くない。予後は漿液性癌よりは良いが類内膜癌G3に比べると不良である。組織発生において,漿液性癌のような初期/前駆病変は明らかではなく,内膜ポリープとの関連性も低い。
2) 病理所見グリコーゲンに富む淡明な細胞質,あるいは好酸性(暗調)の細胞質を特徴とする。また,細胞質に乏しい鋲釘様を呈する腫瘍細胞が,乳頭状,管状嚢胞状あるいは充実性などの様々な増殖形態を呈する。好酸性で無構造な間質あるいは基底膜様物質(IV型コラーゲンやラミニンを含む)を腫瘍細胞が取り囲むような乳頭状の構築もみられる(Figure 10.53)。腫瘍細胞の核は大型類円形で,不整や大小不同が目立つ。核小体は明瞭なことが多い。核分裂像はそれほど多くない。細胞の内外に好酸性の硝子様物質がしばしば認められる(Figure 10.54)。免疫組織化学的に,ERやPgRは陰性のことが多く,p53の異常発現はあまりみられない。HNF-1βの陽性率が高い。PTEN,PIK3CA,ARID1A遺伝子の変異の頻度が高い。しばしば類内膜癌や漿液性癌との移行もみられ,あるいはそれらとの鑑別に難渋することある。

基底膜様物質を腫瘍細胞が取り囲むように乳頭状に増殖している。

細胞内外に好酸性の硝子様物質が目立ち,核の不整や大小不同,明瞭な核小体をみられる。
出血性・炎症性背景に,管状やシート状といった小~中型の集塊として出現する。集塊の結合性は概して緩く,集塊の最外層で核の突出像が認められる。中心部ではライトグリーン好性の基底膜様物質,硝子様物質をみることがあり特徴的な所見である(Figure 10.55)。また,基底膜様物質を伴ったミラーボール状集塊(卵巣明細胞癌が腹水に出現した際にみられる特徴的な所見)もみられることがある(Figure 10.56)。腫瘍細胞は淡明,またはライトグリーン好性の豊富な細胞質をもつ。細胞境界は明瞭なことが多い。核は不整,大小不同を示し,クロマチンは微細顆粒状に増量し,しばしば著明な核小体を認める。

豊富な細胞質,核の大小不同を示す腫瘍細胞からなる結合性の緩いシート状集塊からなり,ライトグリーン好染性の基底膜様物質を認める。

核形不整,明瞭な細胞境界を示す腫瘍細胞が厚みのある立体的なボール状集塊として認められる。
癌腫成分と肉腫成分からなる悪性腫瘍で,体部の上皮性・間葉性混合腫瘍の中でも最も多い。子宮悪性腫瘍の5%未満と多くはないが,全身の臓器に発生するなかで体部の癌肉腫に遭遇する頻度が最も高い。閉経後の高齢者に発生し,性器出血でみつかることが多い。タモキシフェン療法やエストロゲン補充療法との関連性が示唆され,長期の骨盤放射線照射に伴う発生も知られている。診断時にすでに子宮外病変を伴っている場合が少なくなく,通常の類内膜癌に比べて予後不良であり,とくに癌腫成分が予後に関わる。しかしながら,臨床病理学的に肉腫に比べて類内膜癌とリスク因子が共通することから,病期決定や治療選択は高悪性度の子宮内膜癌に準じて行われる。クロナリテイーの解析により癌肉腫のほとんどが単一細胞由来であると考えられている。体部での発生頻度に比べると頸部の癌肉腫はかなり稀である。
2) 病理所見肉眼的には子宮内腔を占拠するようにポリープ状腫瘤を形成することが多い。腫瘍は概ね軟らかく,壊死や出血を伴う(Figure 10.57)。癌腫成分は類内膜癌G3,漿液性癌などの高異型度が多い。上皮成分の異型が弱い場合は腺肉腫,間質肉腫や平滑筋肉腫などを鑑別する必要がある。肉腫成分が子宮に存在する間葉系組織への分化を示す場合を同所性,本来子宮に存在しない軟骨,横紋筋や骨などへの分化を示す場合は異所性と呼ばれる。紡錘形や多形性を示す平滑筋肉腫や内膜間質肉腫などの同所性がやや多く,異所性では横紋筋や軟骨への分化を示す肉腫が一般的である(Figure 10.58)。

子宮内腔に突出したポリープ状腫瘤を認める。出血や壊死を伴っている。

腺管を成す癌腫成分の周囲には紡錘形や類円形の異型核をもつ肉腫成分が認められる。
壊死性背景に,結合性を有する不規則な集塊として認める癌腫成分と,紡錘形細胞や多形性の強い異型細胞が孤在性に出現する肉腫成分をみる(Figure 10.59, 10.60)。悪性と判断することは容易であるが,両成分を明確に識別することは容易でないため,組織型推定には悩むことが多い。上皮成分が多い場合は低分化な類内膜癌や漿液性癌を推定することになり,また肉腫性分が目立つ際には平滑筋肉腫や高異型度内膜間質肉腫などを考えることになる。

癌腫(類内膜癌)が推定される不規則な重積集塊が認められる。

肉腫が推定される紡錘形異型細胞が束状に増殖している。
閉経後の症例がほとんどで片側性が多く,約60%の症例が卵巣あるいはその付近に生じた子宮内膜症から発生すると考えられている(Figure 10.61)。淡明で豊富な細胞質を有する腫瘍細胞とhobnail状の細胞形態の2つを特徴とする腫瘍で,日本人では卵巣癌全体の20~30%を占め,高異型度漿液性癌に次ぐ頻度でみられる組織型である。進行期では化学療法に抵抗性で予後不良である5)。

片側性が多く,表面平滑で厚みのある線維性被膜に覆われる嚢胞内腔に充実性隆起性病変が突出する。
基本構築は,乳頭状,管状嚢胞状,あるいは充実性の増殖構築であり,多くの症例ではそれらの構築が様々な割合で混在し,移行像もみられる。管腔を裏打ちする細胞は,重積を示すことはなく,一列に配列する。核が基底膜側から腺腔方向に向かって突出しているようにみえるため,hobnail様外観を呈する(Figure 10.62)。腫瘍細胞の細胞質内にグリコーゲンを貯留した細胞境界明瞭な淡明細胞が主体となっている。典型例では核異型が強く,核形不整や核の大小不同が目立つとともに,明瞭な好酸性核小体を有する。卵巣明細胞癌の免疫組織化学的特徴として,糖代謝関連の転写因子hepatocyte nuclear factor-1beta(HNF-1β)が,感度・特異度ともに優れたマーカーとして近年定着しつつある。また最近,肺腺癌マーカーの一つであるNapsin-Aが,卵巣癌診断における新たな明細胞癌マーカーとして注目されている6)。

左:複雑に分岐する乳頭状構築であるが,その末梢まで間質芯を認識できることが多い。
右:多くの腫瘍細胞が,hobnail形態を示している。
捺印細胞診では,背景は壊死性で,腫瘍細胞は小型~大型の集塊でみられ,シート状あるいは孤立性にも出現し,多彩な像を呈する。明細胞癌の特徴は,淡明で比較的豊富な細胞質を有し,乳頭状の集塊では,核が突出するhobnail状の細胞と,Pap染色でライト緑好染,Giemsa染色でメタクロマジーを示す硝子様間質(collagenous stroma)の存在である(Figure 10.63)。また,腫瘍細胞の核は大型で著明な核小体を認める。

左:核が突出するように偏在するhobnail状の細胞と中心にはライト緑好染性の硝子様間質を認める。
右:中心にメタクロマジーを呈する硝子様間質を認める。
卵巣癌全体のなかで最も頻度の高い組織型で,大半が進行した状態で見つかり,組織学的には,微小浸潤を超えて破壊性に浸潤する(Figure 10.64)。昨今では,異型が強く予後不良な高異型度漿液性癌(high grade serous carcinoma)と分化度が高く予後の良い低異型度漿液性癌(low grade serous carcinoma)の二つに分けられ,両者は,分子・遺伝子異常に置いて明瞭な違いがあり,互いに独立して位置づけられる。漿液性癌のほとんどが高異型度漿液性癌からなる。

嚢胞部が優勢で乳頭状ないし大小不同の病変を形成する低異型度漿液性癌に対し,高異型度漿液性癌では壊死や出血を混じた充実部が大半を占める。
壊死を広範に認めることが多く,N/C比の高い腫瘍細胞が乳頭状もしくは充実性増殖を示す。裂隙状の空隙を伴っており,細胞配列には規則性がみられない(Figure 10.65左)。核は不整形で大小不同がみられ,クロマチンに富み,核分裂像が高頻度に観察される(Figure 10.65右)。砂粒体がしばしば認められるが,良悪の鑑別とはならない。

やや広い間質を中心に,高度の異型や多形性を示す腫瘍細胞が乳頭状,微小乳頭状に増殖している。裂隙状の空隙を伴っており,細胞配列には規則性がみられない。
高異型度漿液性癌の捺印細胞診では,壊死と共に,不規則な重積性を示す集塊,あるいは乳頭状集塊として観察される(Figure 10.66)。集塊内にヘマトキシリンやエオジンに染色される同心円状の砂粒体を伴うこともある。核形は不整で,クロマチンに富み,核縁は肥厚する。1~数個の明瞭な核小体を有し,核分裂像は高頻度にみられる。空胞状を呈する細胞が混在することもある。

クロマチンの増量した異型核を有する腫瘍細胞の乳頭状集塊。空胞状を呈する細胞が混在することもある。
いかなる上皮性卵巣腫瘍への分化も認識できない上皮性悪性腫瘍で,非常に稀な組織型である(Figure 10.67)。約90%の症例に,卵巣外への播種,転移がみられ,きわめて予後不良である。

充実性腫瘍で,広範な壊死,出血を伴っている。
大型の多形性に富んだ腫瘍細胞が充実性,シート状に増殖し,しばしば地図状の壊死を伴う(Figure 10.68左)。腫瘍細胞は単調な形態を示し,類円形の形態が典型的である。核分裂像は多い(Figure 10.68右)。免疫組織化学的には,上皮性マーカーのEMAやサイトケラチンが陽性を示す。ビメンチンは通常,陰性である7)。

特定の分化傾向を認めない腫瘍細胞が,シート状に増生し,壊死(矢頭)を伴う。核分裂像が多い。
背景は壊死性で,腫瘍細胞はシート状または孤立性に認められる。核の大小不同が顕著であり,核クロマチンの増量や核小体が著明となり,核分裂像を多数認める(Figure 10.69)。

典型的には,類円形の核を有する腫瘍細胞が孤立性からシート状にみられる。核分裂像を多数認める。
卵巣は女性生殖器の中でも他臓器原発の悪性腫瘍の転移を受けやすい臓器である。消化管原発性腺癌の頻度が高く,転移性卵巣腫瘍の約70%が両側性である。原発巣に先行して腫大した卵巣腫瘍が発見されることも多い。卵巣への転移は,血行性,リンパ行性,播種性および直達性,いずれの経路においても成立する。Krukenberg腫瘍(Figure 10.70)の名称は消化器癌とくに胃癌の卵巣転移として広く周知されてきたが,その定義は今日でも曖昧である8)。Krukenberg腫瘍を腫瘍細胞の10%以上が印環細胞からなる転移性腫瘍と定義した際には,その67%は胃癌の転移である9)。次いで虫垂,結腸・直腸,乳腺などの順で原発巣がみられる。

肉眼的に卵巣は球状~粗大分葉状の硬い腫瘤を形成し,割面は灰白色,黄色,赤褐色のゼラチン様性状を呈する。また,嚢胞を伴うことも少なくない。
印環細胞(signet ring cell)のびまん性増殖と卵巣固有の線維性間質の反応性増生を伴う(Figure 10.71左)。上記の通り,胃癌が原発のことが最も多い。胃の印環細胞癌の転移では,小型で細胞質内に粘液を有し(Figure 10.71右),粘液染色(Alcian Blue染色,PAS反応)陽性を示す。大腸癌の転移では,多層化した高円柱状の腫瘍細胞が管状,索状に配列し,分化型の腺管状腺癌の像をとる。大腸癌は一般的に転移先で変性壊死に陥りやすく,汚濁壊死と呼ばれる。

左:胃癌の卵巣転移で,卵巣固有の線維性間質の間に,印環細胞がびまん性から小胞巣状に増殖している。
右:印環細胞は豊富な細胞質内粘液を有する。
印環細胞(signet ring cell)の捺印細胞像では,粘液様物質を背景に,結合性の乏しい腫瘍細胞を認める。(Figure 10.72)。孤立性に出現する異型細胞は核形不整,クロマチン細顆粒状で明瞭な核小体を有する。細胞質は泡沫状で粘液空胞をみる。核は粘液で圧排され偏在傾向を示す。

結合性の乏しい小型腫瘍細胞が,孤立性にみられる。核は粘液で圧排されて偏在傾向を示す。
正常卵巣の卵胞を構成する顆粒膜細胞への分化を示す腫瘍細胞からなる黄色充実性腫瘍で,エストロゲン産生腫瘍としても知られている(Figure 10.73)。莢膜細胞や線維芽細胞が種々の程度に混在するが,顆粒膜細胞が全体の10%以上占めるものをいう。成人型と若年型からなり,多くは成人型である。95%の症例は片側性で,卵巣に限局するI期では,予後は良好であるが,晩期再発をきたすことがあり,基本的には悪性腫瘍である。成人型に比べ,若年型は細胞異型を示すも予後は良好である。

腫瘍の大きさは様々であるが,肉眼的特徴として片側性の黄色充実性の軟らかい腫瘍で,嚢胞形成や出血を伴う。
特定の構築を取らずにシート状に増殖することが多く,核が長軸に対して垂直に配列する索状構造(trabecular pattern)は本腫瘍に特徴的である。最も特徴的なのは腫瘍細胞がロゼット状に配列する構造であり,中央に好酸性基底膜様物質がみられる場合は,Call-Exner bodyと呼ばれている(Figure 10.74)。腫瘍細胞は比較的均一な小型の明調な核を有し,胞体は不明瞭である。核は円形から楕円形でコーヒー豆様の核溝を有する。成人型顆粒膜細胞腫の診断において,これらの所見は重要な手がかりとなるが,若年型では,Call-Exner bodyを欠くことが多く,核溝は目立たないので,注意が必要である。免疫組織化学染色では,性索間質系マーカーであるinhibin α,calretinin,CD99が陽性となる。最近使用されるようになってきたforkhead box L2(FOXL2)は顆粒膜細胞腫の97%に陽性で,核に陽性を示す10)。

細胞の境界が不鮮明で,好酸性基底膜様物質を取り囲む小濾胞構造(Call-Exner body)や核溝が観察される。
捺印細胞診では,組織像を反映し比較的小型で均一な細胞が,結合性の緩い集塊やシート状および孤立散在性に観察され,時に索状配列や濾胞状配列がみられる。腫瘍細胞はN/C比が高く,細胞質は薄く乏しい。核は類円形または楕円形からなり,核縁は菲薄,クロマチンは微細顆粒状で,比較的均一な分布を示し,小型核小体をもつ。核の長軸にそって特徴的な溝が認められる(Figure 10.75)。また,ライト緑好性(Giemsa染色で異染性)の基底膜様物質を含む小濾胞構造(Call-Exner body)が認められる。

腫瘍細胞は小型円形でN/C比が高く,シート状ないし孤立性に出現し,核は類円形で一部にコーヒー豆状の核溝を認める。
腫瘍細胞が卵黄嚢や内胚葉方向への分化を示し,α-フェトプロテイン(AFP)を産生する腫瘍11)で,血清AFPが高値となる(Figure 10.76)。20代前後の若年者に好発する腫瘍であるが,現在は化学療法感受性が高く,予後が著しく改善し,良好なことが多い。

片側性であることが多い腫瘍で腫瘍割面は黄白色,充実性で軟らかく,出血や壊死,大小の嚢胞を伴うことが多い。
同一腫瘍内でも多彩な組織構造を示すが,ほぼ全ての卵黄嚢腫瘍で出現する最も基本的なものは,微小嚢胞状・網状構造である。扁平な腫瘍細胞が糸のように繊細な細胞質を伸ばして微小嚢胞や網目をつくり,クモの巣のようにみえる。しばしば細胞の内外に好酸性の硝子球hyaline globuleを伴うことが多い。また,腫瘍細胞が血管結合織を中心に増殖し,その周囲に空隙が生じると,腎臓の糸球体に類似したSchillar-Duval小体を形成することがある(Figure 10.77)。卵黄嚢腫瘍と明細胞癌は,いずれも明調な細胞を構成要素として含み,両者は酷似することがある。しかしながら,両者の治療法と予後は全く異なるため,鑑別は極めて重要である。免疫染色による鑑別では,AFPやSALL4が有用であるとされ,卵黄嚢腫瘍では,AFPが細胞質に,SALL4が核に陽性となることが知られている(明細胞癌ではいずれも陰性)12)。

扁平な腫瘍細胞が糸のように繊細な細胞質を伸ばして微小嚢胞や網目をつくる。細胞内外には,エオジン好染の硝子球や,血管周囲に腫瘍細胞が増殖し,Schillar-Duval 小体を形成する。
捺印細胞標本における腫瘍細胞は,出血壊死性や粘稠性の背景に,不規則な重積性を伴う大小の集塊,シート状集塊,孤立性などでみられ,多彩な構造をとる。細胞質は明るくグリコーゲンや脂肪に富むため,ライト緑淡染性となる。核は偏在し,核縁は薄く,核クロマチンは細顆粒状で,明瞭な核小体を伴う。腫瘍細胞の細胞内外には,好酸性の硝子球(Figure 10.78)を認めることがあり,診断の一助となりえる。この硝子球はPAS染色陽性で,ジアスターゼ消化抵抗性を示す。

比較的豊富なライト緑淡染性の細胞質を有し,核は偏在性で,明瞭な核小体を伴う。腫瘍細胞の細胞内外には,好酸性の硝子球を認めることが多い。
卵巣の未分化胚細胞腫は始原生殖細胞に類似した幼若な細胞から発症する悪性腫瘍で組織像は精巣のseminomaや,松果体など中枢神経のgerminomaと同様である(Figure 10.79)。本腫瘍は悪性胚細胞腫瘍の代表的な腫瘍で,思春期,性成熟期の若い女性に好発する。血中の乳酸脱水素酵素(lactate dehydrogenase; LDH)値が上昇し,また,血清ヒト絨毛性腺刺激ホルモン(hCG)が上昇することもある。早期の場合,予後は比較的良好で,放射線療法や化学療法に高感受性である。

両側性が約15%に認められる腫瘍で大きさは様々であるが,肉眼的特徴として厚い被膜を有する腫瘍で割面は灰白色を呈し,充実性髄様に膨張している。
大型の腫瘍細胞と浸潤性リンパ球からなるtwo cell patternを示す(Figure 10.80)。シート状に増殖することもあるが,索状や島状に配列することもある。腫瘍細胞には1~数個の核小体が目立つ大型核が認められ,核分裂像も多い。細胞質はグリコーゲンが豊富なため淡明で,PAS染色陽性である。免疫組織化学染色では,KIT(c-kit,CD117),PLAP,PDPN(D2-40)などが陽性となり,病理診断に頻用される。

リンパ球が介在性に浸潤し,大型の腫瘍細胞と2相性のtwo cell patternを示す。腫瘍細胞は大型で細胞質は明るく核小体が目立つ。
N/C比の極めて高いほぼ円形の腫瘍細胞がシート状あるいは孤立性にみられる。核は円形,類円形,桿形で核縁は軽度~中等度肥厚,クロマチンは粗網状~粗大顆粒状,1~数個の明瞭な核小体を有するのが特徴的で,核分裂像も認められる。組織像と同様,背景の小型リンパ球とともに,2相性のtwo cell patternの細胞像を呈す(Figure 10.81)。

小型リンパ球と胚細胞に類似した大型の腫瘍細胞が認められ,2相性のtwo cell patternを示す。1~数個の明瞭な核小体を有し,場所により核分裂像が認められる。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
加藤 智美(埼玉医科大学国際医療センター)…I, II
安田 政実(埼玉医科大学国際医療センター)…I, II
丸川 活司(北海道医療大学)…III
恩田 千景(北海道大学病院)…III
担当編集委員滝野 寿((一社)日本臨床衛生検査技師会)