食道の非腫瘍性病変は形成・形態・機能異常,循環障害,炎症に分けられ,食道裂孔ヘルニア,食道アカラシア,食道静脈瘤などが重要である。逆流性食道炎では,胃内容物の逆流により下部食道の粘膜が傷害され,食道胃接合部から連続的に重層扁平上皮が円柱上皮粘膜に化生することがあり,バレット上皮といわれる。悪性上皮性腫瘍として扁平上皮癌と腺癌がある。扁平上皮癌が日本では食道癌の90%以上を占める。腺癌のほとんどはバレット上皮から発生する。胃は食道と十二指腸との間に位置する嚢状の臓器で,食物の一時的貯蔵や攪拌だけでなく,胃液を分泌して消化するとともに,消化に関連する諸種のホルモンを出す。胃壁は消化管のほかの部位と同様に,粘膜,粘膜下組織,筋層,漿層の4層から構成されている。組織表面が局所的に欠損して陥落した病変を潰瘍という。粘膜に傷はあるが,粘膜下層にまでは傷が達していない状態を「びらん」と呼ぶ。ヘリコバクター・ピロリ胃炎は日本で最も多い胃炎で,慢性持続性感染により慢性胃炎にいたることが明らかになっている。胃の悪性上皮性腫瘍の大部分が癌腫(腺癌)で,悪性非上皮性腫瘍では悪性リンパ腫,消化管間質腫瘍などが発生する。大腸は盲腸,上行結腸,横行結腸,下行結腸,S状結腸,直腸の6つに区分される。大腸の粘膜は盲腸から直腸まで同様で,粘膜筋板は大腸粘膜に目立つ構造で,規則的な収縮により,粘液を分泌し糞便を押し出す。吸収上皮細胞と,粘液分泌性の2種類の杯細胞が存在し,その2種類の細胞が管状腺あるいは陰窩を形成し,粘膜筋板付近まで達する。大腸の病変としては,形態・機能異常であるヒルシュスプルング病,循環障害である虚血性腸炎,炎症性病変,腫瘍性病変(上皮性,間質性,悪性リンパ腫)がある。
Esophageal nonneoplastic lesions are classified into those causing dysplasia, malformation, dysfunction, circulatory disorder, and inflammation. Among nonneoplastic lesions, those causing esophageal hiatus hernia, esophageal achalasia, and esophageal varix are particularly important. The mucous membrane of the lower esophagus of the patients with reflux esophagitis is damaged by the reflux of gastric contents and the stratified squamous epithelium continuously metamorphoses into a columnar mucosal epithelium called Barrett’s epithelium, from the site of an esophagogastric junction. Squamous carcinoma and adenocarcinoma are malignant epithelial tumors. In Japan, squamous carcinoma accounts for ≥90% of the cases of esophageal cancer. Most adenocarcinomas originate from Barrett’s epithelium. The stomach is a saclike organ located between the esophagus and the duodenum. The stomach temporarily stores and mixes ingested food, digests them with gastric juices, and secretes various hormones that promote digestion. Similar to other digestive tracts, the walls of the stomach consist of four layers: the mucous membrane, submucosa, gastric muscularis, and gastric serosa. Gastric ulcer refers to a partial defect and break of the inner surface of the stomach. Gastric erosion refers to the state in which the mucous membrane is damaged, but it does not reach the submucosa. Most cases of gastritis in Japan are caused by Helicobacter pylori infection. It was found that chronic persistent infection with H. pylori leads to chronic gastritis. Most of the gastric malignant epithelial tumors are carcinoma (adenocarcinoma). Malignant lymphoma and gastrointestinal stromal tumor are malignant nonepithelial tumors. The large intestine is divided into six sections: the cecum, ascending colon, transverse colon, descending colon, sigmoid colon, and rectum. The characteristics of the mucous membrane are similar throughout the large intestine from the cecum to the rectum. The muscularis mucosa is a characteristic structure of the large intestine. This layer regularly contracts to secrete mucus and excrete stool. There are two types of germ cell in the large intestine: absorptive epithelial cells and mucus-secreting cells. These types of germ cell form tubular glands or crypts, which reach the muscularis mucosa. Lesions of the large intestine include those causing Hirschsprung’s disease, a morphological and functional disorder; ischemic enteritis, a circulatory disorder; inflammation; and tumors (endothelial tumor, interstitial tumor, and malignant lymphoma).
食道静脈瘤は,食道の粘膜下層に静脈が拡張蛇行して瘤状に隆起したもので,門脈系の閉塞機序に伴う門脈圧の亢進により生じる。原因としては肝硬変が最も多い1)~4)。
2) 組織学的所見食道粘膜下組織の静脈が著明に拡張し,血管壁も肥厚している(Figure 2.1–2.4)1)~4)。

血管内腔の拡張。

血管内腔の拡張。

血管壁の肥厚。

内膜の線維性肥厚。
噴門括約筋の一過性弛緩により胃液が食道に逆流する病態は胃食道逆流症(gastroesophageal reflux disease; GERD)と呼ばれ,食道粘膜に炎症が認められるものを逆流性食道炎という。下部食道に好発する。
2) 組織学的所見重層扁平上皮の基底側過形成,粘膜固有層乳頭の上昇(上皮の厚さが50%以上),基底細胞層の肥厚(上皮全層15~25%以上)および上皮下の粘膜固有層には好中球・好酸球の混在した炎症細胞浸潤,血管の拡張・増生が認められる(Figure 2.5–2.8)1)~3),5)。

重層扁平上皮の基底側過形成がみられる。

乳頭層の上昇がみられる。

基底細胞層の肥厚をみる。

上皮への好酸球浸潤。
バレット食道は食道下部粘膜が噴門と連続して全周性に円柱上皮で覆われた状態である。診断基準として,
・食道胃接合部より口側へ連続性に3 cm以上の置換された円柱上皮細胞の広がり(Figure 2.9)

既存の扁平上皮細胞と置換された円柱上皮細胞を認める。
・病変部粘膜下組織に固有食道腺の存在(Figure 2.10)

円柱上皮下の粘膜層に固有食道腺を確認できる。
・粘膜筋板が2層構造
・病変部より肛門側に円柱上皮内の扁平上皮島の存在(Figure 2.11)

円柱上皮内の扁平上皮島の存在を確認できる。
などがある。
2) 組織学的所見構成される細胞成分により,①噴門腺移行型,②萎縮状胃底腺型,③腸上皮化生型に大別される。このうち③型は絨毛状表面構造,粘液腺および杯細胞よりなり,最も多い型である1)~6)。また,腺癌発生の危険性が高い病変と考えられている(Figure 2.12)。

バレット上皮を発生母地として発生した腺癌を認める(バレット腺癌)。
異所性胃粘膜は,頸部食道で10~20%の頻度でみられる。
胎生初期の食道粘膜は円柱上皮で覆われているが,発生の過程で中部から上下方向に扁平上皮に置換されていく。この置換が不完全な場合,下部では先天性バレット食道となり,上部では異所性胃粘膜として遺残する1)~3)。
2) 組織学的所見組織像は,胃底腺型か胃噴門腺型,あるいは両者の移行型の胃粘膜からなり,内分泌細胞や杯細胞を伴うこともある(Figure 2.13, 2.14)1)~3)。

胃粘膜の遺残がみられる。

胃粘膜の遺残がみられる。
平滑筋腫は良性非上皮性腫瘍の中で最も多く,粘膜筋版や固有筋層,血管平滑筋に由来し,発生部位としては下部が約半数を占める1)~4)。
2) 組織学的所見粘膜下腫瘍を形成する(Figure 2.15)。豊富な縦走性筋原線維を含む好酸性細胞質と桿状あるいは柵状の核を有する紡錘形平滑筋細胞の交錯する束からなる(Figure 2.16, 2.17)1)~3),6)。腫瘍細胞の異型性は弱く,多形性や核分裂像はみられない。免疫染色では平滑筋マーカーであるα-smooth muscle actin(SMA)・desminが陽性を示すが,CD117(KIT),CD34,S-100蛋白はいずれも陰性を示す(Figure 2.18)5)。

粘膜下腫瘍をみる。

好酸性の紡錘形細胞が交錯している。

好酸性の紡錘形細胞が交錯している。

細胞質に陽性を示す。
食道の悪性腫瘍は90%以上が扁平上皮癌で,中部から下部食道に多く発生する。リンパ節転移の有無を問わず,癌腫の壁深達度が上皮内,粘膜固有層あるいは粘膜下層までのものを表在癌という5),6)。
2) 組織学的所見異型細胞が充実性胞巣を形成し,重層扁平上皮への分化を示す癌であり,角化(個細胞角化,癌真珠)と細胞間橋が特徴的である。また胞巣中心部に向かう層状分化を示す。食道癌取扱い規約では角化傾向と層状分化を指標として,高・中・低分化に亜分類すると定められている(Figure 2.19, 2.20)6)。高分化型は広範囲(癌面積の3/4以上)にわたり層状分化と角化が認められる癌で,低分化型とはそれらが殆どみられない癌を指す1)~4)。

異型細胞が充実性胞巣を形成している(高分化扁平上皮癌)。

角化を認める。
急性胃炎は胃粘膜の急激な炎症性変化であり,原因としては薬剤や化学物質,真菌・細菌感染など多様である。腹痛,嘔吐,出血などの症状を伴う。
2) 肉眼的所見粘膜の充血や出血,浮腫,びらんを認める。原因が強い組織障害作用を伴う薬品などである場合は粘膜の高度な壊死を伴う場合がある。
3) 組織学的所見好中球浸潤を中心とする一過性の胃粘膜の炎症とされる2)。病変は軽症型では粘膜の軽い充血と浮腫がみられ,粘膜固有層の表層に好中球を主体とする炎症細胞浸潤がある(Figure 2.21, 2.22)1)~4)。

胃粘膜に出血や好中球浸潤を認める。

胃粘膜好中球浸潤を認める。
アニサキス症は最も頻度の高い寄生虫症である。
アニサキス幼虫による幼虫移行症。サバやサケなどの海産物を生食した時に,胃壁や腸壁に侵入し,激痛を伴う7)。
2) 肉眼的所見内視鏡検査等で,胃粘膜に穿入する2~3 cmの虫体を認める(Figure 2.23)。

胃粘膜に穿入する虫体をみる。
アニサキス属の内腔はY字型をしている特徴がある(Figure 2.24)。虫体の刺入部の周囲粘膜は急性胃炎像を示す。好酸球の目立つ著明な炎症細胞浸潤がみられる(Figure 2.25, 2.26)4),7),8)。

虫体のY字型の内腔が確認される。

虫体の横断面。

虫体周囲に好酸球浸潤をみる。
慢性胃炎は,成因は大部分がヘリコバクター・ピロリ(Helicobacter pylori; HP)の慢性持続性感染により慢性胃炎にいたることが明らかになっている。その他の原因として化学物質や自己免疫などがある。
2) 肉眼的所見慢性活動性炎症が持続すると胃粘膜は萎縮した像を呈する(Figure 2.27)。

萎縮した粘膜がみられる。
腺管密度が低下し,粘膜の丈が低くなり,慢性萎縮性胃炎といわれる状態になる(Figure 2.28)3)。腸上皮化生には小腸型の吸収上皮,杯細胞とパネート細胞が出現する完全型(小腸型)腸上皮化生と,それらが揃わない不完全型腸上皮化生(胃腸混合型化生)がある1)。

非萎縮性胃炎。
現在では胃炎の分類として,病因,広がり,組織形態学的変化を含んだシドニー分類を用いるのが一般的である2)。組織形態学変化は,
① 採取部位
② HPの有無
③ 慢性炎症細胞浸潤(Figure 2.29)
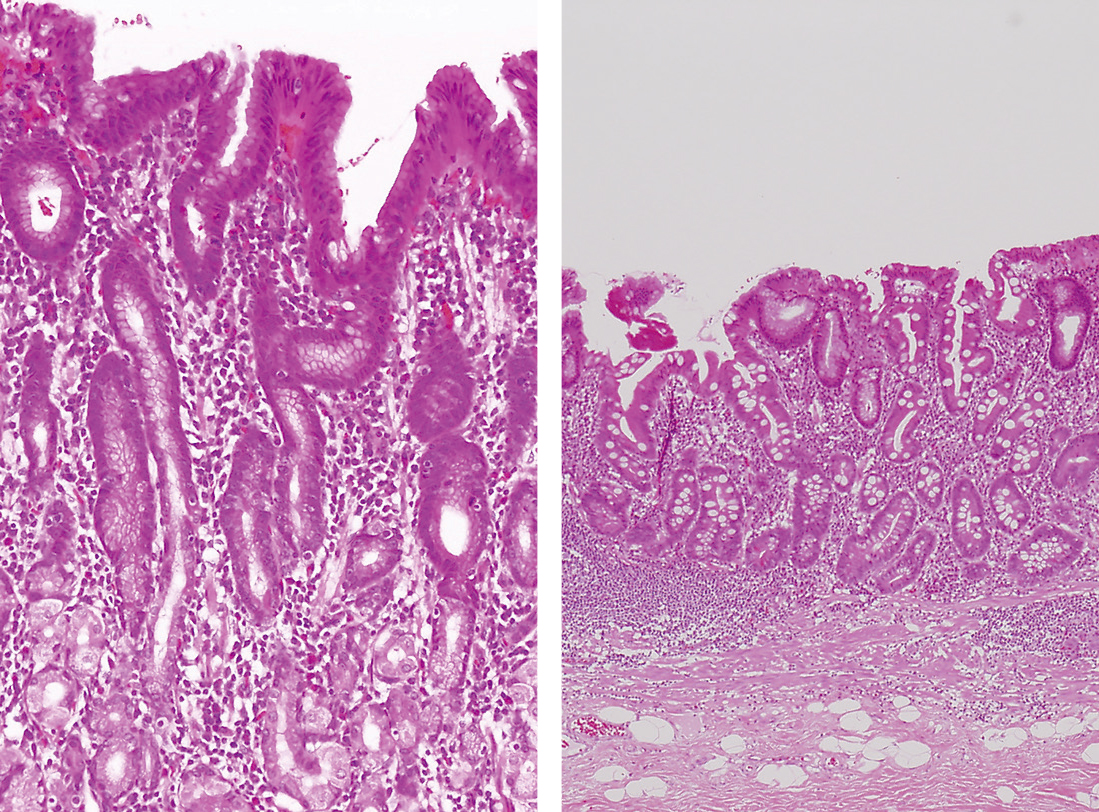
(左)10× 粘膜表層部への炎症細胞浸潤。
(右)4× 萎縮性胃炎(胃底腺の萎縮)。
④ 好中球浸潤
⑤ 萎縮(Figure 2.29)
⑥ 腸上皮化生の程度(Figure 2.30)

腸上皮化生(完全型)。
を判定する。
4. ヘリコバクター胃炎(Helicobacter pylori) 1) 概要ヘリコバクター・ピロリ胃炎は日本で最も多い胃炎である。ヘリコバクター・ピロリは,強力なウレアーゼ活性を有する約3 μm,4~7本の鞭毛を有するグラム陰性桿菌で,幽門前庭部に感染し,胃全体に広がる。感染経路は経口感染が有力視されている。ヘリコバクター・ピロリの有するウレアーゼ活性により産生されたアンモニアや菌自身が産生するサイトトキシンが粘膜上皮を障害する。
2) 組織学的所見胃粘膜表層部の腺窩上皮(表層粘膜細胞)に付着している粘液内に生着する(Figure 2.31)1)。初感染が成立すると急性胃炎が生じ,粘膜固有層内から上皮内に好中球,リンパ球,形質細胞などが浸潤する。胃底腺領域で表層部に限局し,幽門腺領域では全層に浸潤する傾向がある。ヘマトキシリン染色を濃く染めておくと,HE染色だけでヘリコバクター・ピロリが観察しやすい。除菌後の症例などではヘリコバクター・ピロリの有無が確定しにくい場合は特殊染色を追加する。追加染色には,通常はギムザ染色を行うが,ワルチン・スターリー染色やトルイジン青染色(pH 7.0)を行うこともある(Figure 2.32–2.34)。

粘液内や胃腺窩上皮の表面に短桿状の細菌ヘリコバクター・ピロリを認める。



びらんは急性炎症の結果あるいは壊死組織の脱落により組織表面が局所的に欠損して陥落した病変を潰瘍という。消化液による自己融解で生じる組織欠損を消化性潰瘍として包括される。粘膜に傷はあるが,粘膜下層にまでは傷が達していない状態を「びらん」と呼ぶ。
2) 肉眼的所見潰瘍縁の不整さに乏しい円形~楕円形であり,1~3 cm程度の粘膜が欠損している(Figure 2.35)。

白斑としてみられ,出血を伴うこともある。
消化性潰瘍(UL)の深さ(組織欠損の程度)によりUL-IからUL-IVと4段階に分類するが(村上分類),びらんはUL-Iに相当する(Figure 2.36)2)。一般的にはUL-II~IVを潰瘍とする。粘膜表層組織の欠損はみられ,出血をともなっている(Figure 2.37, 2.38)1),3)。


粘膜表層の脱落がみられる。

出血を伴っている。
過形成性ポリープは,胃のポリープで最も多いタイプである。胃粘膜の増生からなるポリープで,通常ヘリコバクター・ピロリ胃炎を背景とした炎症性反応による再生性変化により生じる良性病変である2)。単発あるいは多発し,大半は前庭部に発生するが,胃体部にも多い。大きなもの(1 cm以上)で癌を併存することがある。
2) 肉眼的所見小型のものは無茎性であるが,大型では有茎性,かつ分葉状となり赤色調を呈する(Figure 2.39, 2.40)。

赤色調を呈する。

大きなものは有茎性となる。
過形成性の腺窩上皮の増生からなる腺窩上皮型のポリープで,通常は表面にびらんを伴い,浮腫性で血管豊富な間質,肉芽組織の増生や炎症細胞浸潤を伴う(Figure 2.41, 2.42)1)~4)。

腺窩上皮の過形成性がみられる。

浮腫性で炎症の強い粘膜固有層がみられる。
胃底腺ポリープはヘリコバクター・ピロリのいない(H. pylori陰性)胃粘膜に派生する良性病変である。家族性大腸腺腫症に伴って100個以上多発することもある。βカテニンの変異を高頻度に認めることがある。また,強力な制酸作用を示すプロトンポンプ阻害薬の長期薬投与とその発生との関連もいわれている。
2) 肉眼的所見胃底腺領域に単発または多発する通常5 mm以下の無茎ないし亜有茎性の半球状ポリープとして出現する。表面は平滑で,変色を示さない(Figure 2.43)。

平滑で変色を示さない。
表面は腺窩上皮に覆われ,胃底腺の増生・構築異常と部分的な嚢胞状拡張が特徴的なポリープである(Figure 2.44, 2.45)1),2),4)。胃底腺が粘膜表層近くまで増生し,胃小窩や腺頸部は短縮している。間質は乏しく,炎症像もほとんどみられない(Figure 2.46)3)。

胃底腺組織の過形成と小嚢胞化がみられる。

胃底腺組織の嚢胞状拡張がみられる。

炎症像はほとんどない。
胃腺腫は,境界明瞭な良性上皮性腫瘍で,軽度の腫瘍性異型を示す腸上皮化生に類似した腺管から形成される腸型腺腫と頸部粘液細胞や幽門腺に類似した円柱細胞からなる管状構造で形成される胃型腺腫がある。腸型あるいは胃型が主体の粘膜内非浸潤性腫瘍と定義される。
2) 肉眼的所見腸型管状腺腫:扁平ないしドーム状の境界明瞭な隆起を形成し,表面は粗大顆粒状である(Figure 2.47)。前庭部に好発する。

隆起性病変。多結節状。
胃型管状腺腫:ドーム状の境界明瞭な隆起を形成し,表面は平滑である。胃上部に好発する。
3) 組織学的所見腸型管状腺腫:小腸上皮への分化を示す異型細胞で,好酸性細胞質をもつ吸収上皮型細胞と杯細胞型細胞からなる高円柱細胞が管状に増殖する(Figure 2.48, 2.49)。免疫染色では吸収上皮型と杯細胞型の腫瘍細胞がそれぞれCD10(刷子縁に陽性:Figure 2.50)とMUC2(杯細胞に陽性)に染色される。

腺管の密な増生がみられる。

核は基底層に規則正しく整列している。

吸収上皮型細胞の刷子縁に陽性となる。
胃型管状腺腫:淡明な粘液性の細胞質をもつ丈の低い円柱細胞からなる嚢胞状~管状腺管が狭い間質を挟んで密に増殖する。免疫染色では最表層以外の腫瘍腺管がMUC6に染まるのが特徴的である。
9. 早期胃癌(early gastric cancer) 1) 概要胃の悪性上皮性腫瘍の大部分が癌腫(腺癌)である。胃は上部,中部,下部の3領域に区分されるが,胃癌は下部に最も多く,次いで中部,上部の順である。
早期胃癌は「癌の局在が粘膜または粘膜下層にとどまるもので,リンパ節転移の有無は問わない」と定義されている2)。
2) 肉眼的所見肉眼型は,「胃癌取扱い規約」では0~5型に分類されており,粘膜表面から観察して病変の肉眼的形態が軽度な隆起や陥凹を呈するにすぎない表在型を0型,進行型を1型から5型に分類する9)。表在型は日本内視鏡学会1962年を参考に0-I型~0-III型に亜分類されている。進行型はボールマン(Borrmann分類)に準拠している。5型は0~4型のいずれにも分類できない,分類不能型としている(Figure 2.51)。胃癌の場合,癌が発生してからの期間や大きさは規定要因ではなく,癌の浸達度(浸潤の深さ)が規定因子である。

早期胃癌は0型に分類される。
早期胃癌は,肉眼型分類では0型に分類され,軽度な隆起や陥凹,平坦な形態を呈している(Figure 2.52)。

表面隆起型(左)表面平坦型(右)。
組織型分類の基準は下記に基づいている。
① 高頻度に出現する腺癌を一般型とし,その他を特殊型とする。
② 悪性上皮性腫瘍を亜分類するときは,量的に優勢な組織像に従う。異なる組織型を含む場合(組織混在型)は優勢像から列記する。
③ 低分化腺癌は充実型と非充実型に亜分類する。
④ 一般型の胃癌の一部に特殊型の組織像がみられるものは,その旨を必ず診断に付記する。
⑤ 癌に腺腫,腫瘍様病変あるいは消化管ポリポーシスが併存するものは,その旨を診断に付記する。
⑥ 分化型と未分化型に二大別分類することがある。
癌の局在が粘膜にとどまっており,癌腺管は,円柱上皮あるいは立方上皮から構成されている(Figure 2.53, 2.54)1),3),4)。

単純な管腔構造からなる(管状腺癌)。大型核が混在し,極性の乱れが目立つ。

癌の局在が粘膜にとどまっている。腺腫以上の細胞異型・構造異型がみられる。
胃の悪性上皮性腫瘍の大部分が癌腫(腺癌)である。進行癌は癌の大きさにかかわらず,胃癌細胞が固有筋層より深く浸潤したものである(Figure 2.55)。進行癌は肉眼的に以下のように分類されている1),2)。

進行癌は1~5型に分類される。
・1型(腫瘤型):周囲と明らかな境界をもって隆起した病変。
・2型(潰瘍限局型):潰瘍を形成し,潰瘍を取り巻く胃壁が肥厚し周囲粘膜との境界が比較的明瞭な周堤を形成した病変。
・3型(潰瘍浸潤型):潰瘍を形成し,潰瘍を取り巻く胃壁が肥厚し周囲粘膜との境界が不明瞭な周堤を形成した病変。
・4型(びまん浸潤型):著明な潰瘍や周堤もなく,胃壁の肥厚・硬化を特徴とし,病巣と周囲との境界が不明瞭な病変。
・5型(分類不能型):1~4型に分類できないもので,進行癌と表在癌の混合したものや化学療法後の複雑な形態を示す病変。
3型が最も多く進行胃癌の50%前後を占め,次いで2型が多く,1型と4型はまれで数%にすぎない。
組織学的に一般型と特殊型に分類し,一般型には乳頭腺癌,管状腺癌(高分化,中分化),低分化腺癌(充実型,非充実型),印環細胞癌と粘液癌がある。
2) 肉眼的所見潰瘍浸潤型(3型)は潰瘍を形成し,潰瘍を取り巻く胃壁が肥厚し周囲粘膜との境界が不明瞭な周堤を形成している(Figure 2.56)。

潰瘍浸潤型。潰瘍を形成し,周囲粘膜との境界が不明瞭。
癌の大きさにかかわらず,胃癌細胞の壁深達度が固有筋層以深に及んでいるものを示し,乳頭状あるいは絨毛状構造を呈する乳頭腺癌や円柱上皮あるいは立方上皮が明瞭な腺腔形成を示す管状腺癌などがある(Figure 2.57, 2.58)3),4),10)。

乳頭腺癌。癌組織は主として円柱上皮からなり,乳頭状あるいは絨毛状構造を示す。

管状腺癌。円柱上皮あるいは立方上皮から構成され,腺管形成が明瞭。
悪性上皮性腫瘍の大部分が癌腫(腺癌)である。組織学的に一般型と特殊型に分類し,高頻度に出現する腺癌が一般型で,その他が特殊型である。胃癌は組織像が多彩で,同一病変内で異なる組織型を示すことが多い。特殊型として,カルチノイド腫瘍,内分泌細胞癌,リンパ球浸潤癌,肝様腺癌,腺扁平上皮癌,扁平上皮癌,未分化癌,その他の癌が分類されている。
2) 組織学的所見通常粘膜下層以深にみられる。腫瘍が小型で均一な細胞からなり,充実性,索状,リボン状,時にロゼット様あるいは腺管様の構造をとる(Figure 2.59, 2.60)1),2)。細胞質内に,グリメリウス染色およびマッソンフォンタナ染色で好銀性顆粒あるいは銀親和性顆粒が証明される(Figure 2.61)。免疫組織化学的には,クロモグラニンA,シナプトフィジン,CD56等が陽性となる(Figure 2.62)1),3),4)。

充実性,小胞巣状に増生。

均一な大きさで,淡明な細胞質を有し,核は類円形を示す。

細胞質内に好銀性顆粒がみられる。

両染色ともに,細胞質内に顆粒状に陽性を示す。
胃の悪性非上皮性腫瘍では悪性リンパ腫,消化管間質腫瘍などが発生する。消化管はリンパ組織の発達が良好で,その頻度は節外性リンパ腫中,最も頻度が高い2)。胃悪性リンパ腫の組織分類はWHO分類に従い,ほとんどはB細胞リンパ腫であり,T細胞リンパ腫はきわめてまれである。多くは粘膜関連リンパ装置(mucosa-associated lymphoid tissue; MALT)に由来し,MALT型リンパ腫と呼ばれる1),2)。
2) 組織学的所見小型~中型のリンパ腫細胞が主に粘膜固有層で増殖する(Figure 2.63–2.65)。形質細胞へ分化を示すものも多い。またびまん性大細胞型B細胞性リンパ腫は正常リンパ球の2倍以上の大きさを示すリンパ腫細胞が増殖しCD20を発現する(Figure 2.66)1),3),4)。

粘膜固有層内にリンパ腫細胞がびまん性に認められる。

小型~中型のリンパ腫細胞が認められる。

大型リンパ球のびまん性浸潤も認められる。

大型リンパ球が陽性を示す。
H. pyloriとの関連が言われており,除菌により寛解する症例が多数あることが知られている。しかし除菌抵抗性を示すものもあり,化学療法や放射線療法が施行される。
また,t (11;18) (q21;q21) (API2-MALT1) 等の染色体異常や遺伝子異常が報告されている1)。
13. 消化管間質腫瘍(gastrointestinal stromal tumor; GIST) 1) 概要胃の悪性非上皮性腫瘍では悪性リンパ腫,消化管間質腫瘍などが発生する。消化管の間葉系腫瘍は,かつては平滑筋系腫瘍(平滑筋腫,平滑筋芽腫,平滑筋肉腫)が大部分を占めると考えられていたが,近年の研究から80%以上が消化管間質腫瘍(gastrointestinal stromal tumor; GIST)であることが判明した2)。
GISTは胃や小腸を主体として消化管の壁に発生する腫瘍で,筋層内に局在する「カハールの介在細胞(interstitial cells of Cajal)」を起源とする腫瘍である。受容体型チロシンキナーゼであるKITあるいはPDGFR-α(platelet-derived growth factor receptor α:血小板由来増殖因子受容体α)の遺伝子が,機能獲得型の突然変異を来たすことで,増殖に対する異常な信号を出し続けることが主な発生原因である1),2)。
2) 肉眼的所見粘膜下腫瘍形態を示し,大部分は固有筋層から生じる。腫瘍は内腔や漿膜面に圧排性に発育し,通常は境界明瞭である。割面は色調が灰白色調ないし軽度黄色調を帯びる充実性腫瘤で,内部に出血や変性がしばしばみられる(Figure 2.67)。

割面は淡黄色調。腫瘍は粘膜下に存在する。
組織型は紡錘型(60~70%),類上皮型(20~30%),混合型に分けられる。
紡錘型:両端が鈍な棍棒状あるいは葉巻状の核と,弱好酸性細胞質を有する紡錘形細胞が密に束状配列を示して増殖する像を示す(Figure 2.68, 2.69)。

紡錘形の細胞が錯綜している。

好酸性の線維性細胞質を有し,紡錘形の核を有する。
類上皮型:好酸性または淡明化した細胞質を有する類円形細胞が増殖し,びまん性または胞巣状構造を示す。
診断には免疫染色が必須で,CD117(KIT)陽性が一般的であるが,類上皮型の場合ではCD117の発現が減弱することがある(Figure 2.70)。CD117と同様に感度・特異度が高いDOG1やCD34を併用することが診断に有用とされている(Figure 2.71, 2.72)1),3)。

CD117(KIT)陽性を示す。

DOG1陽性を示す。

CD34陽性を示す。
GISTの悪性度(リスク分類)は,腫瘍の発生部位(臓器)および腫瘍最大径,5 mm2あたりの核分裂数,腫瘍破裂の有無の組合せで判定される。
4) 細胞学的所見紡錘型の場合,腫瘍細胞が束状や散在性にみられ,一部重積性を認める。細胞質はライトグリーンに淡染性で線維状である。核は長楕円形で,ねじれや切れ込みを認める(Figure 2.73)。類上皮型の場合は類円形の腫瘍細胞が散在性に出現する(Figure 2.74)4)。

腫瘍細胞が束状や散在性にみられる(左)。細胞質はライトグリーンに淡染性で線維状である。核は長楕円形で,ねじれや切れ込みを認める(右)。

類円形の腫瘍細胞が散在性にみられる。
胃の良性非上皮性腫瘍は,粘膜下腫瘍の形態を示すため鑑別診断が重要である。平滑筋腫が最も多い。発生頻度は一般に低いが,胃は食道に次いで平滑筋系腫瘍が多く発生する。粘膜下層に主座を置くものが多い。平滑筋腫以外では神経鞘腫,顆粒細胞腫,脂肪腫,血管腫,グロームス腫瘍などがあるがいずれもまれである。
2) 肉眼的所見平滑筋腫の割面は唐草模様を示す白色調の硬い腫瘍である11)。
3) 組織学的所見長紡錘形細胞が錯走する細胞束を形成しており,個々の細胞は細線維状,好酸性を示す細胞質を有する(Figure 2.75–2.77)2)。ただし,HE染色標本だけでは,GISTとの鑑別が困難な症例は少なくなく,KIT,desmin,平滑筋マーカーなどの免疫組織化学的検索をすることが望ましい1)~4),11)。α-SMA陽性である(Figure 2.78)。

紡錘形細胞が錯綜している。

核密度は低く,核異型や核分裂像は認めない。

好酸性の細胞質を有する細線維状細胞をみる。

腫瘍細胞は陽性を示す。
胃の良性非上皮性腫瘍は,粘膜下腫瘍の形態を示すため鑑別診断が重要である。平滑筋腫が最も多くが,平滑筋腫以外では神経鞘腫,顆粒細胞腫,脂肪腫,血管腫,グロームス腫瘍などがあるがいずれもまれである。神経鞘腫は固有筋層内に好発する。
2) 組織学的所見腫瘍細胞が卵円形や湾曲した核を有する紡錘形細胞が束を形成しながら不規則に交錯しつつ走行する(Figure 2.79)2)。間質の一部に粘液腫様の変化や不規則に硝子化して肥厚した血管壁などが認められ,リンパ球浸潤を伴うことも特徴の一つである(Figure 2.80)11)。不整な濃染性核と好酸性の細胞質を有する紡錘形細胞がみられる(Figure 2.81)1),3),4),11)。

紡錘形の細胞が錯綜している。

間質内に粘液腫様変化やリンパ球浸潤を認める。

不整な濃染性核と好酸性の細胞質を有する紡錘形細胞が交錯して束状に増殖を示す。
免疫組織化学的には,S-100蛋白陽性である(Figure 2.82)11)。

細胞質に陽性を示す。
大腸と比較すると小腸由来の癌の頻度は低いが,小腸癌の好発部位として十二指腸乳頭部周囲が挙げられる。総胆管と膵臓からの主膵管が,十二指腸壁を抜けて十二指腸内腔へ開口する部位を十二指腸乳頭部と呼び,ここに発生する癌腫を十二指腸乳頭部癌と総称する12),13)。
2) 肉眼的所見肉眼形態の分類はa.腫瘤型(非露出腫瘤型と露出腫瘤型に亜分類される),b.混在型(腫瘤潰瘍型(Figure 2.83, 2.84)と潰瘍腫瘤型に亜分類される),c.潰瘍型,d.その他の型に分類される14)。

本症例は腫瘤潰瘍型で,十二指腸乳頭部付近に周堤を有す潰瘍性病変を認める。

癌は十二指腸壁全層に浸潤し固有筋層をわずかに越える。
腸型と膵胆型に亜型分類され,それぞれの組織分類に準ずる。頻度的には腸型が多く,腸型では中分化または高分化型管状腺癌が多い(Figure 2.85, 2.86)。

青点の範囲で固有筋層をわずかに越えて癌の浸潤がみられる。

中分化型管状腺癌(図中黒線の右側)と低分化腺癌(同左側)が混在している。
粘血便(イチゴゼリー状),下痢,腹痛を主訴とし,大腸に潰瘍を起こす疾患である。好発部位は盲腸と右半結腸,直腸であるが,病巣は全大腸でみられる15)。肉眼的に,粘膜の浮腫,顆粒状変化,点状出血,多発びらんがみられ,潰瘍性大腸炎に類似する16)~18)。
輸入感染症として重要であるが,近年,海外渡航例のない国内感染例も増加している19)。
2) 肉眼的所見・組織学的所見粘膜,潰瘍部表面に融解壊死がみられ,これらの部位に20~30 μmの円形から卵円形の栄養型や嚢子型アメーバがみられる(Figure 2.87)。栄養型は胞体が空胞状または顆粒状を示し,1個の小さな核を有する。赤血球の貪食像がみられることもある(Figure 2.88)。PAS反応陽性を示す(Figure 2.89, 2.90)。生検の際には壊死物質を含む組織採取が必要である。

粘膜表面にアメーバ虫体がみられる。

アメーバ虫体に赤血球の貪食像がみられる。

PAS反応で陽性を示す虫体がみられる。

浸出液中に栄養型アメーバを認める。
本症例は消化管の粘膜下神経叢と筋層神経叢内の副交感神経性神経節細胞が先天的に欠損することにより,蠕動運動が消失し,口側部の腸管が拡張する疾患である20)~22)。生後まもなくから,ガス性の腹部膨満や胎便の排泄遅滞などがみられる23)。
診断には,注腸造影,直腸肛門内圧測定検査,直腸生検が用いられる。
治療としては,神経節細胞のない腸を切除し,神経節細胞のある正常の腸と繋ぐことが必要となる。
2) 肉眼的所見病変部の肉眼像はほぼ正常である。病変部より口側の腸管に拡張,筋層の肥大がみられる。
3) 組織学的所見粘膜下,筋層内の神経節細胞が欠如する代わりに太い神経線維束の増生がみられる(Figure 2.91)。これらの神経線維束はHE染色では観察し難い(Figure 2.92)が,生検組織による凍結切片を用いたアセチルコリンエステラーゼ染色(acetylcholinesterase staining; AchE staining)を実施することにより証明できる(Figure 2.93, 2.94)。

粘膜固有層に神経線維束の増生がみられるが,HE染色では観察し難い。

アセチルコリンエステラーゼ染色では粘膜固有層に太い神経線維束が陽性となるが,HE染色では観察が難しい。

アセチルコリンエステラーゼ染色では固有筋層に太い神経線維束が陽性となる。

粘膜固有層に太い神経線維束の陽性像がみられる。
腺腫の大きさが大きくなると腺癌の発生率が高くなる。腺腫内の一部に腺癌がみられるものを腺腫内癌という。
腺腫性病変内に腺癌組織が共存した腫瘍において腺腫の成分が優勢な病変を腺腫内癌と呼ぶ。
癌腫の成分の方が優勢な場合は「腺腫成分を伴う癌」と呼ばれる24)~27)。
診断としては,拡大内視鏡で癌が疑わしい場合,大きさ等により,通常,ポリペクトミー,EMR,ESDのいずれかを用いて内視鏡的に切除され,組織学的に診断される。
治療は内視鏡的切除の後,定期的な経過観察となる場合が多い。
2) 組織学的所見腺腫内癌は,粘膜内の非浸潤性病変である。紡錘形核を有する高円柱異型細胞が極性を保ちながら管状絨毛に増殖している腺腫の一部に,極性の乱れ,脈管の拡張,蛇行や篩状構造がみられ,腺癌と考えられる部分が存在する28)(Figure 2.95, 2.96)。

大部分は腺腫であるが,一部腺癌がみられる(黒線より上が腺腫部分,下が腺癌部分)。

腺腫内にみられた腺癌の部位(黒線より下が腺癌部分)。
大腸粘膜にびらんや潰瘍を形成する原因不明の炎症性疾患で,活動期active stageと寛解期remission stageを繰り返しながら慢性の経過をたどる。病変は直腸から連続的かつ上行性に広がる(Figure 2.97)。原則的に小腸に病変はみられない29)~31)。

びらん,潰瘍がみられ,ひだが消失している。
頻回の下痢,下血,腹痛が特徴的で,病変の広がりによって直腸炎型,左側大腸炎型,全大腸炎型に分類される28),32)。
2) 組織学的所見粘膜固有層全体に強い慢性炎症細胞浸潤がみられ,腺管(陰窩)が不規則に歪み拡張する(Figure 2.98)。活動期は好中球浸潤が目立ち,拡張した腺管内に膿が溜まる状態(陰窩膿瘍)がみられる(Figure 2.99)。びらんや浅い潰瘍を伴う。陰窩底部と粘膜筋板間に形質細胞を含む炎症細胞浸潤basal plasmacytosisがみられる。

強い慢性炎症細胞浸潤,陰窩の歪みがみられる。

陰窩炎や陰窩膿瘍がみられる。
好発部位は回腸から右側大腸で,深い潰瘍や狭窄を伴う炎症性の疾患である(Figure 2.100)。原因は不明であるが,遺伝的な因子と環境的な因子が関与し,異常な免疫反応が起こると考えられている。

肉眼的に縦走潰瘍がみられる(丸印内)。
10~20歳代に多い。腹痛,下痢,体重減少,発熱,難治性痔瘻などがよくみられる33),34)。
肉眼像で縦走潰瘍や敷石像がみられること,切除組織の所見で非乾酪性類上皮細胞肉芽腫がみられることが主な診断基準とされる35),36)。
完治させる治療法は現在のところ無いが,内科的治療として栄養療法,薬物療法が用いられる。
瘻孔がみられる場合は外科的治療の適用が検討される。
2) 肉眼的所見肉眼的には腸の縦方向(「ひだ」と垂直方向)に潰瘍がみられる縦走潰瘍(Figure 2.100丸印内),敷石像,密集性の炎症ポリープが特徴である。
3) 組織学的所見非乾酪性類上皮細胞肉芽腫を主要所見とし,形質細胞主体の慢性炎症細胞巣が不連続にみられる(Figure 2.101, 2.102)。敷石状外観を示す粘膜では浮腫が強く,肉眼的にも,組織学的にも病変は不連続である(Figure 2.100)。

非乾酪性の類上皮細胞肉芽腫がみられる。

類上皮細胞肉芽腫の組織像。
腹腔内にゼリー状の粘液塊が広がり,その中に上皮性の腫瘍細胞が増殖した状態を指す。粘液性の腫瘍の腹膜播種によるもので,原発巣は卵巣の境界悪性(低悪性度)粘液産生腫瘍(腺腫),粘液性嚢胞腺癌や虫垂の粘液性腫瘍がある37),38)。
長期にわたって増殖を続け,腹腔内に粘稠な粘液が貯留する腹膜癌腫症で,経過が長いため腹部の膨隆がみられることが多い39),40)。
治療法として,全身化学療法は効果が低く,根治は困難である。腹膜切除による腫瘍の完全切除と微小な遺残腫瘍を術中温熱化学療法で治療することが現在では唯一の方法とされている。
2) 組織学的所見腹膜播種部の腫瘍細胞と同様の,粘液産生の豊富な腫瘍細胞がみられる(Figure 2.103)。

背景には多量の粘液がみられ(Figure 2.104),その粘液に浮かぶように小集塊状で腫瘍細胞が出現する(Figure 2.105)。細胞集塊は乳頭状,ボール状,柵状で,PAS反応,アルシアン青染色では,背景の粘液とともに腫瘍細胞の細胞質も陽性を示す(Figure 2.106)。

多量の粘液を背景に腫瘍細胞が小集塊状で出現。

粘液に浮かぶように細胞集塊がみられる。

背景の粘液,腫瘍細胞はともにPAS反応陽性を示す。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
鳥居 良貴(兵庫医科大学病院)…I, II. 1.~15.
中村 純子(兵庫医科大学病院)…I, II. 1.~12, 14, 15.
石田 誠実(兵庫医科大学病院)…I, II. 1.~12, 14, 15.
中西 昂弘(兵庫医科大学病院)…I, II. 1.~12, 14, 15.
佐藤 元(兵庫医科大学病院)…I, II. 1.~12, 14, 15.
廣田 誠一(兵庫医科大学)…II. 13.
林 裕司(滋賀医科大学医学部附属病院)…II. 16., III, IV
担当編集委員白波瀬浩幸(京都大学医学部附属病院)