2022 年 71 巻 J-STAGE-1 号 p. 37-48
2022 年 71 巻 J-STAGE-1 号 p. 37-48
膵臓は,膵管上皮(円柱上皮),ランゲルハンス島,腺房細胞から構成される内分泌と外分泌が存在する臓器である。脂肪も含まれることが多い。膵腫瘍は,膵管から発生する膵管癌(腺癌)が最も多く,次いでランゲルハンス島から発生する神経内分泌腫瘍,腺房細胞から発生する腺房細胞癌があげられる。その他,自己免疫性疾患(IgG4関連疾患),充実性偽乳頭状腫瘍,平滑筋肉腫,転移性膵癌,扁平上皮癌等が認められる。現在,これらの膵腫瘍の診断は,超音波穿刺吸引細胞診検査(EUS-FNA)が広く実施されている。メイ・ギムザ染色迅速簡易法,Pap染色,セルブロックによるHE染色,免疫組織化学染色を実施して確定診断する。膵腫瘍を診断する方法は,主に細胞診検査であり,一部,セルブロックによるHE染色,免疫組織化学染色による組織検査を実施する。よって膵腫瘍の細胞学的特徴及び組織学的特徴を詳細に熟知することが必須である。各染色態度を各疾患別に鑑別できるように知識を習得する。今後,膵腫瘍の特徴を捉えることをしっかり身に着け,鑑別診断できるように学習することが必要である。
The pancreas consists of the pancreatic duct epithelium (columnar epithelium), islets of Langerhans, and acinar cells. It relates to internal and external secretions. The pancreas frequently contains fat. Among pancreatic tumors, the frequency of pancreatic ductal carcinoma (adenocarcinoma) is the highest, followed by pancreatic neuroendocrine tumor forming in islets of Langerhans, and acinar cell tumor. Other pancreatic tumors include autoimmune (IgG4)-related tumors, solid pseudopapillary neoplasm, leiomyosarcoma, metastatic pancreatic cancer, and squamous carcinoma. Endoscopic ultrasonography-guided fine needle aspiration (EUS-FNA) has been widely used for the diagnosis of pancreatic tumors. The definite diagnosis is made by staining techniques, such as rapid and simple May–Giemsa’s staining, Papanicolaou (Pap) staining, and hematoxylin and eosin (HE) staining of cell blocks, and immunohistochemical staining. Cytodiagnosis is mainly carried out for pancreatic tumors. HE staining of cell blocks and histopathological tissue examination by immunohistochemical staining are also carried out for some tissues. Therefore, full and detailed knowledge of cytological and histological characteristics of pancreatic tumors is indispensable for their precise diagnosis. It is important to acquire expertise to distinguish different types of pancreatic tumor from the results of various staining methods. Medical experts are required to understand the characteristics of pancreatic tumors and apply this knowledge to the precise identification of various types of pancreatic tumor.
男性,高齢者に多い。膵以外にも炎症反応が認められる。慢性膵炎の持続で起こり,アルコール性が最も多い1)。
血清IgG4高値となるI型と特異的なIgG4の上昇を認めないII型がある。I型では,IgG4陽性細胞を強拡大で10個以上確認する必要がある1)。II型では好中球浸潤が認められ,IgG4陽性細胞は少ない。膵は線維化が認められることが多い2)。
2) 組織学的所見エオジン好性に線維が染色され,リンパ球,形質細胞が多数認められる(Figure 3.1, 3.2)。炎症反応が強くなると濾胞形成も認められることがある。腺房細胞は,腺房構造が崩れ萎縮している。膵実質内に錯そうする強い線維化が認められる3)。異型細胞は認めない。

HE染色 10×

HE染色 40×
EUS-FNAでは,悪性腫瘍の否定が目的であり,自己免疫膵炎の確定診断にはIgG4の免疫組織染色が必要である。IgG4陽性のリンパ球が強拡大で10個以上認められる(Figure 3.3, 3.4)4)。線維化が高度なとき,穿刺しても検体量が少ない場合がある。EUS-FNAのメイ・ギムザ染色迅速簡易染色では線維が散見され,線維化の中にリンパ球,形質細胞を認める(Figure 3.5, 3.6)。膵管癌でもIgG4陽性細胞は認められることがある3,4)。

免疫組織化学染色 40×

IgG4抗体陽性,陽性細胞が鏡拡大で10個以上の存在。免疫組織化学染色 40×

線維とリンパ球が散見される。メイ・ギムザ染色迅速簡易染色 40×

メイ・ギムザ染色迅速簡易染色 40×
WHO分類では,膵腫瘍は,良性,前がん病変,悪性に分類される5)。IPMNは,膵上皮内腫瘍性病変に属し前がん病変である。異型度により軽度,中等度,高度に分類される。40–50歳代男性に多く認められる。原発性膵腫瘍としては予後良好である。粘液が多量に産生される。しかし,悪性の経過をとることもあり,膵管内浸潤に限局されず,膵実質に浸潤が認められ,リンパ節,肝,腎等に転移を認めることもある5)。
IPMNは,免疫組織学的染色で胃型,腸型,膵胆道型,好酸性型のタイプに分類できる6)。
2) 肉眼的所見粘液産生,出血,一部充実性を有する嚢胞性病変を認める(Figure 3.7)。

粘液を有する軽度異型細胞が認められる。PAS染色陽性を示す。高円柱状の上皮細胞が配列している。通常は嚢胞形成が多数存在する(Figure 3.8, 3.9)。

粘液を有する異型細胞が散見される。HE染色 4×

粘液産生,重積性を認める。軽度異型性を示す。
HE染色 40×
組織球が認められることがある。一般的に膵管癌と比較すると軽度異型は軽く,腺腫と比較すると異型が強い。確定診断には,免疫組織化学染色が必要である。膵胆道型では,MUC5AC,MUC1,MUC6が陽性となる(Figure 3.10, 3.11)。

免疫組織化学染色 10×

免疫組織化学染色染色 20×
膵腫瘍なかで最も多く70%程度を占める。不規則大小不同の異型腺管が多数認められる。膵頭部から発生することが最も多く,炎症細胞浸潤を伴う膵炎を合併していることが多い。浸潤性膵管癌として乳頭腺癌,管状腺癌,低分化型腺癌,腺扁平上皮癌,粘液癌,退形成性膵癌が認められる。
2) 肉眼的所見境界不明瞭な充実性腫瘍が認められる。辺縁には線維化が認められ,白色形態を示す(Figure 3.12)。膵管拡張を認める。

不規則大小不同の異型腺管が多数認められる。個々の細胞は,クロマチン増量,核小体明瞭,粘液産生,N/C比大の細胞である。乳頭状増殖を示し高分化の腺癌である(Figure 3.13)。

不規則な大小不同の異型腺管が認められる。
HE染色 10×
セルブロック法のHE染色(EUS-FNA)では,採取された細胞塊をホルマリン固定してパラフィンブロック作製,薄切,HE染色した標本である。組織構築が正確ではないが不規則大小不同の異型腺管を確認できる(Figure 3.14, 3.15)。
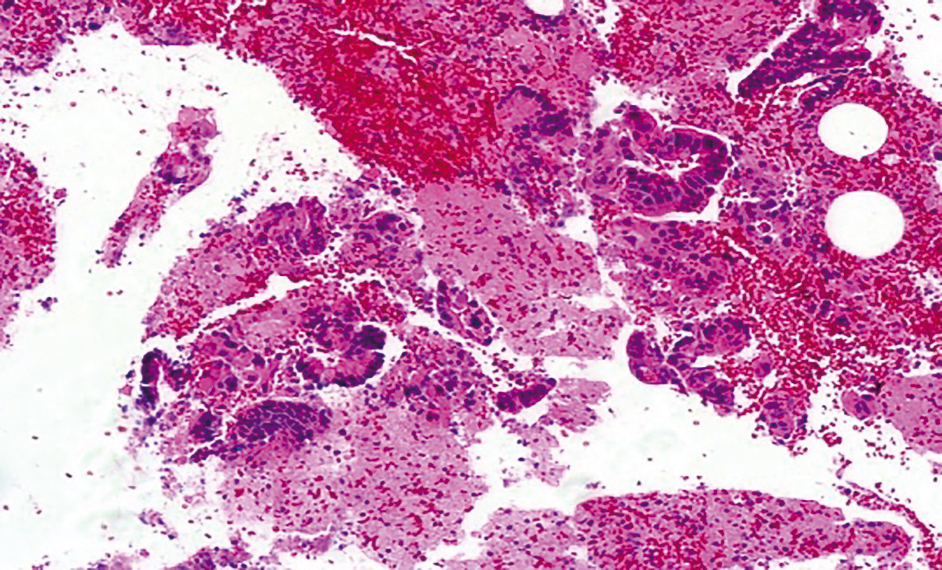
クロマチン増量した異型腺管が認められる。セルブロックHE染色 10×

大小不同,クロマチン増量した異型細胞を認める。
セルブロックHE染色 10×
膵超音波穿刺吸引細胞診(EUS-FNA)で採取された細胞塊の一部を採取して合わせ法で標本作製,乾燥固定した標本をメイ・ギムザ染色迅速簡易染色,アルコール固定した標本をPap染色する3,7)。Pap染色では,核小体明瞭,クロマチン増量した膵管癌(腺癌)である(Figure 3.16)。メイ・ギムザ染色迅速簡易染色では,背景は出血性で極性が乱れ,重積性,クロマチン増量,N/C比大の異型細胞が多数認められる(Figure 3.17)。正常膵管上皮では,核間距離は正常で平面的に出現している(Figure 3.18)8)。

核小体明瞭,クロマチン増量した膵管癌細胞を認める。Pap染色 10×

極性の乱れ,クロマチン増量,N/C比大の膵管癌細胞を認める。メイ・ギムザ染色迅速簡易染色 40×
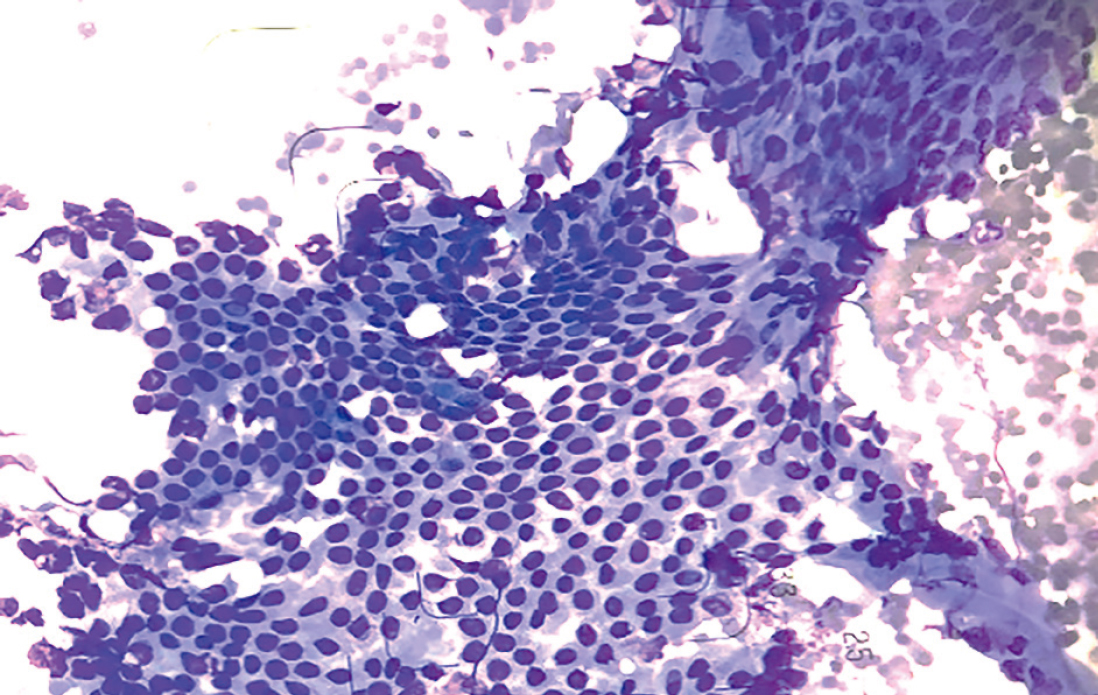
核間距離は等しく,平面的に出現する正常膵管上皮を認める。メイ・ギムザ染色迅速簡易法染色 10×
膵癌取り扱い規約では浸潤性膵管癌に退形成癌として分類されている。巨細胞型,破骨細胞様巨細胞型,多形細胞型,紡錘細胞型に分類される。WHO分類ではundifferentiated carcinomとanaplastic carcinomaは同一の疾患を指す分類名として用いられている。高齢者に多く,きわめて予後不良である。発生は浸潤性膵管癌の約0.2%である9)。
2) 組織学的所見腫瘍細胞は結合性に乏しく,強い異型性を示す。紡錘形細胞が散在性に出現する。核小体明瞭,クロマチン増量が認められ,異型性の強い巨細胞,核分裂像が認められる。肉腫様形態を示すこともある(Figure 3.19, 3.20)。

HE染色 10×

セルブロック HE染色 10×
EUS-FNAの細胞診検査では,多核巨細胞,紡錘細胞,細胞分裂像を有する異型の強い細胞を認める(Figure 3.21, 3.22, 3.23)。On-siteでのメイ・ギムザ染色迅速簡易染色での細胞診断は比較的容易である10)。Pap染色においても大小不同の異型細胞,多核細胞が認められる(Figure 3.24)。

メイ・ギムザ染色迅速簡易染色 100×

メイ・ギムザ染色迅速簡易染色 10×

メイ・ギムザ染色迅速簡易染色 100×

Pap染色 10×
膵癌取り扱い規約において膵腫瘍の上皮性腫瘍(腺房細胞腫瘍として分類される。外分泌腫瘍である。発生頻度は,外分泌腫瘍の1%程度である。小児から成人までの幅広く発生する。男に多い5)。
神経内分泌腫瘍,充実性偽乳頭状腫瘍;SPNと類似の細胞形態を示す。腫瘍自体は大型で見つかることが多く,周囲との境界は明瞭である。
2) 肉眼的所見中心部に壊死を伴う腫瘍で柔らかい。腫瘍は被膜形成があり,正常膵実質との境界は明瞭である。わずかに出血性壊死を認め淡赤色を呈する(Figure 3.25)。

中心部に出血性壊死を伴い,境界は明瞭である。
腺房構造を有するN/C比の高い短紡錘形の腫瘍細胞を多数認める。細胞密度は高く,細胞集塊周囲に線維成分を認める。腫瘍細胞は,核小体明瞭,クロマチン増量して胞巣状に増殖し腺房形成を呈する(Figure 3.26, 3.27)。

HE染色 10×

HE染色 40×
EUS-FNAの細胞所見では,メイ・ギムザ染色迅速簡易染色,Pap染色では,核小体明瞭,クロマチン増量,N/C比大,重積性を有して腺房構造を呈し,線維も少量認められる(Figure 3.28, 3.29)。

核小体明瞭,クロマチン増量,N/C比大,重積性を有して腺房構造を呈し,線維も少量認められる。
Pap染色 40×

核小体明瞭,クロマチン増量,N/C比大,重積性を有して腺房構造を呈し,線維も少量認められる。
メイ・ギムザ染色迅速簡易染色 40×
免疫組織化学染色においてキモトリプシン抗体,Bcl2抗体が陽性となる(Figure 3.30)11,12)。トリプシン,キモトリプシンは,内分泌腫瘍においても陽性になることがある。鑑別診断には,神経内分泌腫瘍,SPNがあげられる。

キモトリプシンが細胞質に陽性になる。
免疫組織化学染色 40×
EUS-FNAにおいてon-siteで迅速染色を施行し,腺房細胞,SPN,神経内分泌腫瘍を疑ったときは,セルブロックを作製すると免疫組織化学染色を実施することができる13)。
5. 内分泌腫瘍 1) 概要WHO分類では,neuroendocrine tumor(NET):Grade1,Grade2,neuroendocrine carcinoma(NEC)の3タイプに分類されている。内分泌腫瘍の多くの症例は,機能的腫瘍であるが非機能的腫瘍も存在する。血中ホルモンの上昇が認められる機能的腫瘍では,細胞診検査時に内分泌腫瘍の予測は可能である。上昇しない症例では,腺房細胞癌等との鑑別が必要である。いずれにせよ,確定診断には,免疫組織化学染色が必須である。
30歳から60歳くらいに多く認められる。NETの場合は,予後良好であるが,NECは悪性度が高く,転移も認められる。再発例も存在する14)。神経内分泌細胞由来の細胞である。腫瘍細胞増殖能(Ki-67陽性率)によってNET,NECが分類される。また,腫瘍サイズが大きいほど予後不良である5,15)。
2) 肉眼的所見黄白色腫瘍の形態を呈する。腫瘍自体は,充実性で柔らかい腫瘍である。境界は,明瞭である。多発性のことは少なく,多くは,単発性である。腫瘍が2 cm以上と大きくなるほど悪性を疑う(Figure 3.31)。

黄白色腫瘍の形態を呈する。腫瘍自体は,充実性で柔らかい腫瘍である。境界は,明瞭である。
腫瘍細胞は均一で細胞異型に乏しい異型細胞増殖が認められる。リボン状,ロゼット形成,柵状配列が認められる(Figure 3.32)。

リボン状,ロゼット形成,柵状配列が認められる。HE染色 10×
Pap染色,メイ・ギムザ染色迅速簡易染色では,核偏在,ごま塩状核,ロゼット形成(Figure 3.33, 3.34)(Figure 3.35),ロゼット形成(Figure 3.36)スピンドル細胞(Figure 3.37),硝子様物質(Figure 3.38)が認められることがある14)。これらの細胞所見は,その他の膵腫瘍でも認められる。個々の細胞は,腺房細胞癌と類似しており,形態学的にメイ・ギムザ染色迅速簡易染色,Pap染色,セルブロックによるHE染色で確定診断はできない。セルブロックによる免疫組織化学染色が必要となる為,十分な細胞量の確保が必要である。確定診断には,必ず,EUS-FNAのセルブロックでクロモグラニンA,シナプトフィジンの免疫組織化学染色で証明する(Figure 3.39, 3.40)。WHO分類では,腫瘍細胞増殖能(Ki-67陽性率)が2%以下(10 HPF)でNET(G1),3–20%(10 HPF)でNET(G2),20以上(10 HPF)でNECとされている(Figure 3.39, 3.40)16)。

細胞は均一で細胞異型に乏しい。EUS-FNA,
Pap染色 10×

核はゴマ塩状パターンを示し,ロゼット形成が認められる。EUS-FNA,Pap染色 40×

細胞は均一で,核が辺縁に存在する。EUS-FNA,メイ・ギムザ染色迅速簡易染色 40×

核はゴマ塩状パターンを示しロゼット形成を認める。EUS-FNA,メイ・ギムザ染色迅速簡易染色 100×

スピンドル状細胞が認められる。
メイ・ギムザ染色迅速簡易染色 100×

細胞質に硝子様物質陽性である。
メイ・ギムザ染色迅速簡易染色 100×

セルブロック 免疫組織化学染色 20×

セルブロック 免疫組織化学染色 20×
Solid-pseudopapillary neoplasm(SPN)のWHO分類は,低悪性度に分類されるが,転移がみられる症例もある。予後は良好である。若い女性に多いが,高年齢の男性にも発症することがある。CT,超音波で嚢胞性病変として発見されることが多い。腫瘍は,壊死,嚢胞,出血を伴うことが多い17)。
2) 肉眼的所見充実性部位も認めるが,多くは出血,壊死を伴っている。(Figure 3.41)EUS-FNAでは,出血,壊死部位からの穿刺は,細胞量が少量となり,確定診断できないことがある。充実性部位からの穿刺が認められる。

充実性に増殖する部位,出血,壊死を形成する部位が認められる。
軽度クロマチン増量した腫瘍細胞が乳頭状に増殖している。円形で小型の細胞が単一に出現し均一な細胞増殖を呈する。腫瘍自体は,柔らかく血液成分を多く含み嚢胞形成が認められることもある。個々の細胞は,内分泌腫瘍,腺房細胞癌と類似する(Figure 3.42, 3.43)18)。

血管軸を伴い,円形,単一で比較的小型細胞で均一な細胞増殖を呈する。HE染色 10×

血液成分を多く含み,均一な腫瘍細胞が増殖する。
HE染色 10×
EUS-FNAにおけるメイ・ギムザ染色迅速簡易法の細胞所見は,血管軸を中心にクロマチン増量した腫瘍細胞が乳頭状増殖を示す(Figure 3.44, 3.45)。EUS-FNA時には,多量の血液成分と細胞成分が採取されることが多い17)。

血管軸を中心にクロマチン増量した腫瘍細胞が乳頭状増殖を示す。
メイ・ギムザ染色迅速簡易染色 40×

血管軸を中心にクロマチン増量した腫瘍細胞が乳頭状増殖を示す。
メイ・ギムザ染色迅速簡易染色 40×
血管軸形成が認められる症例は,SPNを疑うことは可能であるが,血管軸形成しないSPNも存在する。
セルブロック法における免疫組織化学染色を実施する。多くの症例は,核に陽性を示すβカテニン陽性細胞が認められる(Figure 3.46)。ビメンチン陽性,CD56陽性,クロモグラニン陰性である19,20)。

βカテニン陽性細胞が認められる。
免疫組織化学染色 40×
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
米田 操(鈴鹿医療科学大学)…I,II
今野 和治(桑名市総合医療センター)…I,II
担当編集委員所 嘉朗(愛知県がんセンター)