2023 年 72 巻 1 号 p. 68-76
2023 年 72 巻 1 号 p. 68-76
Mycoplasma pneumoniae(M. pneumoniae)によるマイコプラズマ肺炎は,市中肺炎の中で最も多く見られる感染症の一つで,小児の肺炎の10~20%を占める。M. pneumoniaeの診断が遅れると,病気の悪化や治療の遷延化につながることから,M. pneumoniaeを正確かつ迅速に検出することが重要である。今回我々は,QP法を原理とした全自動遺伝子解析装置Smart Gene®と当院で通常使用している従来のQP法の検出能を比較検討した。対象は既知濃度のFH株とマイコプラズマ肺炎が疑われた患者104名とした。①FH株は生理食塩水で段階希釈後,両法で分析し最小検出限界の比較を行った。最小検出限界は両法ほぼ同程度であった。②咽頭ぬぐい液を用いて検出能と耐性変異の有無を比較した。両法共に,検出能および耐性変異有無の感度,特異度,一致率においてすべて一致した。③マイコプラズマ抗原迅速診断キットによる分析後の残留検体から抽出し凍結保存していたM. pneumoniae DNA検体を用いた場合,Smart Gene®の感度,特異度,一致率はそれぞれ75.9%,100.0%,87.3%であった。また,耐性変異の有無については両法の結果が一致した。Smart Gene®は,短時間でM. pneumoniaeの感染とマクロライド耐性変異の有無を検出することが可能で,早期診断と抗菌薬の適正使用にも貢献ができ,マイコプラズマ診療において有用性の高い検査法と考えられた。
Mycoplasma pneumoniae pneumonia is one of the most common community-acquired pneumonias and accounts for 10–20% of the pneumonia cases among children. The precise and timely detection of M. pneumoniae is critical because delayed diagnosis will cause disease exacerbation and prolonged treatment partly because of the development of macrolide resistance. We compared the bacteria detection ability of Smart Gene®, a fully automated genetic analyzer based on the QP method, with that of the conventional QP method used in our laboratory. M. pneumoniae culture strains of known concentrations were used and 104 patients with suspected mycoplasma pneumonia were recruited in this study. ①M. pneumoniae culture strains were serially diluted with physiological saline and analyzed by both methods and the minimum detection limits were compared between these two methods. The minimum detection sensitivities were almost the same for both methods. ②We compared the detection ability and the presence of resistance mutations using pharyngeal swabs. Both methods showed good agreement in terms of sensitivity, specificity, and match rate of detection and resistance mutation. ③When cryopreserved M. pneumoniae DNA specimens extracted from residual specimens after analysis using the mycoplasma antigen rapid diagnostic kit were used, the sensitivity, specificity, and match rate of Smart Gene® were 75.9%, 100.0%, and 87.3%, respectively. The results of both methods were consistent for the presence of resistance mutations. Smart Gene® can detect M. pneumoniae infection and the presence of macrolide-resistant mutations in a short time, and it is considered to be a highly useful test method in mycoplasma treatment because it can contribute to the early diagnosis and appropriate use of antimicrobial agents.
Mycoplasma pneumoniae(以下,M. pneumoniae)によるマイコプラズマ肺炎は代表的な市中肺炎の一つであり,小児肺炎の中では10~20%と比較的多いと報告されている1)。治療はβ-ラクタム系抗菌薬が無効であり,さらに使用できる抗菌薬が限られているため本菌による感染を迅速かつ正確に特定することは臨床的に大変重要である2)。M. pneumoniaeの診断法には培養法のほか,血清学的診断法,イムノクロマト法,loop-mediated isothermal amplification法(以下,LAMP法)などが利用されているが,これらの診断法では迅速性,感度,特異度のほか操作性や経済性の面で課題があった3)。一方,マイコプラズマ肺炎の治療の第一選択薬にはマクロライド系抗菌薬が推奨されているが,広い抗菌スペクトラムと副作用の頻度が少ないという汎用性が一因となり,耐性株の増加が懸念されていた4)。2000年にはマクロライド耐性株が出現し,それ以降日本では耐性株が年々増加している5)。M. pneumoniaeのマクロライド耐性化は,23SリボソームRNA(23SrRNA)のドメインVにおける点突然変異であり2),治療の遷延化や6),髄膜炎や脳炎などの中枢神経合併症を発症する症例なども存在するため,早期診断と適切な抗菌薬による治療が重要となる7)。当院では,Quenching probe法(以下,QP法)を用いてM. pneumoniaeと耐性変異の有無を検出しているが,試薬の調整や結果解析判定など検査工程が煩雑であり,DNA抽出とPCR反応にそれぞれ1時間程度要するため迅速性にも欠け8),検査員の熟練度によって検査効率や精度に差が見られるという課題があった。このような中,ミズホメディー社は新たにQP法を原理とした9)全自動遺伝子解析装置Smart Gene®(以下,SG法)を開発した。今回我々はSG法と当院のQP法を用いてM. pneumoniaeと耐性変異の有無について比較検討を行ったので報告する。
既知濃度(2.3 × 109 copies/mL)のM. pneumoniae FH株(以下,FH株)と2013年11月~2020年4月までのマイコプラズマ肺炎を疑いマイコプラズマ抗原迅速検査を実施した患者104症例を対象とした。内訳は,男性51例(2~94歳,平均26.0歳),女性53例(1~95歳,平均28.4歳)であった。検査材料には咽頭ぬぐい液49症例と凍結保存していたマイコプラズマ抗原迅速診断キット(以下,イムノクロマト法)の残液から抽出したDNA検体(以下,M. pneumoniae DNA検体)55症例を用いた。
2. 方法 1) QP法原理QP法は,グアニン近傍の蛍光色素発色が消光する反応を利用したSingle Nucleotide Polymorphism(SNP)typing法である。M. pneumoniaeの変異部位を含む領域をpolymerase chain reaction(以下,PCR)で増幅後,温度を下げて3'末端のシトシンに蛍光色素を標識したQProbeを結合させる。QProbeが所定の位置に結合すると,相補鎖のグアニン作用で蛍光が抑制されるが,徐々に温度を上げていくとQProbeが解離し始め再び蛍光を発する。この時,パーフェクトマッチのwild typeでは結合力が強く高温でQProbeが乖離し発光する。一方,QProbeと標的遺伝子にミスマッチのあるmutant typeでは結合力が弱まるため低温でQProbeが解離し,発光する(Figure 1)。このTm値の差を検出し,一塩基の違いを検出する(Figure 2)8)。

A:標的遺伝子をPCRで増幅し,QProbeを反応させる。
B:QProbeが標的遺伝子から解離し,蛍光が増加する温度の違いから,遺伝子型を判別する。

Tm値の差より,各変異の検出が可能である。
イムノクロマト法で使用した抽出液の残りのうち,200 μLをサンプルとして,QIAamp DNA Mini Kit(QIAGEN)を用いて,核酸抽出精製装置QIAcube(QIAGEN)にてDNA抽出を行った。抽出量は100 μLとした。
3) 院内QP法プライマーおよびプローブは,M. pneumoniaeの23SrRNAをコードするDNA領域に設定した。塩基配列は,Forward-Primer:5'-TCGGTGAAATCCAGGTACGG-3',Revers-Primer:5'-TCGATTGCTCCTACCTATTCTCT-3',QProbe:5'-CGCAACGGGACGGAAAGAC-BODIPY-3'とした8),10)。
PCR反応溶液の組成は,1反応あたりLight Cycler FastStart DNA Master Hybprobe(Roche)4.0 μL,10 μM Forward-Primer 0.4 μL,10 μM Revers-Primer 1.2 μL,5 μM QProbe 0.8 μL,DW11.6 μLおよびDNAテンプレート2.0 μLを混合し,全反応溶液量を20.0 μLとした。
PCR反応は,Light cycler 2.0 DX400(Roche)を使用し,95℃ 10分のHot Start後,熱変性95℃ 1秒,アニーリング58℃ 15秒を50サイクル行った。融解曲線解析は,95℃ 1秒,40℃ 60秒(Ramp Rate 4.8℃/秒),95℃ 0秒(Ramp Rate 0.2℃/秒)で行い,PCR反応に要する時間は約50分であった。
4) 既知濃度のFH株を用いた最小検出限界の比較既知濃度(2.3 × 109 copies/mL)のFH株を生理食塩水で段階希釈し最小検出限界の比較を行った(Table 1)。
| 系列 | 希釈倍率 | 濃度(copies/mL) |
|---|---|---|
| 1 | 1 | 2.30 × 109 |
| 2 | 10 | 2.30 × 108 |
| 3 | 100 | 2.30 × 107 |
| 4 | 1,000 | 2.30 × 106 |
| 5 | 10,000 | 2.30 × 105 |
| 6 | 20,000 | 1.15 × 105 |
| 7 | 40,000 | 5.75 × 104 |
| 8 | 60,000 | 3.83 × 104 |
SG法:スマートジーン® Myco検体採取セット(ミズホメディー社)のスワブ(以下,スワブ)に生理食塩水で段階希釈したFH株を浸したあと,専用抽出液に入れスマートジーン® Mycoテストカートリッジ(ミズホメディー社)に4滴滴下し測定装置でPCR反応を行った(Figure 3)。

院内QP法:生理食塩水で段階希釈したそれぞれのFH株からDNA抽出を行い,抽出したDNA検体を用いてPCR反応を行った。
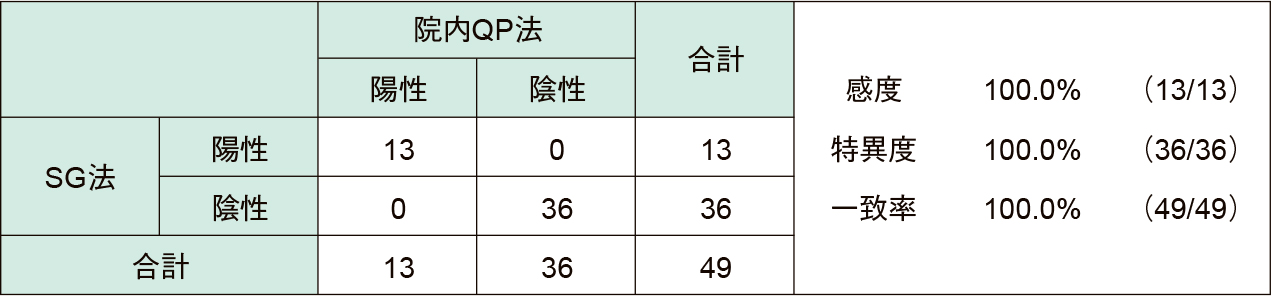
5) 咽頭ぬぐい液とM. pneumoniae DNA検体を用いた検出能の比較咽頭ぬぐい液(49/104症例)とM. pneumoniae DNA検体(55/104症例)を用いてM. pneumoniaeとマクロライド耐性変異の有無の比較を行った。
① 咽頭ぬぐい液(49/104症例)SG法:専用抽出液に咽頭をぬぐったスワブを浸し,スマートジーン® Mycoテストカートリッジに4滴滴下し測定装置でPCR反応を行った。
院内QP法:SG法で用いた抽出液の残りからDNA抽出を行い,抽出したDNA検体を用いてPCR反応を行った。また,同時に内部標準物質として全症例リアルタイムPCR法でβ-globinの検出も行った。
② M. pneumoniae DNA検体(55/104症例)SG法:M. pneumoniae DNA検体を専用抽出液に50 μL添加し11),スマートジーン® Mycoテストカートリッジに4滴滴下し測定装置でPCR反応を行った。
院内QP法:SG法で用いた抽出液の残りからDNA抽出を行い,抽出したDNA検体を用いてPCR反応を行った。また,同時に内部標準物質として全症例リアルタイムPCR法でβ-globinの検出も行った。
3. 倫理委員会本検討は市立函館病院倫理委員会の承認を受け実施した(迅2020-57)。
両法ともに40,000倍希釈の5.75 × 104 copies/mLまで検出可能であった。
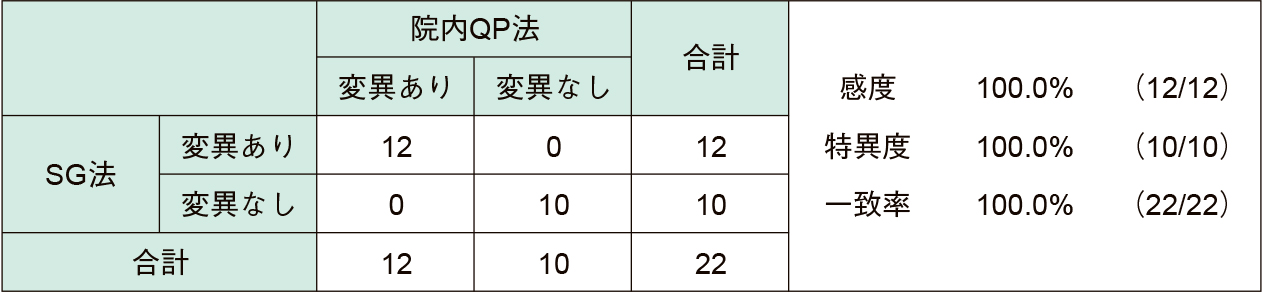
2. 咽頭ぬぐい液を用いた検出能の比較両法ともに49症例中陽性13件(26.5%)であり(Table 2),耐性変異は陽性13件中変異あり2件(15.4%),変異なし11件ですべての症例で結果が一致した(Table 3)。検出された耐性変異株は1件がA2063Gであり,残りの1件はA2063Tであった。またβ-globinは全症例で検出された。

55症例中,SG法では陽性22件(40.0%),院内QP法では陽性29件(52.7%)であった。SG法と院内QP法の感度は75.9%,特異度100.0%,一致率87.3%であった(Table 4)。SG法と院内QP法で結果が乖離した症例は全部で7症例認められ,その7症例はすべてSG法で陰性,院内QP法で陽性であった。耐性変異は,両法共に陽性であった22件を対象に比較したところ陽性22件中変異あり12件(54.5%),変異なし10件で全症例結果が一致した(Table 5)。検出された耐性変異株はすべてA2063Gであった。またβ-globinは全症例で検出された。

M. pneumoniaeは非定型肺炎の代表的な原因菌の一つであり,特に若年性の非定型肺炎では最も多い原因菌である。M. pneumoniaeは細胞壁を持たないため,細菌感染症で一般的に用いられるペニシリン系やセフェム系などの細胞壁合成阻害薬では奏功せず,マクロライド系やテトラサイクリン系などの蛋白合成阻害薬が有効であるが12),使用できる抗菌薬が限られているためM. pneumoniaeによるマイコプラズマ肺炎を正確かつ迅速に特定することは非常に臨床的に重要である。マイコプラズマ肺炎の確定診断には,培養法や血清学的診断法,イムノクロマト法,LAMP法などがあるが血清学的診断法やイムノクロマト法は感度や特異度に問題があり,培養法やLAMP法は迅速性や検査工程に課題があった3)。さらに,2000年にマクロライド耐性株が出現して以降,耐性率は年々増加し2011~2012年には80~90%と高い耐性率となった13)。マクロライド系抗菌薬の作用機構は細菌特異的23SrRNAのドメインに結合し蛋白合成を阻害するが14),現在確認されているマクロライド耐性機構は作用点のドメインVにおける点突然変異で15),最も頻度の多いA2063Gの変異の他にA2063T,A2063C,A2064Gなども報告されている16)。マクロライド耐性マイコプラズマは治療中に耐性化するとの報告もあり17)~19),適切な抗菌薬を投与することが重要となる。マイコプラズマ肺炎は治療の第一選択薬にマクロライド系抗菌薬が推奨されているが,マクロライド感受性株ではマクロライド投与後48時間で解熱するのに対し,マクロライド耐性株による肺炎の症例では解熱するまで日数を要するとされている20)。マクロライド系抗菌薬投与後も発熱が持続する場合は,テトラサイクリン系抗菌薬もしくはトスフロキサシンの使用が推奨されているが21),テトラサイクリン系の副作用として一過性骨発育不全,歯牙着色,エナメル質形成不全などがあるため8歳未満では原則禁忌とされている21),22)。
今回我々はQP法の原理を用いた全自動遺伝子解析装置Smart Gene®のマイコプラズマ検出能について院内QP法と比較検討を行った。既知濃度のFH株を用いた最小検出限界の比較では,両法ともに5.75 × 104copies/mLまで検出が可能であった。咽頭ぬぐい液を用いたマイコプラズマ検出能の比較ではSG法,院内QP法ともに49症例中陽性13件であり,感度100.0%,特異度100.0%,一致率100.0%とすべての症例で結果が一致した。耐性変異においても陽性13件中変異あり2件,変異なし11件で感度100.0%,特異度100.0%,一致率100.0%とすべての症例で結果が一致した。日本マイコプラズマ学会によるマイコプラズマ肺炎に対する治療指針では急性期の確定診断にはLAMP法のほかQP法が最も優れているとの記載があり21),以前我々が院内QP法を構築した際の検討において院内QP法はLAMP法と同程度の検出能を有していることが確認されている8)。M. pneumoniae DNA検体を用いたマイコプラズマ検出能の比較では55症例中SG法で陽性22件,院内QP法で陽性29件であり感度75.9%,特異度100.0%,一致率87.3%であった。結果が乖離した症例は7件認められ,すべてがSG法で陰性,院内QP法で陽性であった。耐性変異においては陽性22件中変異あり12件,変異なし10件で,感度100.0%,特異度100.0%,一致率100.0%とすべての症例で結果が一致した。結果乖離7症例について,内部標準物質であるβ-globinを用いて検体中のDNA量を確認し再検証したところ2症例は36–40サイクル付近で,5症例は34サイクル以下でβ-globinが検出されていた(Table 6)。PCR反応は初期のDNA濃度に依存し,DNA濃度が濃い検体では早いサイクル数で,DNA濃度が薄い検体では遅いサイクル数で標的遺伝子が検出されるという特徴がある23)。今回内部標準物質として用いたβ-globinはハウスキーピング遺伝子としてヒト由来のDNAをターゲットとしていることから24),必ずしもM. pneumoniae DNA量を反映しているわけではないが,36–40サイクル付近にてβ-globinが検出された2症例では検体中のM. pneumoniae DNA量も減少し,偽陰性となった可能性が示唆された。他の5症例では34サイクル以下でβ-globinは十分量検出されていたが,検体採取時において上気道のヒト由来成分を多く採取し,下気道に多く存在する25)~27) M. pneumoniaeが適切に採取されなかった可能性も要因の一つとして考えられた。本検討はマイコプラズマ肺炎非流行期に実施しており,咽頭ぬぐい液を用いた検出能の比較検討症例数や陽性症例数が少数であったため数年前から凍結保存していたM. pneumoniae DNA検体を用いての追加検討を実施したが,乖離症例が散見され感度が低めの結果となった。M. pneumoniae DNA検体は咽頭ぬぐい液と比較しβ-globinの検出サイクルが遅い傾向があり,イムノクロマト法抽出液の残液からDNA抽出操作をしたことで含まれるM. pneumoniae DNAも少量しか抽出されず,長期間の凍結保存によりDNAも劣化したことで結果が乖離したと推測された。今後は,マイコプラズマ肺炎流行期においてさらなる症例数の蓄積が望まれる。

*  は結果不一致症例
は結果不一致症例
本検討で検出された耐性変異株は14件中13件(92.9%)がA2063Gであり,既報のとおりA2063Gが最も多かった。院内QP法では,Tm値の差によりwild typeとA2063Gの変異の検出が可能であるが8),今回の検討においてSG法で変異(+),院内QP法でA2063Gの変異とはTm値が異なる症例が1例認められシーケンス解析を行った結果,変異の頻度が5%前後と報告されている16),28) A2063Tの変異が検出された。
院内QP法はDNA抽出,試薬調製,PCR反応,結果解析と検査工程が煩雑であり,迅速性にも欠けてしまう8)。一方,SG法は咽頭ぬぐい液を専用の抽出液に浸し,テストカートリッジに滴下して専用装置にセットをするだけでDNA抽出・PCR反応・結果解析までを全自動で約30分~50分で行うことができ9),普段遺伝子検査業務に携わっていない検査員でも容易に遺伝子検査を行うことができる。2022年2月現在,全自動遺伝子解析装置Smart Gene®ではM. pneumoniae検出試薬の他,新型コロナウイルス(SARS-CoV-2)の検出試薬も発売され当院ではM. pneumoniaeと新型コロナウイルスの検出に用いている。
SG法はM. pneumoniaeの感染の有無と発生頻度の低い変異株も含め耐性変異を同時に短時間で検出することが可能であった。しかし,M. pneumoniaeは下気道感染症であり上気道に存在する菌量が必ずしも多くはないため25),検体採取方法が非常に重要となる。M. pneumoniae感染症では咽頭後壁からの採取法が推奨されているが25),27),咽頭後壁からの採取は技量を要するため検査の感度は採取手技に影響されることを念頭に置かなければならない。また,遺伝子検査では生菌のみではなく死菌も検出するため26),過去の感染でも陽性となる場合がある。よって,M. pneumoniaeの診断には遺伝子検査のみならず画像検査や臨床症状などの臨床所見を含め総合的に判断する必要があると考えられた。
今回我々は,QP法を原理とした全自動遺伝子解析装置Smart Gene®におけるマイコプラズマ検出能の比較検討を行った。SG法はM. pneumoniae DNA検体では院内QP法にやや劣るが,咽頭ぬぐい液においては院内QP法と同程度の性能を有しており操作も簡便で迅速性にも優れていた。SG法を用いることで業務の効率化や付加情報の提供が可能となり,マイコプラズマ肺炎の診療において有用な検査法であると考えられた。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。