関節液検査は,関節液貯留の原因を特定する目的で実施されており,特に結晶分類は結晶誘発性関節炎の診断に有用である。しかし,関節液検査についての精度管理や教育活動は十分に普及していない。その原因として,関節液検査の依頼件数が少ないことや,検体の保存が困難なことが挙げられる。本研究では,関節液中にピロリン酸カルシウム結晶(以下,CPPD結晶)または尿酸ナトリウム結晶(以下,MSU結晶)を認めた検体を対象に,10%中性緩衝ホルマリン固定または無水エタノール固定されたセルブロック標本を用いて,結晶の長期保存が可能か検討した。CPPD結晶は,10%中性緩衝ホルマリン固定で有意に結晶成分が保存されていた。一方,MSU結晶は,無水エタノール固定で有意に結晶成分が保存されていた。検出された結晶は,鋭敏色偏光顕微鏡でCPPD結晶とMSU結晶に特徴的な複屈折性を示した。本法で作製されたセルブロック標本を使用したオンライン鏡検実習では,70%以上の参加者から良好なアンケート結果を得ることができた。これらの結果は,無水エタノール固定によるセルブロック標本を用いることでCPPD結晶とMSU結晶両方の長期保存を可能とし,関節液検査の教育に活用できることを示した。
Joint fluid is tested to identify the cause of joint effusions, and crystal classification is particularly useful for the diagnosis of crystal-induced arthritis. However, quality control and educational activities on joint fluid analysis are not sufficiently widespread, and the reasons are attributed to the small number of requests for analysis and unstable preservation. In this study, we examined the possibility of long-term preservation of crystals in specimens with calcium pyrophosphate crystals (CPPD crystals) or sodium urate crystals (MSU crystals) in joint fluid, using 10% neutral buffered formalin-fixed or anhydrous ethanol-fixed cell block specimens. CPPD crystals were significantly well preserved by 10% neutral buffered formalin fixation. In contrast, MSU crystals were significantly well preserved by anhydrous ethanol fixation. The crystals detected by polarized light microscopy also showed characteristic birefringence for CPPD and MSU crystals. In the online microscopy training using cell block specimens, the survey results showed that more than 70% of the participants responded ‘good’. These results suggest that the use of cell block specimens prepared by anhydrous ethanol fixation enables long-term preservation of both CPPD and MSU crystals and can be useful for education in joint fluid analysis.
関節液は関節腔に貯留する粘稠度の高い液体であり,血漿濾過成分とヒアルロン酸や糖蛋白などから構成されている1)。関節液検査は一般的に外観・性状の観察,細胞数算定,粘稠度,結晶分類,細菌検査などを実施することにより,関節液貯留の原因を特定する目的で実施される。関節液貯留の原因で頻度の高い疾患の一つとして,尿酸ナトリウム結晶(以下,MSU結晶)やピロリン酸カルシウム結晶(以下,CPPD結晶)による結晶誘発性関節炎があり,一般的に痛風ではMSU結晶,偽痛風ではCPPD結晶を検出することで確定診断が可能となる。また,X線検査ではMSU結晶を証明することが困難なことから,顕微鏡的検査による判定は臨床的意義が高いとされている1),2)。このように,関節液中の結晶成分の同定は臨床的意義が高いにもかかわらず,多くの施設で精度管理や教育が実施されていない問題がある。関節液検査の教育が尿や髄液,穿刺液など他の一般検査と比較し進んでいない原因として,関節液検査の依頼件数が少ないことや,検体の保存が困難なことなどが挙げられる。これらの課題を解決するために,本研究では関節液をセルブロック法にてパラフィン包埋ブロックを作製することにより,少量の検体から複数標本の作製かつ長期間保存が可能か検証し,本法にて作製した標本が施設内の精度管理や後進の育成教育に活用することができるかを検証した。
対象は,2019年から2020年の間に当院整形外科から提出された関節液検体を用いた。足首より採取されたMSU結晶及び膝関節から採取されたCPPD結晶が,5個/HPF以上出現している検体を対象とした。
なお,本研究は当院倫理委員会において,倫理審査に該当しないとされた。
Figure 1に示すように,以下2~5の手順に従ってセルブロック標本を作製した。

関節液10 mLに対してヘパリンナトリウム(陽進堂)1 mL添加後,綿棒チューブ(アジア器材)に分注し,室温にて2,000 g,5分間遠心した後,スポイトにて上清を除去し沈渣を作製した。
3. 検体の固定方法MSU結晶,CPPD結晶の沈渣に,それぞれ10%中性緩衝ホルマリン(健栄製薬)7 mLまたは無水エタノール(関東化学)7 mLを重層し,室温で12時間固定を行った3)。
4. 簡易セルブロック作製法室温にて2,000 g,5分間遠心後,綿棒チューブ内の10%中性緩衝ホルマリン及び無水エタノールをスポイトにて除去し,その後沈渣の入っている綿棒チューブの先端を切り取りメッシュパック(村中医療器)に収納し包埋カセットへ入れた。自動固定包埋装置エクセルシアES(Thermo Scientific)により通常のパラフィン浸透操作を実施した。
5. セルブロック標本の作製包埋時には綿棒チューブの中から取り出した細胞塊のみをパラフィン包埋して,3 μmで薄切し37℃で1時間乾燥させた3),4)。その後,3槽のキシレン(武藤化学)でそれぞれ5分間脱パラフィンを実施後,マリノール(武藤化学)にて封入した(Figure 2, 3)。


MSU結晶及びCPPD結晶標本を簡易偏光顕微鏡(OLYMPUS)にて400倍で全視野観察し,無作為な5視野の結晶形態を確認した。生標本と同様の形態と複屈折性が保たれた典型的な結晶と変性または崩壊した結晶の出現率を算定した。その後,鋭敏色偏光顕微鏡にてZ’(γ)軸と平行及び垂直方向で鏡検し,MSU結晶及びCPPD結晶の複屈折性を確認した。
7. 教育的効果の評価法2021年度愛知県臨床検査技師会臨床一般検査研究班基礎講座において,簡易偏光顕微鏡及び鋭敏色偏光顕微鏡下でセルブロック標本の鏡検動画と解説を事前に撮影し,ライブ配信にて実技研修会を実施した。基礎講座終了後,参加者89名に対してアンケート調査を実施した。アンケート内容は,「よくわかった」,「わかった」,「普通」,「やや難しかった」,「難しかった」の5段階評価に加え,自由記述による感想を集計した。
8. 統計解析統計解析は統計ソフトJMP software ver. 14.2.0(SAS Institute)を使用し,2群間の差はフィッシャーの正確検定で解析した。P < 0.05の場合に統計学的有意差ありと判断した。
簡易偏光顕微鏡による顕微鏡所見をFigure 4に示す。CPPD結晶の5視野当たりの結晶成分の頻度は,10%中性緩衝ホルマリン固定で14.4%(253/1,755)となり,無水エタノール固定11.9%(749/6,286)と比較して有意に高かった。

(a) Monosodium urate (Anhydrous ethanol)
(b) Monosodium urate (10% neutral buffered formalin)
(c) Calcium pyrophosphate dihydrate (Anhydrous ethanol)
(d) Calcium pyrophosphate dihydrate (10% neutral buffered formalin)
 Typical crystal forms (red arrow)
Typical crystal forms (red arrow)
 Abnormal crystal forms (yellow arrow)
Abnormal crystal forms (yellow arrow)
一方,MSU結晶の5視野当たりの結晶成分の割合は10%中性緩衝ホルマリン固定で0.3%(2/630)となり,無水エタノール固定17.6%(288/1,634)と比較して有意に低かった(Table 1)。
| Anhydrous ethanol | 10% neutral buffered formalin | |||||||
|---|---|---|---|---|---|---|---|---|
| Typical | Abnormal | Typical/abnormal ratio (%) | Typical | Abnormal | Typical/abnormal ratio (%) | |||
| MSU | ① | 42 | 140 | 42/182 (23.1%) | ④ | 0 | 38 | 0/38 (0%) |
| ② | 94 | 579 | 94/673 (14.0%) | ⑤ | 1 | 260 | 1/261 (0.3%) | |
| ③ | 152 | 627 | 152/779 (19.6%) | ⑥ | 1 | 330 | 1/331 (0.3%) | |
| total | 288 | 1,346 | 288/1,634 (17.6%)*,$ | total | 2 | 628 | 2/630 (0.3%) | |
| CPPD | ⑦ | 184 | 964 | 184/1,148 (16.0%) | ⑩ | 77 | 585 | 78/662 (11.6%) |
| ⑧ | 291 | 1,878 | 291/2,169 (13.4%) | ⑪ | 37 | 189 | 37/226 (16.4%) | |
| ⑨ | 274 | 2,695 | 274/2,969 (9.2%) | ⑫ | 139 | 728 | 139/867 (16.0%) | |
| total | 749 | 5,537 | 749/6,286 (11.9%) | total | 253 | 1,502 | 253/1,755 (14.4%)#,† | |
*p < 0.05, MSU (Anhydrous ethanol vs 10% neutral buffered formalin)
#p < 0.05, CPPD (Anhydrous ethanol vs 10% neutral buffered formalin)
$p < 0.05, Anhydrous ethanol (CPPD vs MSU)
†p < 0.05, 10% neutral buffered formalin (CPPD vs MSU)
鋭敏色偏光顕微鏡による顕微鏡所見をFigure 5に示す。10%中性緩衝ホルマリン固定にて作製されたセルブロック標本では,CPPD結晶の結晶成分がZ’(γ)軸と平行時は青色,垂直時は黄色と,典型的な複屈折性を示した。一方,MSU結晶は,ほぼ変性または崩壊しており,典型的な複屈折性を得ることができなかった。
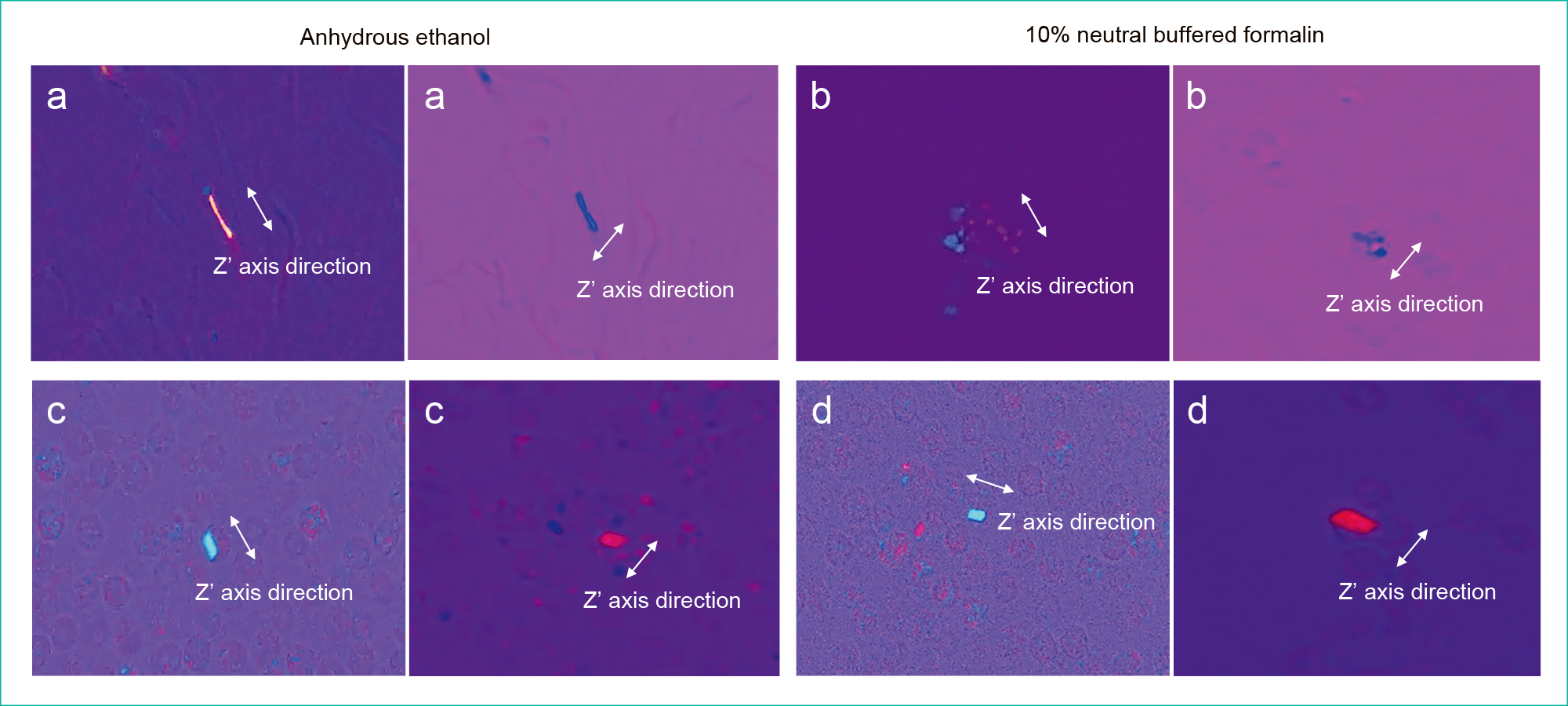
(a) Monosodium urate (Anhydrous ethanol)
(b) Monosodium urate (10% neutral buffered formalin)
(c) Calcium pyrophosphate dihydrate (Anhydrous ethanol)
(d) Calcium pyrophosphate dihydrate (10% neutral buffered formalin)
無水エタノール固定にて作製されたセルブロック標本のCPPD結晶は,Z’(γ)軸と平行時は青色,垂直時は黄色の複屈折性を示し,MSU結晶は,Z’(γ)軸と平行時は黄色,垂直時は青色の複屈折性を示し,生標本と同様の複屈折性を確認することができた。
また,CPPD結晶は臨床上重要となる貪食像もセルブロック標本上で確認することができた。
3. アンケート調査による教育的効果2021年度愛知県臨床検査技師会一般検査研究班基礎講座のアンケート調査結果を示す(Table 2, Figure 6)。参加者89名に対してアンケート回収率は86名(96.6%)であった。その内訳は,「よくわかった」が34名(39.5%),「わかった」が29名(33.7%),「普通」が16名(18.6%),「やや難しかった」が7名(8.1%),「難しかった」が0名(0%)であり,70%以上の参加者から良好な結果を得ることができた。また,自由記述については,「関節液の講習会はあまりなかったので勉強になった」,「関節液の結晶成分の実習はWEBでしたが,しっかり見ることができとても良かった」など良好な結果となった。
| 【自由記述】 |
| ・関節液についての講習は今まであまりなかったので,とても参考になりました。 |
| ・関節液の結晶成分の実習はWEBでしたが,しっかり見ることができとても良かったです。 |
| ・顕微鏡を使った研修は非常に良いと思います。検者が何を考えながら観察してるかの視点は必要と思います。これからも取り入れて欲しいです。 |
| ・関節液の結晶を動画で丁寧に説明していただいてとても良かった。 |
| ・スライドカンファレンス及び関節液実習の解説が個人的にわかりやすく,ためになりました。ありがとうございました。 |
| ・関節液についての勉強会があまりないので大変勉強になりました。 |

本研究ではMSU結晶及びCPPD結晶を含有する関節液に対して,10%中性緩衝ホルマリンと無水エタノールによる2種類の固定液を用いて,セルブロック標本を作製した。CPPD結晶は10%中性緩衝ホルマリン固定及び無水エタノール固定共に結晶成分を確認することができた。しかし,MSU結晶は無水エタノール固定では結晶成分を検出することができたが,10%中性緩衝ホルマリン固定では,結晶の変性や崩壊により結晶成分を確認することが困難であった5)。
尿酸は水に難溶であるが,血液中でナトリウムと結合することで,MSU結晶となり,生成された結晶はpH 7.4で7 mg/dL,pH 7.0で200 mg/dLの溶解度を示すことが知られている6)。したがって,本研究で使用した10%中性緩衝ホルマリンは,約pH 7.0に調整されているため,最大溶解度となるpH下で固定液中に含まれる水による溶解性が高まった結果,MSU結晶が溶解したと推測された。
MSU結晶とCPPD結晶共に小型の結晶成分では,固定の影響と考えられる変性を認めた。セルブロック作製では検体を固定することが必須であり,固定による変性は避けることができない。本法で安定的に結晶成分を観察するには,一定以上の大きさ及び結晶成分量が十分含まれる検体を用いることが必要と考えられた。また,多くの結晶成分はpHの影響により結晶形態や残存率に変化を来すことが知られており7),8),本研究においても固定液のpHにより多くの結晶成分が消失した可能性が示唆された。
今後の課題として,固定時間と結晶成分変性の関係性について,さらなる検討が必要である。本研究結果より,固定液に関してはMSU結晶の影響がない無水エタノール固定が有用と考えられるが,固定により多くのMSU結晶及びCPPD結晶共に小型の結晶成分が変性または崩壊する。すなわち,結晶の崩壊や変性を防ぎ,より安定的な標本を作製するためには,さらなる最適な固定条件を設定する必要がある。
横川ら9)は,結晶性関節炎の診断方法として関節液を1滴垂らしカバーガラスをかぶせた無染色標本を使用し,偏光顕微鏡下で結晶成分を確認することを推奨しており,多くの施設で本法が標準的方法となっている。しかし,実技研修会で横川らの推奨している方法を行うには,無染色標本及び検体が大量に必要となり,現実的ではない。また,保管しやすいギムザ染色標本等では,無染色標本と色調が異なるため,教育として活用するには不十分であると考えられる。これらの原因により,これまで関節液検査に関する研修会は座学が中心となり,実技研修会の開催が制限されていたと推察される。本研究における関節液のセルブロック化による無染色標本は,必要な標本の確保に加え,推奨法である無染色標本に限りなく類似しており,実技講習会開催及びアンケート結果の評価から教育用標本として活用することが可能と考えられる。また,本方法は,MSU結晶やCPPD結晶だけではなく,臨床上重要かつ出現頻度の少ない結晶成分であるハイドロキシアパタイト結晶など,希少成分保存の観点からも非常に有用であると考えられる(Figure 7)10)。一方,問題点として,3 μmにて薄切された無染色標本は,顕微鏡下でピントを調整することが困難であり,熟練者によるサポートが必要となることが挙げられる。

(a) Obsevation with simple polarizing microscope
(b) Observetion of aizarin red stained specimen with a light microscope
関節液検査は,結晶誘発性関節炎の診断において極めて臨床的意義の高いものであり,特にMSU結晶,CPPD結晶の鑑別は偏光顕微鏡があれば比較的容易に検査が可能である。また,これら結晶の存在をもって確定診断に繋がるため,十分な教育や精度管理が必須の検査である。本研究における関節液のセルブロック作製は,手順が煩雑であり時間を要するデメリットはあるが,一度セルブロックを作製することで,今後大量の検体を用意する必要がなくなる。事前準備も標本のみと容易となり,実技研修会などで関節液を取り上げる機会を増やすことが可能となる。今後は,自施設内や多施設間における関節液検査の精度管理への応用も十分期待される。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
本研究を進めるにあたり,熱心にご指導いただいた愛知県臨床検査技師会一般検査研究班の皆様に深謝致します。