単一クローン性免疫グロブリン(M蛋白)患者は,蛋白質におけるM蛋白が占める割合が極端に高く,その他の免疫グロブリンは顕著に減少している。一方で,非M蛋白患者は各蛋白質を一定の割合で含有している。蛋白質は塩溶液を加えると,濃度によって塩溶または塩析する。患者血清を塩濃度の異なる2液(精製水,リン酸緩衝生理食塩水)とそれぞれ反応させた場合,2液の吸光度を差し引いた吸光度変化量はM蛋白患者と非M蛋白患者とで有意差が認められた。そこで上記の吸光度変化量を用いて,M蛋白スクリーニング検査を実施するために適する測定波長・分注量・測光ポイントを検討した。結果,測定条件を測定波長は340 nm,分注量は試薬80 μLに患者血清16 μL,測光ポイント1とした。次に本検出法の性能評価をした。相関性では,蛋白電気泳動(Mピークの有無)で有意差を認めた。併行精度では,吸光度変化量0.064付近において変動係数(CV%)は4.2%であった。ランダマイズ2回測定法では,2グループの測定値に強い相関があった。ロジスティック回帰分析から得られた受動者動作特性試験(ROC)曲線より,カットオフ値を0.048(感度67.7%,特異度59.1%)とした。曲線下面積は年齢・総蛋白・アルブミン・A/G比のみのROC曲線よりも,本検出法を加えた方が有意に高いことが認められた。結果から,本検出法はM蛋白スクリーニング検査として有用だと考える。
Patients with monoclonal immunoglobulin (M-protein) have an extremely high proportion of M-protein in their serum, significantly reducing the levels of other immunoglobulins. In contrast, non-M-protein patients have a more balanced distribution of various proteins. Proteins can either dissolve or precipitate when added to a salt solution, depending on the concentration. When patient serum was reacted with two solutions of different salt concentrations (purified water and phosphate-buffered saline), the absorbance changes were significantly different between M-protein and non-M-protein patients. Therefore, we investigated the optimal photometric wavelengths, volumes, and photometric points for M-protein screening based on these absorbance changes. The results showed that the optimal wavelength was 340 nm, the reagent volume was 80 μL, the patient serum volume was 16 μL, and the photometric point was 1. We subsequently evaluated the performance of this test method. For correlation, significant differences were observed in protein electrophoresis (presence or absence of an M-peak). For concomitant accuracy, the coefficient of variation (CV%) was 4.2% at an absorbance change of around 0.064. In terms of Randomized two-time measurement method, there was a strong correlation between the measurements of the two groups. For criterion validity, the cutoff value was set at 0.048 (sensitivity 67.7%, specificity 59.1%) based on the receiver operating characteristic (ROC) curve obtained from logistic regression analysis. The area under the curve was significantly higher with this test method than with the ROC curve for age, total protein levels, albumin levels, and A/G ratio alone. Therefore, this test is useful for M-protein screening.
単一クローン性免疫グロブリン(monoclonal immunoglobulin;M蛋白)は,骨髄中の1つの形質細胞ががん化することにより増殖する。増殖した細胞から産生された免疫グロブリンは同じ性質・等電点をもち,高濃度に精製された状況で存在している。
M蛋白スクリーニングは通常,初めに血清総蛋白濃度(total protein; TP)やアルブミン濃度(albumin; Alb),アルブミン・グロブリン比(A/G比)とそれに準ずる免疫グロブリンG(immunoglobulin G; IgG),免疫グロブリンA(immunoglobulin A; IgA),免疫グロブリンM(immunoglobulin M; IgM)定量等,これらの検査を行う自動分析装置による段階,蛋白分画電気泳動を行う段階,その同定を含めた確定は免疫電気泳動または,免疫固定法(immunofixation electrophoresis; IFE)と順を追って検査している1)。これらの過程を順に実施していくため,患者のM蛋白確定までに時間が掛かることが課題であった。また,国の医療費抑制政策により蛋白分画電気泳動はスクリーニング的に検査することが難しくなり,M蛋白検出数も減少しているとの報告もある2)。さらに免疫グロブリンの増加を反映する硫酸亜鉛混濁試験(zinc sulfate turbidity test; ZTT),チモール混濁試験(thymol turbidity test; TTT)を用いたZTT-TTT判別式はM蛋白スクリーニングとして有用3),4)とされていたが,2018年の診療報酬改定において保険点数の算定対象から除外されている。これらの状況はM蛋白検出の機会損失であることは否めない。
そこで本研究では,検査室で手に入りやすい精製水とリン酸緩衝生理食塩水(phosphate buffered saline; PBS)を用いて,自動分析装置によるM蛋白スクリーニング検査を試みた。
本研究のM蛋白検出法は,蛋白質に適当な塩溶液を加えると共存する塩の濃度によって,塩溶または塩析することを利用した比濁法である。低い濃度の塩が共存すると,蛋白質のような高分子電解質の水に対する溶解度は増加する(塩溶)5)。一方,塩濃度がほとんどない場合,溶解度は前者に劣り凝集することがある(塩析)6)。M蛋白患者は単一クローン性に蛋白質を産生しているため,血中蛋白質におけるM蛋白の割合が極端に高く,それ以外の免疫グロブリンは顕著に減少している7)。非M蛋白患者は各蛋白質を一定の割合で含有している。患者血清を塩濃度の異なる2液とそれぞれ混ぜ合わせた場合,2つの混合液の吸光度を差し引いた値(吸光度変化量)は,M蛋白患者と非M蛋白患者とでは,塩溶と塩析の程度による差があるのではないかと考えた。
本研究では精製水に検体を混ぜた場合の吸光度と,PBSと検体を混ぜた場合の吸光度を比較し,M蛋白検出予測となる因子の検討を行った。また,測定方法として適当な測定条件を探るため,測定波長,検体分注量,測光ポイントを変えることで吸光度変化を調べた。さらに,M蛋白診断検査となり得るか評価したので報告する。
当検査科に提出された患者血清のうち,IFEの依頼があった247検体を対象とした(Table 1,2)。IFEはM蛋白の検出,確定のゴールドスタンダードと考え8),9),対象とした。
| total(n = 247) | M蛋白検出群(n = 93) | 非M蛋白検出群(n = 154) | |
|---|---|---|---|
| 年齢(歳) | 74.0(65.5~83.0) | 78.0(70.0~85.0) | 73.0(63.3~82.0) |
| 性別,男性/女性(n) | 122/125 | 43/50 | 79/75 |
| TP(g/dL) | 7.10(6.40~7.50) | 7.30(6.60~7.60) | 7.00(6.30~7.50) |
| ALB(g/dL) | 3.80(3.20~4.20) | 3.8(3.2~4.2) | 3.80(3.30~4.20) |
| A/G比 | 1.21(0.92~1.48) | 1.17(0.81~1.47) | 1.31(1.00~1.50) |
| IgG(mg/dL) | 1,354.0(996.0~1,782.5) | 1,456.0(973.0~2,228.0) | 1,322.5(1,037.3~1,586.5) |
| IgA(mg/dL) | 216.0(132.0~326.0) | 159.0(55.0~289.0) | 242.0(168.5~345.8) |
| IgM(mg/dL) | 72.0(41.5~119.5) | 57.0(28.0~129.0) | 73.5(48.0~114.5) |
| Mピーク,有/無(n) | 77/170 | 72/21 | 5/149 |
| Siaテスト,陽性/陰性(n) | 16/231 | 10/83 | 6/148 |
| 精製水(吸光度) | 0.317(0.252~0.437) | 0.304(0.233~0.424) | 0.326(0.260~0.442) |
| PBS(吸光度) | 0.255(0.197~0.356) | 0.263(0.197~0.368) | 0.254(0.201~0.350) |
| 精製水-PBS(吸光度変化量) | 0.048(0.018~0.087) | 0.036(0.012~0.068) | 0.060(0.033~0.103) |
median and interquartile rangeで表記。
| 種類 | n | 複合型の種類 | n | |
|---|---|---|---|---|
| IgG | κ | 36 | IgG κ + IgG λ | 1 |
| λ | 23 | IgG κ + IgA κ | 2 | |
| IgA | κ | 3 | IgG λ + IgA λ | 1 |
| λ | 1 | IgG κ + IgM κ | 1 | |
| 不明 | 2 | IgG λ + BJP λ | 1 | |
| IgM | κ | 11 | IgG λ + IgA κ + IgM 不明 | 1 |
| λ | 4 | IgA λ + IgA 不明 | 1 | |
| BJP | κ | 2 | IgM κ + BJP κ | 1 |
| λ | 2 | |||
1)精製水はピュアライトPR-SG(オルガノ株式会社)から得られたイオン交換水を使用した。本検出法測定日(29日間)ごとに,試薬の性質を血液ガス分析装置にて測定した(Table 3)。
| 項目 | 精製水 | PBS | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| pH | Na(mmol/L) | K(mmol/L) | Cl(mmol/L) | Ca(mmol/L) | pH | Na(mmol/L) | K(mmol/L) | Cl(mmol/L) | Ca(mmol/L) | |
| mean | 7.127 | < 7.0 | < 0.5 | < 7.0 | < 0.2 | 7.281 | 147.5 | < 0.5 | 122.1 | < 0.2 |
| SD | 0.065 | ― | ― | ― | ― | 0.007 | 1.8 | ― | 1.3 | ― |
29日間測定。< xは測定下限未満。
2)PBSは精製水20.0 Lに塩化ナトリウム試薬特級(富士フイルム和光純薬株式会社)153.0 g,リン酸水素二ナトリウム鹿1級(関東化学株式会社)30.5 g,リン酸二水素ナトリウム・一水和物分析用 エンシュア(メルク株式会社)7.1 gを溶解し使用した。本検出法測定日(29日間)ごとに,試薬の性質を血液ガス分析装置にて測定した(Table 3)。
3)TPはアクアオート カイノスTP-II試薬,Albはアクアオート カイノスALB試薬(いずれも株式会社カイノス)を使用した。IgGはN-アッセイTIA IgG-SH,IgAはN-アッセイTIA IgA-SH,IgMはN-アッセイTIA IgM-SH(いずれもニットーボーメディカル株式会社)を使用した。
3. 測定手段 1) 吸光度測定機器自動分析装置AU5800(ベックマン・コールター)を用いた。本検出法に用いる吸光度測定は1波長1ポイント法である。測定可能波長全13種類(nm)は340,380,410,450,480,520,540,570,600,660,700,750,800である。測光ポイントは全27ポイント(最長8分40秒)である。試薬(精製水およびPBS)と患者血清の反応温度は37℃である。
2) 血清蛋白分画電気泳動装置CTE880(株式会社常光)を用いた。γ分画にデンシトメトリー像で大小関わらず急峻なピークおよび,泳動像に幅狭い蛋白帯を認めた場合に,Mピーク有りとした。
3) 免疫固定法クイックジェルIFEキット(株式会社ヘレナ研究所)を用いて免疫固定電気泳動法を行った。M蛋白が微量または疑いの判定結果は,検出有りとした。
4) Siaテスト(Sia euglobulin precipitation test)試験管内に精製水1.0 mLを入れ,検体約50.0 μLを添加し混濁の有無(陽性・陰性)を黒い背景を置き,目視にて確認した。
5) 血液ガス分析装置精製水およびPBSの性質測定はABL800 FLEX(ラジオメーター)を用いた。
4. 統計解析統計解析には,改変Rコマンダー(Bland-Altman分析)とEZR(その他全て)を使用した。改変Rコマンダー(弘前大学)とEZR(自治医科大学)は,RおよびRコマンダーの機能を拡張した統計ソフトウェアである。統計学的有意水準はp < 0.05とした。
精製水に検体を混ぜた場合の吸光度(精製水吸光度)と,PBSに検体を混ぜた場合の吸光度(PBS吸光度)をどのように比較すれば,M蛋白の診断予測因子となるか検討した。精製水吸光度とPBS吸光度を比較するために,以下の2項目を設定し,M蛋白の検出予測における妥当性を比較検討した。測定条件は測定波長340 nm・試薬(精製水及びPBS)80.0 μLに検体16.0 μL分注(5:1)・測光ポイント1(試薬と検体を分注し,約15秒後に攪拌,さらに18秒後に測光)での吸光度を測定した。
差:精製水吸光度-PBS吸光度
倍率:精製水吸光度/PBS吸光度
得られた“差”と“倍率”の各々の値についてM蛋白スクリーニングにおける妥当性の検証として,アウトカムにM蛋白検出の有無(IFE),要因に“差”または“倍率”を投入したMann-WhitneyのU検定を行った。また診断能の比較を行うため,ロジスティック回帰分析を行った。その後,受動者動作特性試験(receiver operating characteristic; ROC)曲線よりYouden indexに基づきカットオフ値を算出し,比較した。
「IV 結果」に後述するが,以降の検討方法では“差”(吸光度変化量)を検討した。
2. 新規M蛋白検出法の確立 1) 波長比較照射可能波長全13種類,試薬(精製水及びPBS)80.0 μLに検体16.0 μLを分注し(5:1),測光ポイント1での吸光度を測定した。
2) 分注量比較試薬(精製水及びPBS)分注量80.0 μLに対して検体分注量を4.0 μL(20:1)・8.0 μL(10:1)・10.0 μL(8:1)・13.3 μL(約6:1)・16.0 μL(5:1)の5パターンに分け,測定波長340 nm・測光ポイント1での吸光度を測定した。
3) 測光ポイント比較測光全27ポイント,測定波長340 nm・試薬(精製水及びPBS)80.0 μLに検体16.0 μLを分注(5:1)での吸光度を測定した。
3. 新規M蛋白検出法の性能評価「IV 結果」に後述するが,本検出法の測定条件を測定波長340 nm・試薬(精製水及びPBS)80.0 μLに検体16.0 μL分注(5:1)・測光ポイント1から得られた吸光度の差(吸光度変化量)として,性能を評価した。
1) 相関性Spearmanの相関にて本検出法の吸光度変化量と年齢・TP・Alb・A/G比・IgG・IgA・IgMを解析,Mann-WhitneyのU検定にて性別・Mピークの有無(蛋白分画)・Siaテスト・M蛋白の有無(IFE)との相関性を評価した。
2) 併行精度対象から低濃度域,中濃度域,高濃度域と考える3種類の検体それぞれを,連続して10回ずつ繰り返し測定した。得られた検体の測定値から,標準偏差(SD)と変動係数(CV%)をそれぞれ求めた。
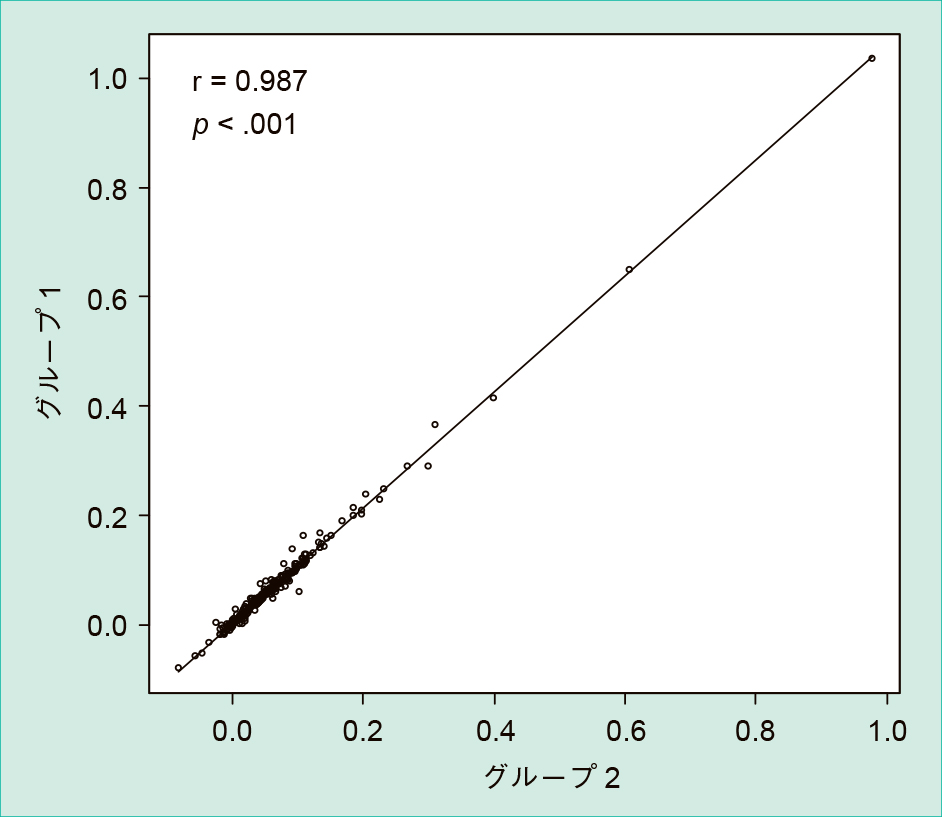
3) ランダマイズ2回測定法検体をそれぞれ二分し,2つのグループとした。2つのグループの検体をそれぞれ独立して測定し,Spearmanの相関,Bland-Altman分析にて評価した。
4) 感度,特異度,ROC曲線アウトカムにM蛋白検出の有無(IFE),要因に本検出法の吸光度変化量を投入したロジスティック回帰分析を行った。その後,ROC曲線よりYouden indexに基づきカットオフ値を算出した。
さらに,M蛋白のスクリーニング検査を行うにあたり,TPやAlbなどに加えて本検出法を加えることが有用であるかどうかを検証するために,多変量ロジスティック回帰分析を行った。アウトカムをM蛋白検出の有無(IFE)とし,要因に年齢・TP・Alb・A/G比の4因子と,その結果に本検出法を加えた多変量ROC曲線を作成し比較した。
“差”と“倍率”いずれもMann-WhitneyのU検定によってM蛋白検出群では有意に低値を示した(p < .001)。“差”では,カットオフ値0.048,ROC曲線下面積(area under the curve; AUC):0.651,感度67.7%,特異度59.1%となり,“倍率”ではカットオフ値1.414,AUC:0.631,感度93.5%,特異度29.2%であった(Figure 1)。2つのAUCについて有意差はなかった(p = 0.20)。

差(—):精製水吸光度-PBS吸光度。
倍率(---):精製水吸光度/PBS吸光度。
結果より“差”のAUCが“倍率”よりも高く,感度と特異度のバランスからも“差”が適当であり,以降の検討では“差”(吸光度変化量)を検討した。
2. 新規M蛋白検出法の確立 1) 波長比較最高平均値が340 nmの0.067であり,長波長側に従って漸減した(Figure 2)。測定に用いる波長は平均吸光度変化量が最も高い340 nmとした。

各波長の吸光度変化量の平均値と標準偏差の折れ線グラフ。
最高平均値が検体分注量16.0 μL(5:1)での0.067であり,検体分注量が増加するに従って漸増した(Figure 3)。測定に用いる分注量は平均吸光度変化量が5パターンのうち最も高い,試薬(精製水及びPBS)分注量80.0 μLに対して検体分注量16.0 μL(5:1)とした。

各分注量の吸光度変化量の平均値と標準偏差の折れ線グラフ。
最高平均値がポイント2(試薬と検体を分注し,約15秒後に攪拌,さらに36秒後に測光)の0.069であり,経時的に漸減傾向であった(Figure 4)。

各測光ポイントの吸光度変化量の平均値と標準偏差の折れ線グラフ。
結果ではポイント2が最高平均値だったが,試薬と検体が攪拌棒で混合された直後のポイント1は,溶液全体が均質状態に近く,ポイント1とポイント2の2群間においてWilcoxon符号付順位和検定を行ったところ,有意差は認められなかった(p = 0.26)。平均吸光度変化量も2番目に高い0.067であったことから,測定タイミングはポイント1とした。
3. 新規M蛋白検出法の性能評価 1) 相関性IgG,IgA,IgM で弱い相関が認められた(Table 4)。Mピークの有無(蛋白分画)ではMピーク有りで有意に低値を示した(p < .001)。一方,Siaテストは陽性で有意に高値を示した(p = 0.006)。M蛋白の有無(IFE)では,有意に低値を示した(p < .001)。
| 解析方法 | 相関係数 | p-value | |
|---|---|---|---|
| 年齢(歳) | Spearmanの相関 | −0.142(相関なし) | < .001 |
| TP(g/dL) | 0.172(相関なし) | 7.00 × 10−3 | |
| ALB(g/dL) | −0.142(相関なし) | < .001 | |
| A/G比 | −0.047(相関なし) | 0.47 | |
| IgG(mg/dL) | 0.260(弱い相関あり) | < .001 | |
| IgA(mg/dL) | 0.276(弱い相関あり) | < .001 | |
| IgM(mg/dL) | 0.349(弱い相関あり) | < .001 | |
| 性別 | Mann-WhitneyのU検定 | ― | 0.61 |
| Mピークの有無(蛋白分画) | ― | < .001 | |
| Siaテスト | ― | 6.00 × 10−3 | |
| M蛋白の有無(IFE) | ― | < .001 |
低濃度域,中濃度域,高濃度域の順にSDは0.002,0.003,0.015であった。CV(%)は34.0%,4.2%,2.1%であった(Table 5)。
| 低濃度 | 中濃度 | 高濃度 | |
|---|---|---|---|
| mean | 0.004 | 0.064 | 0.712 |
| SD | 0.002 | 0.003 | 0.015 |
| CV(%) | 34.0 | 4.2 | 2.1 |
Spearmanの順位相関係数は0.987の強い相関があった(p < .001)(Figure 5)。Bland-Altman分析による一致性では,差の95%信頼区間0.005から0.007(p < .001)であり,有意な固定誤差が認められた。また,相関係数0.55(p < .001)となり,有意な比例誤差も認められた(Figure 6)。
検体を二分し,2グループとした測定値の散布図と最小二乗直線。

X軸:グループ1とグループ2の測定値の平均。
Y軸:グループ1とグループ2の測定値の差。
M蛋白の診断において,本検出法はAUC:0.651(95%信頼区間0.581~0.720)の診断精度が期待できる。カットオフ値を0.048に設定すると,感度67.7%,特異度59.1%となった(Figure 7)。

4因子で予測されたM蛋白診断の正確性を評価したAUCは,0.658であった。一方,4因子に本検出法を加えたAUCは0.723まで増加した。ROCの増加量0.065であり,2つのAUCの差には統計的有意差が確認された(p = 0.028)(Figure 8)。

M蛋白検出法なし(—):年齢+TP+Alb+A/G比
M蛋白検出法あり(---):年齢+TP+Alb+A/G比+本検出法
自動分析装置を用いて,患者血清を精製水およびPBSと混ぜた吸光度差から,M蛋白を予測するための適切な条件探索と臨床的有用性を比較検討した。
吸光度差の評価において,本検査法の根拠となる“差”と“倍率”いずれもM蛋白検出群では有意に低値を示したことから,M蛋白を予測可能と考える。“差”が“倍率”よりも優れていたのは,患者血清の色調(黄疸・乳び・溶血など)による影響を“倍率”では軽減しきれなかったと思われる。例えば,2ポイント法で試料を測定した場合の吸光度から試薬ブランクや検体ブランクの吸光度を差し引いた吸光度変化量のように,“差”の場合は精製水の吸光度からPBSの吸光度を差し引くことで,各患者血清の色調の影響を低減し,蛋白質の塩析・塩溶による混濁の程度がより反映されたと推察される。
新規M蛋白検出法の確立として,測定波長の比較では,本検出法の吸光度変化量は最も短波長である340 nmで最も高く,長波長側にいくにつれて吸光度は減少した。これは濁りの溶液の吸収スペクトルと波形が類似しており10),本検出法で混濁が生じていると考える。
分注量の比較では,最も高い吸光度は試薬(精製水及びPBS)80.0 μLに検体16.0 μL分注(5:1)であり,患者血清の分注量が増加するに従って漸増した。多くの蛋白質は精製水にも溶解するが,少量の塩を添加したPBSは溶解度が上昇しているため,添加する患者血清を増やすほどに溶解度差は顕著となり,吸光度変化量も増加すると思われる。今回の検討は5パターンでの検討であったが,検体量を増加させた分注比率のさらなる検討が必要である。
測光ポイントの比較では,大局観として経時的に吸光度が漸減していた。ポイント1で吸光度が最も高いと推測していたが,結果はポイント2であった。しかし,ポイント1とポイント2の2群間において有意差は認められず,試薬と検体が攪拌棒で混合された直後のポイント1は,溶液全体が均質状態に近く,平均吸光度も2番目に高いことから,測定に用いる波長はポイント1が妥当であると考えた。時間が経つにつれ低下したのは,反応開始から混濁物(塩析)が次第に沈殿していくため,反応直後が測光箇所に混濁物(塩析)が多く存在し,吸光度が高いと推察する。
新規M蛋白検出法の性能評価として,相関性の評価では,IgG,IgA,IgMで有意ではあるが弱い相関を示し,免疫グロブリンとの関連があると思われる。検査の組合せの効率を考える場合,強く相関する検査を組み合わせても,診断効率は上がらない。相関係数rが0.8以上の検査を同時に行う意味は薄く,相関が0.2 < |r| < 0.6となる検査を組み合わせる意義が大きいとされている11)。本検出法は既存の検査と組み合わせることで,診断効率を高める可能性がある。Mピークの有無(蛋白分画)で有意差を認めたことから,本検出法はM蛋白との関連があることが示唆された。本検出法の吸光度変化量をM蛋白検出の有無(IFE)で比較した場合,M蛋白検出群で有意に低値となった。これは非M蛋白患者では血中蛋白質のうち本検出法で塩析する蛋白を数種類一定量含有しているのに対して,M蛋白患者の場合は1種類の蛋白質が総蛋白に占める割合が高いため,その他の蛋白質が相対的に低量となる。従ってM蛋白患者は本検出法で塩析による混濁も少なく,吸光度変化量も低値となると考える。ただし,本検出法の特性上,患者の総蛋白が低値の場合においても,反応する蛋白質量が少ないため,吸光度変化量は低値となる可能性がある。例えば,低γ-グロブリン血症や免疫抑制剤投与患者では,偽陽性となることが懸念される。一方,Siaテスト陽性で有意に高値を示していた。本検出法はSiaテストと同様に精製水を用いた方法であり,蛋白質の混濁を見ている12)。M蛋白の種類が塩析しやすい蛋白の場合,本検出法は異常高値になることが考えられる。Siaテストによる混濁は非特異反応13)とされているが,Siaテスト陽性M蛋白血症例では測定試薬との異常反応報告が散見される14),15)。本検出法が高値の場合,異常蛋白質の存在を示唆している可能性があり,今後本検出法の高値域について検討していく予定である。
併行精度の評価では,本検出法カットオフ値0.048付近の中濃度域でCV(%)は4.2%と差し支えない結果と考える。しかし,低濃度域ではバラツキが大きい。本検出法は比濁法であるため,低濃度域での測定感度が優れているとは言えず16),他の免疫比濁法試薬の報告によると,低濃度域でのCV(%)は10%以上とバラツキがあり17)~20),比濁法の特性である可能性が高い。また,本検出法は同一測定波長を用いた吸光度変化量のため,吸光度差が少なくなり,測定のバラツキが大きくなると思われる21)。ランダマイズ2回測定法では,それぞれ独立して測定した2つのグループの吸光度は強い相関があり,有意差は認めなかった。しかし,固定誤差,比例誤差が認められた。精密さを改善するために検体分注量を増加させ,測定吸光度域を上げることによりバラツキを抑制することは可能である。今回,試薬(精製水及びPBS)分注量80.0 μLと固定し,検体分注量は5パターンのみの検討であったが,更なる検体量を増加させた分注量比率の検討が必要である。加えて,Bland-Altman分析の性質上,本検出法のように新しい検出法の再現性や基準妥当性を検討する場合,複数のグループ・方法による測定値間に差がないことよりも,どの種類の誤差が,どの程度存在し,どの位の誤差ならば臨床応用上問題ないか明らかにすることが重要とされている22)。さらなる検証と本検出法の特性を考慮したカットオフ値の検討が必要と考える。
感度,特異度,ROC曲線の評価では,本検出法は感度67.7%,特異度59.1%,AUCは0.651と単独では診断能が高いとは言えない結果であった。しかし,本研究の目的は,M蛋白を初期の自動分析装置による段階でスクリーニングすることである。そのため,自動分析装置による通常のスクリーニング検査時,M蛋白の見立てに使用されると考える検査項目として,年齢・TP・Alb・A/G比の4因子と,本検出法を加えた場合のM蛋白検出における有効性を多変量ROC曲線より比較した。4因子に本検査法を加えたAUCが有意に増加し,本検出法を診断検査として加えることで,有意に診断能が改善することが示された。本検出法単独では診断能が高くはなく,次のステップとなる免疫グロブリンや蛋白分画,免疫固定法を吟味することになるが,初期段階に本検出法を組み入れることで,診断精度や絞り込みの効率を上げる手助けになると考える。
今後は,実用化に向け測定条件の更なる検討や,症例の蓄積を重ね,実際にルーチン検査に導入することでM蛋白に関わる項目との関連を解析し,正確で安定した本検出法の測定を検討していく必要があると考える。
研究の結果より,本検出法は自動分析装置で測定することが可能であり,検査初期段階でのM蛋白の検出に有用であることが示唆された。
本研究は当院倫理委員会の承認を受けている(21-036)。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。