混成軌道を用いて,ルイスの電子対共有結合の概念にどのようにして同等性(等価性)や方向性を加味できるかを,簡単な分子を例にとって示す.σ電子とπ電子のちがい,π電子が核磁気共鳴スペクトルのケミカルシフトに及ぼす影響についても解説した.
When each of the four identical carbon sp3 hybrid orbitals overlaps with the
hydrogen 1s orbital, four identical C-H σ bonds are formed and methane (CH4)
results. Because the four sp3 hybrid orbitals have a specific geometry, the
angle formed by each H-C-H is 109.47°, the so-called tetrahedral angle. The structure of
ethane (C2H6) is similarly explained. The bonds in methane and
ethane are called single bonds because they result from the sharing of one electron pair
between bonded atoms. Carbon atoms can also form double bonds by sharing two electron
pairs or triple bonds by sharing three electron pairs. Ethylene
(H2C=CH2) contains a carbon-carbon double bond. When two carbons
with sp2 hybrid approach each other, they form a strong σ bond by
sp2-sp2 overlap. The unhybridized p orbitals interact by sideways
overlap to form a π bond, resulting the formation of a carbon-carbon double bond. Four
hydrogen atoms form σ bonds with the remaining four sp2 orbitals to complete
the structure of ethylene. The H-C=C or H-C-H bond angle in ethylene molecule is 121.3°or
117.4°respectively. Acetylene (HC
前回,炭素原子の原子価状態(単独の原子の最も安定な電子配置から昇位させて得た結合をつくりうる電子配置)として,3種の混成軌道について取り扱った [1].今回は,この原子価状態の原子軌道を用いて,簡単な分子を組立てる.2つの原子軌道に1個ずつ属する電子が軌道の重なり合いによって共有され,電子対共有結合を構成するというイメージである.σ電子とπ電子のちがい,π電子が核磁気共鳴スペクトルの測定位置(ケミカルシフト)に及ぼす影響についても取り扱う.
前回述べたように,2s軌道1個と2p軌道3個を混ぜ合わせて生じる4個のsp3混成軌道は同じ形をしていて,その軌道胞の方向は互いに109.47°の角をなしている.1個の炭素原子と4個の水素原子からメタン分子(CH4)を形成するとき,まず,この4個の混成軌道に1個ずつ原子価電子が割り当てられると考える.
ルイスの電子対共有結合の概念を用いて,この炭素の4 個の原子価電子が電子を1個ずつ持つ4個の水素原子とそれぞれ共有されて結合を生成すると考えると,オクテット(電子が8個の殻,ただし,水素は2個の殻)が形成される.Figure 1左図である.右側にはその分子模型を示した.立方体の頂点を1個おきに結んでできる図形は正四面体なので,おのおののH-C-H結合角はいわゆる四面体角 109.47°であり,Figure 1左図は,メタンの4個の結合が等価であることを説明できる.Figure 1における個々のC-H結合は,炭素のsp3 混成軌道に配置された1個の電子と水素の1s軌道の1個の電子が共有されて化学結合が形成されることを表している.このうち,一組だけを取り出して1s軌道とsp3 混成軌道の重なり具合を図示したものがFigure 2である.混成軌道では2s軌道(2s軌道には負符号をつけて描いてある [2])の+の軌道胞(外側)と2p軌道の+の軌道胞の干渉で片方の軌道胞が強め合って大きくなっているので,この方向に水素の1s軌道との重なりが増加し,強い結合を生じて安定化する.混成軌道を作るには2s軌道から2p軌道に1個の電子を昇位させる必要があり,これにはエネルギーが必要である.しかし,新しく4個の強い結合ができることで安定化し,それは,昇位による不安定化を補って余りがあるということになる.作図にあたり,各軌道は等値曲面図で描いたので,2s軌道の内側の-の軌道胞は見えていない.水素の1s軌道は炭素の混成軌道よりも小さい関数値の等値曲面として見やすく描いた.炭素原子は左側の黒い丸印,水素原子は右側の褐色の丸印である.原子間距離はメタンのC-Hの値 (108.7 pm) とした.

The structure of methane; (left): Each sp3 hybrid orbital forms a σ bond by overlap with an H 1s orbital located at the corner of the cube; (right): molecular model of methane.
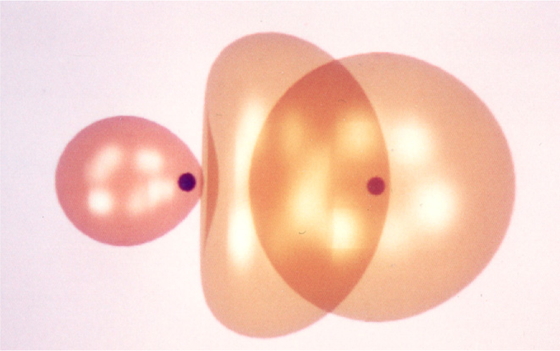
Overlap of carbon sp3 hybrid orbital and hydrogen 1s orbital.
ふたつの軌道は炭素原子と水素原子を結ぶ軸に関していずれも円筒対称である.つまり,この軸に垂直な面ではどこをとってもs軌道に特徴的な円形が観察できるので,σ結合とよぶ(より正確には,σ結合に与かる電子は結合軸まわりの角運動量が0である [3]).σは英語のsに相当するギリシア文字である.
ちなみに,前々回に紹介した水素分子の結合 [3]もσ結合であることは言うまでもない.
エタン(C2H6)の場合も同様にしてsp3混成軌道と1s軌道を使ってFigure 3に示すように分子を組立てることができる.個々のC-H結合のイメージは原子間距離が 109.4 pmとわずかに変化するほかはFigure 2とほとんど同様である.中央のC-C結合はFigure 4に示すようにsp3混成軌道の非対称に張り出した軌道胞同士の重なりであるので,強い結合をつくって安定化する.
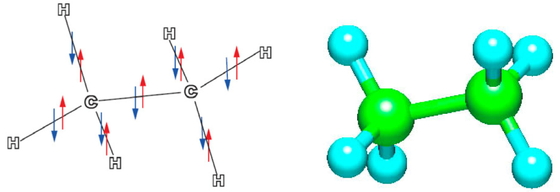
The structure of ethane; (left): Each C sp3 hybrid orbital forms a σ bond by overlap with an H 1s orbital or a C sp3 orbital; (right): molecular model of ethane.

Overlap of carbon sp3 hybrid orbitals.
メタン,エタンのように,一般式CnH2n+2で表される炭化水素をアルカンという.
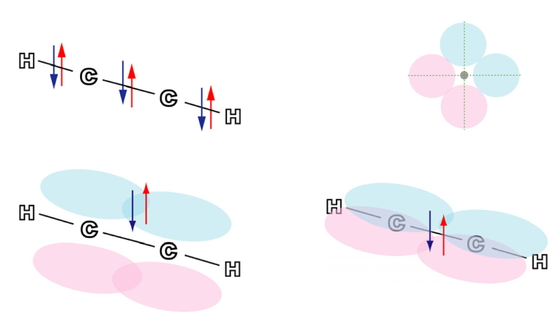
表題の化合物は120°またはそれに近い結合角をもつため,sp2混成軌道で組立てるのが適している.エチレン(エテン,C2H4)のσ結合はFigure 5 左図のように5個ある.炭素と水素の結合は4個あり.結合距離や混成軌道のかたちは若干の違いはあるが,そのイメージはFigure 2とほとんど同じである.炭素炭素σ結合は1個で,そのイメージはFigure 4と類似している.エチレンは平面分子で,炭素炭素結合は常温では回転できない.その理由は混成に与からなかった2p軌道同士がπ結合(Figure 5右図およびFigure 6)を形成し,σ 結合とあわせて二重結合になっているためである.それぞれの2p軌道は分子面が節面となるように+の軌道胞が上側とすれば−の軌道胞は下側というように配置される.この結合を炭素炭素結合軸方向から眺めるとp軌道のかたちが認識できるので,π結合とよばれる(πは英語のpに相当するギリシア文字).
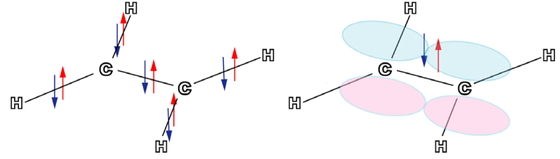
Five σ bonds (left) and a π bond (right) in an ethylene molecule
A π bond image in an ethylene molecule by the overlap of carbon 2p orbitals.
Figure 6は,分子面を水平に保ち,π結合に関与する2つのp軌道をその面の側方から眺めたものである.
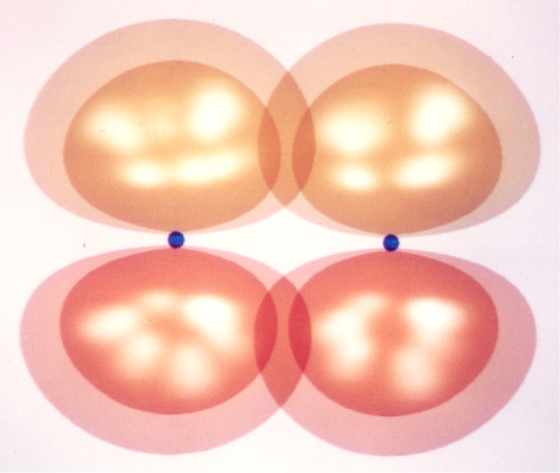
比較のために,同じ原子間距離で2個の炭素原子の2p軌道同士の重なり(σ結合)を描いた(Figure 7).Figure 4の混成軌道のように軌道胞の一方が張り出すという特徴が無いのを反映して,重なりが少なく,弱い結合しか生成しないことが観察できる.しかし,π 結合(Figure 6)の方は,同じ関数値の等値面で描いた内側の軌道胞同士では重なりが観察できず,より絶対値が小さい等値面(外側の大きい軌道胞)ではじめて重なりが見られる程度でしかなく,さらに弱い結合(つまり,結合の生成による安定化が少ない結合)であることがわかる.エチレンのC=C二重結合の結合解離エネルギーは728kJ/molで,エタンのC-C単結合の結合解離エネルギーは377kJ/molであるから,二重結合の値は単結合の値の2倍よりも小さい.Figure 6に示した側面からのπ軌道の重なりが,Figure 4などに見られるσ型の重なりほど有効ではないことを示している[5 (a)].分子軌道法計算では,π電子がHOMO (最高被占分子軌道,電子が詰まっている最もエネルギーの高い軌道)を占有し,LUMO (最低空軌道)もπ型の軌道となる.

A σ bond image by the overlap of carbon 2p orbitals.
アルカン類が化学的に不活性で燃焼などのほかの化学反応を起こしにくい理由は,強固なσ結合のみで構成されているためである.これに対して,エチレンなど二重結合をもつ炭化水素は付加反応などの反応性に富んでいる.その理由は,π結合の電子がエネルギーの高い位置に存在するためである.複数の二重結合が単結合を介して連なっている炭化水素を共役ポリエンという.いくつかの例をFigure 8に示した.前に述べたように,二重結合は回転できないので,E, Z異性体(cis, trans異性体)が存在しうる(Figure 8, (2)と(3)).
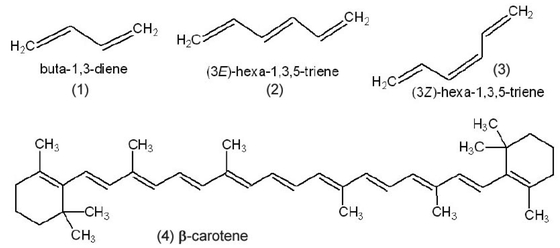
Examples of conjugated polyene.
ポリエチレンは多数のエチレンが重合して生成した高分子量のアルカンである.ポリエチレンが無色であることからもわかるように,アルカンはすべて無色である.これに対して,共役ポリエンは二重結合の数が増すにつれて,次第に着色してくる.たとえば,ニンジンなどに含まれるβ-carotene (4)は,二重結合が11個共役していて,赤橙色である.アルカンはσ結合だけでできているので,HOMOが安定でLUMOが高い準位にあるので,HOMO-LUMOの差が大きく,可視光を吸収できないので無色である.
β−carotene (4)などの共役ポリエンでは,HOMOがπ軌道なのでアルカンより高い準位にあって不安定で,HOMO-LUMOの差が小さい.二重結合数が増すとその差がさらに小さくなるため,可視光の吸収が起こるようになり,着色を呈する [6].
エチレンにおけるH-C-H結合角は117.4°,H-C=C結合角は121.3°で,sp2 混成軌道の120°とはわずかな差がある.主として,-Hと=C< の嵩だかさの違いによるものと解釈できる.
ベンゼン(C6H6)は,正六角形の骨格をもつ分子で,H-C=CまたはH-C-C結合角ならびにC-C=C結合角は正確に120°である.Figure 9左図に示すような共鳴のために,シクロヘキサトリエン型の極限構造式(I),(II)は実際には存在せず,これらよりも安定な共鳴混成体がただ1種存在する.ベンゼンの構造式は(I)や(II)で描かれることが多いが,実際には(III)のようなすべてのC-C結合が同じ長さ(139 pm)の構造がただ1種存在する.エチレンのC=Cの長さは134 pmであるのに対し,エタンのC-C結合の長さは154 pmというように,一般に,二重結合は単結合よりも原子間距離が短いが,ベンゼンの場合は(I)や(II)で描いても,正六角形と解釈する約束になっている. 式(III)の丸印は,π電子が特定の結合に局在してはいない(非局在である)ことを表している.ベンゼンは,仮想的なシクロヘキサトリエンよりも150 kJ/mol安定であると計算されており[5 (b)],この値がベンゼンの共鳴による(非局在化による)安定化の程度を表している.(I)や(II)で描かれている二重結合はエチレンの二重結合とは本質的に異なるものである.ベンゼンは二重結合を持つ化合物に特徴的な付加反応よりはむしろ,置換反応を起こしやすい.このような一群の化合物を芳香族化合物という.
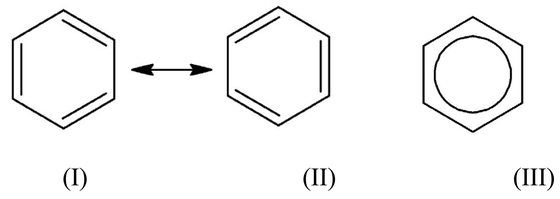
(left): Two benzene resonance forms; (right): A single circle indicates the equivalence of the carbon-carbon bonds.
ヒュッケルは,平面,単環で4n+2個のπ電子を持つ化合物は,芳香族性(安定性)を示し,4n個のπ電子を持つ場合は反芳香族性(不安定性)を示すという理論を提出した[4 (b)].これをヒュッケル則という.
アセチレン(エチン,C2H2)は180°の結合角をもっているため,sp混成軌道で組立てるのが適している.アセチレンのσ結合はFigure 10 左上図のように3個ある.炭素と水素の結合は2個あり,結合距離や混成軌道のかたちは若干の違いはあるが,そのイメージはFigure 2とほとんど同じである.炭素炭素σ結合は1個で,そのイメージはFigure 4と類似している.混成に与からなかった2p軌道は炭素原子1個に対して2個あるので,π結合が2個作られ,σ結合とあわせて3重結合を形成している.Figure 10上右図に分子軸方向から見た2個分のπ軌道図(緑の直線が節平面), Figure 10下図にこの軸の上下および前後にπ軌道が描かれる概略図を示した.正確な図はFigure 16左図に示したので,比較対照していただきたい.
Three σ bonds (top left) and two π bonds (top right and bottom) in an acetylene molecule
アセチレンは直線状分子で,H-C
前々回,水素分子を分子軌道法で取り扱って,HOMOとLUMOそれぞれの差分電子密度図について考察した [4].これはσ結合の差分電子密度図に相当する.今回は,エチレンやアセチレンに見られるπ分子軌道の差分電子密度図を調べてみることにする.
(left) HOMO of ethylene; (right) Difference electron density
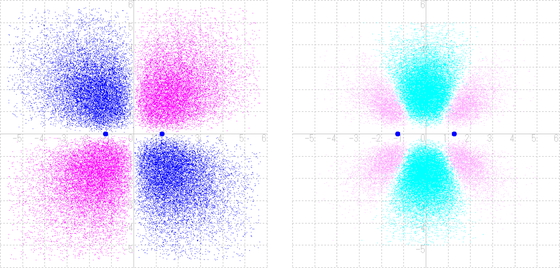
(left) LUMO of ethylene; (right) Difference electron density
Ab initio法と呼ばれる分子軌道法 (STO-3G level)
でエチレンを取り扱うと,炭素原子1と2の2px原子軌道
| (1) |
| (2) |
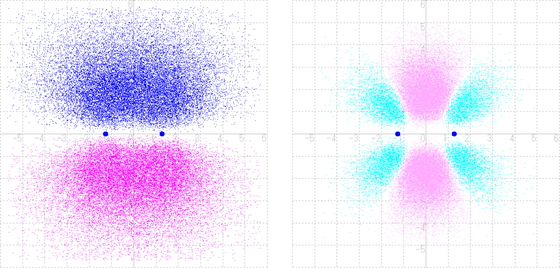
式(1)で表されるHOMOでは,同位相の波の重ねあわせ(位相が合ったとき,in-phase)で強め合っている.原子価結合法の取り扱いのFigure 5右図ならびにFigure 6に示したイメージである.式(1)を電子雲で図示すると,Figure 11左図となる.青色の領域は2p軌道の+の軌道胞同士の重なり,マゼンタ色の領域は-の軌道胞同士の重なりである.式(1)の平方(すなわち,電子の存在確率)からおのおのの成分の平方を差し引いて差分電子密度を計算すると,Figure 11右図となる.中央部に電子密度の増大がピンク色で示されており,+の電荷を持つ炭素原子核(図の・印)は-の電荷を持つピンク領域に引かれて,結合性分子軌道を形成していることが理解される.
式(2)で表されるLUMOでは,異なる位相(out-of-phase)の波の重ねあわせで打ち消し合っている.式(2)を電子雲で図示すると,Figure 12左図となる.2p軌道の+の軌道胞と−の軌道胞が打ち消しあって,中央部に縦の節面(関数値が0になる面)が現れている.式(2)の平方からおのおのの成分の平方を差し引いて差分電子密度を計算すると,Figure 12右図となる.外側部に電子密度の増大がピンク色で示されており,仮にこの軌道に電子が入ったとすれば+の電荷を持つ炭素原子核は−の電荷を持つピンク領域に引かれて,反結合性となることが理解される.
核磁気共鳴(nuclear magnetic resonance, NMR)分光法は,有機化合物の複雑な構造を決定するとき最も有力な手法として活用されている.初期には1Hのみであったが,最近は13Cなどいろいろな核種に用いられ,構造決定における有力な情報を提供している.
NMRが与えるいろいろな情報のひとつに,化学シフトがある.NMRチャートのどの位置に吸収が観測されるかを示す値で,今回登場した化合物等のおよその1Hの値はFigure 13のようになる.基準物質はTMS (tetramethylsilane Si (CH3) 4) で,TMSとの吸収位置の差を「化学シフト」と呼ぶ.化学シフトはδ値(ppm)で示され,1H核のまわりの電子の量によって影響を受ける.
エタンの骨格で例示したアルカン類は,1H核のまわりの電子が豊富なので,高磁場側(チャートの右側)での吸収がおこる.カルボキシル基(-COOH)の1Hは,酸性,つまり,1Hのまわりの電子が少ないので,低磁場側(チャートの左側)での吸収がおこる.

Regeons of the 1H NMR spectrum

Probability density distribution in the 3-dimentional distribution of the highest two occupied benzene orbitals. (left): top view, (center): side view; (right): 18-annulene.
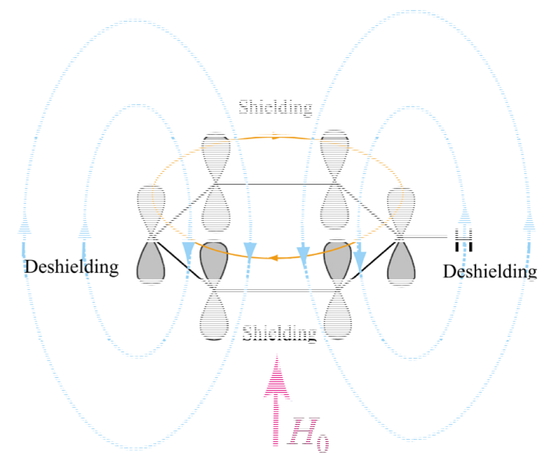
The ring current effects in benzene. Circulating π electrons create a ring current (orange). Induced magnetic field (cyan) reinforces the external magnetic field (H0) near the protons which are deshielded.
sp2混成で組み立てられるベンゼンなどの芳香環についた1Hは,sp3混成で組み立てられるアルカンの1Hとほとんど変わらない酸性度であるが,-COOHの少し右側というような低磁場での吸収を与える.Figure 9で,ベンゼンのπ電子は (I) と (II) の共鳴により非局在と説明した.Figure 14に,分子軌道法で求めた縮重した2つのHOMOにあるπ電子の存在確率をガラス内に彫刻したものを,分子面の上から(左図)ならびに側方から(中央図)観察した図を示した.π電子は,正六角形の分子骨格の上下にドーナツの輪のように分布している [7].ベンゼンを外部磁場H0の中に置くと,環状に非局在化したπ電子による電流が,Figure 15左図に橙色で示したように流れる.これを,環電流という.この電流は,磁場をシアン色で示す向きに誘起する.誘起磁場の向きは,環の内側では外部磁場H0を打ち消す(shielding)が,外側では逆に強める(deshielding)向きになる.ベンゼンの水素は環の外側についているため,低磁場側(δ 7.27 ppm)にシグナルが観察されることとなる.18-Annuleneという化合物は,ヒュッケル則に合致する芳香族化合物で,Figure 14右図に示すように,環内プロトン(図にはひとつだけ示したが,合計6個)を有している.外部磁場を打ち消す内側の誘起磁場の影響で,より強い磁場をかけないと共鳴しないことから,Figure 13にも示したように,−3.0 ppmという高い磁場に観察されることとなる.環外プロトン(図にはひとつだけ示したが,合計12個)は9.3 ppmに観察される(約-60 °Cでの測定).110 °Cの測定では,環の配座の交換が行われるため,これらのほぼ平均値のδ 5.3 ppmにシグナルが観察されるようになる [8].
sp2混成で組み立てられるエチレンの1HのシグナルがFigure 13に示すように低磁場側に観察される理由も,ベンゼンと同じように,分子面に平行な面内の環電流効果で説明される.
sp混成で組み立てられるアセチレンの1Hは前述したように酸性なので,低磁場での共鳴が期待されるが,実際にはアルカンよりもわずかに左側の吸収を与える. Figure
16は,アセチレンのπ分子軌道における電子の存在確率をガラス内に彫刻したものである.2個の縮重したHOMOは,左上の図にHOMO1,HOMO2として示した.左下の図は,この彫刻を分子軸まわりに90°回転したものである.左上図と右上図を見比べると,HOMO1とHOMO2は同じ形で,分子軸回りに90°回転した関係にあることが理解される.右上の図は,彫刻を分子軸方向から眺めたもので,Figure
12右上の概念図に相当するが,概念図とは異なり,分子軸回りに円筒対称であることを髣髴させる.実際,この2軌道を同じC-C軸上に置いて等値曲面図を描いてみると,右下図のように,確かに円筒対称である
[9].アルカンの組立の第2節で,結合軸まわりに円筒対称な場合はσ結合であると述べたが,例外があった.2個のπ軌道はFigure
10右上の概念図に示したように,それぞれが分子軸を含む節平面(緑の直線)を1個ずつ持っているので,結合軸まわりの角運動量が0にはならないのである.2px軌道と2py 軌道は,もともと,その平方が円筒対称な複素関数の2軌道

(left and top right) The Probability density distribution in the 3-dimentional distribution of the highest two occupied acetylene orbitals; (bottom right): The electron density in π orbitals has cylindrical symmetry around the internuclear axis.

Isosurfaces of (left) the squares of hydrogen
Figure 18は,アセチレンの円筒対称なπ電子雲が外部磁場によって受ける影響を図示したものである.アセチレンの1Hはベンゼンとは逆に,誘起磁場によって外部磁場が打ち消されてしまう.したがって,より強い磁場をかけないと共鳴しないため,高磁場シフトを受けるのである [8, 11].酸性度だけを考慮すれば低磁場側に観測されるはずのケミカルシフトが高磁場側に引き戻されるのは,このような理由による.
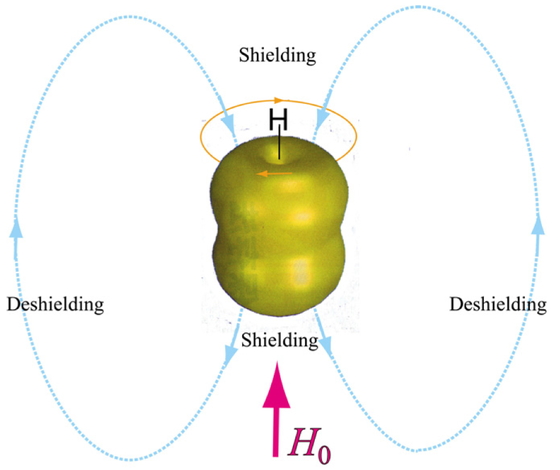
The ring current effects in acetylene. Circulating π electrons create a ring current (orange). The applied (red) and induced (cyan) magnetic fields are opposite and the hydrogen feels weaker net field. This puts the proton in a shielded environment.
今回は,共鳴という用語が2つの意味で用いられており,多少の混乱を招いたかも知れない.ひとつはベンゼンの共鳴で,電子の非局在という意味,もうひとつは核磁気共鳴の話で,こちらは音叉の共鳴のような共振とも呼ばれるものである.ポーリングは1954年にノーベル化学賞を受賞しており,受賞理由となった化学結合に関するテーマを,The Nature of the Chemical Bondという著書に取りまとめている [12].第1章は,共鳴と化学結合というタイトルで,第3章の軌道の混成の項でも原子価結合法に量子力学的共鳴の概念を取り入れたことが記されている.芳香族における共鳴の項は第6章である.大学の有機化学の教科書では,混成軌道ばかりでなく,置換ベンゼンの置換反応における配向性等の説明に,現在も賞用されている.