2012 年 45 巻 12 号 p. 1170-1179
2012 年 45 巻 12 号 p. 1170-1179
症例は45歳の男性で,心窩部痛を主訴に来院した.上部消化管内視鏡検査で胃体中部小彎から前庭部に複数の潰瘍性病変を認め,生検でT細胞性悪性リンパ腫と診断した.末梢血中の抗human T-lymphotropic virus type-1(以下,HTLV-1と略記)抗体は陽性であった.末梢血,骨髄中に異常リンパ球を認めず,CT,PETでは胃と所属リンパ節以外に異常を認めなかったため,胃原発悪性リンパ腫と診断し,胃全摘,胆摘,D2郭清術を施行した.切除組織中にHTLV-1 proviral DNAの組み込みを認めたが,末梢血中にはHTLV-1 proviral DNAを認めず,HTLV-1関連胃原発悪性リンパ腫と診断した.術後は補助化学療法としてTHP-COP療法を6クール施行し,術後27か月を経過したが,再発徴候なく生存中である.
胃原発悪性リンパ腫はそのほとんどがB細胞性であり,T細胞性の頻度は3.8~6%とまれである1)2).さらに,そのうちhuman T-lymphotropic virus type-1(以下,HTLV-1と略記)関連のものの頻度は約36.6%であり3),その予後は極めて不良である4).
今回,我々は手術と補助化学療法により良好な成績が得られたHTLV-1関連胃原発悪性リンパ腫の症例を経験したため,若干の文献的考察を加えて報告する.
患者::45歳,男性
主訴:心窩部痛
出身地:沖縄県
家族歴:家族と疎遠のため不明.
既往歴:特記すべきものなし.
現病歴:2009年4月頃より心窩部痛を認め近医受診.上部消化管内視鏡検査にて,胃体中部小彎に潰瘍性病変を指摘.同部の生検にて悪性リンパ腫と診断され,2009年8月当院に紹介された.
現症:発熱なく全身状態は良好.腹部は平坦,軟で肝臓,脾臓は触知せず,表在リンパ節の腫大は認めない.
血液検査所見:WBC 6,500/μl(Neu. 56.2%,Lym. 36.5%,Mo. 5.9%,Eo. 0.8%,Bas. 0.6%)で異型リンパ球は認めず.RBC 478×104/μl,Hb 15.3 g/dl,Ht 44.8%,Plt 21.9×104/μl.LDHは153 IU/lで正常範囲内.HBs抗原,HCV抗体は陰性であったが,抗HTLV-1抗体は陽性.可溶性IL-2レセプターは2,450.0 U/mlと上昇していた.抗ヘリコバクターピロリIgG抗体は62 U/ mlと高値であった.
上部消化管内視鏡検査所見:胃体中部小彎に不整な潰瘍性病変を認め,前庭部にも複数の不整潰瘍を認めた(Fig. 1).生検標本の免疫染色検査ではCD3陽性で,CD20,CD79a,CD10,bcl-2,bcl-6はいずれも陰性であったことより,T細胞性悪性リンパ腫と診断された.
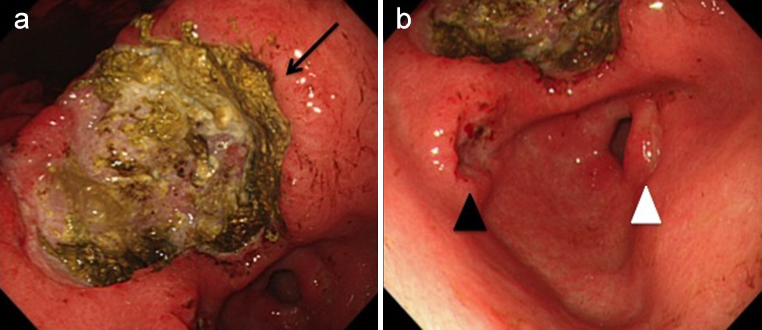
Gastrointestinal endoscopic findings. (a) A large ulcerative lesion can be seen on the lesser curvature of the middle body of the stomach (arrow). (b) Two ulcers can also be seen on the antrum (black and white arrowhead).
頸部・胸腹部造影CT所見:胃体中部に壁肥厚と胃所属リンパ節の腫大を認めた.その他頸部,縦隔,肺門,腹腔内リンパ節の腫大は認めず,肝臓,脾臓に腫大や腫瘤を認めなかった(Fig. 2).
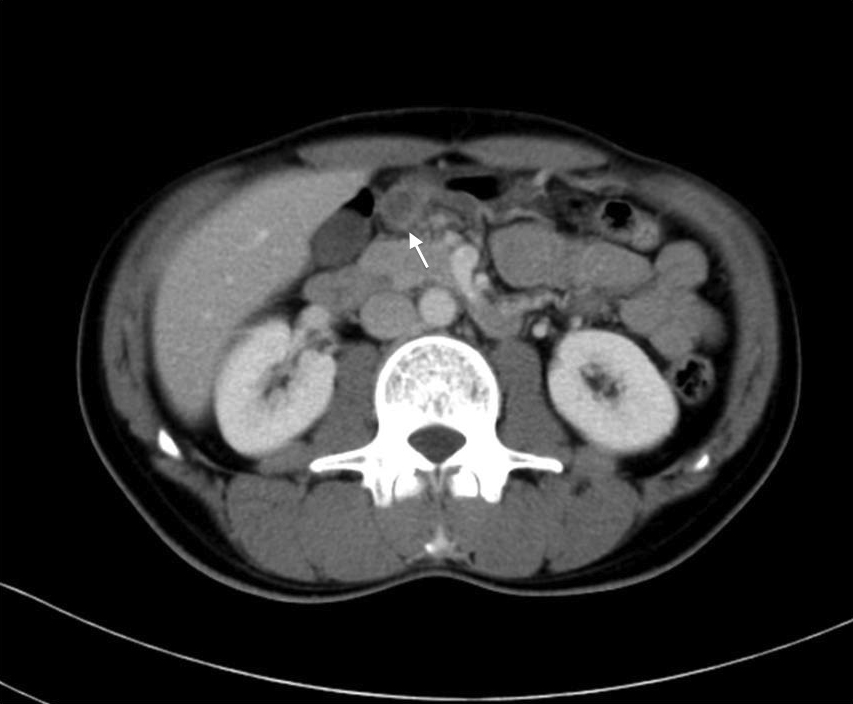
Contrast-enhanced CT shows thickening of gastric wall and multiple perigastric lymphadenopathy (arrow).
FDG-PET所見:CTで認めた胃の壁肥厚と胃周囲の腫大リンパ節に一致してFDGの集積を認めた.その他の臓器には有意なFDGの集積は認めなかった(Fig. 3).

FDG-PET shows FDG accumulation in the gastric lesion and perigastic lymph nodes.
骨髄検査:正常の骨髄像を呈し,表面マーカー,染色体検査でも異常を認めなかった.
手術所見:以上より,胃原発T細胞性悪性リンパ腫,Lugano分類でstage II1と診断し,2009年9月に胃全摘,D2郭清,胆摘,Roux-en Y再建を行った.術中,腹水なく,肝臓,脾臓には異常を認めなかった.胃の漿膜面には腫瘍の露出を認めず,所属リンパ節は第一群に腫大を認めた.胃癌取扱い規約第13版5)に準じて記載すると,T2,N1,H0,P0,M0であった.手術時間3時間28分,出血量300 gであった.
切除標本肉眼所見:胃体中部小彎に7×5 cm大の潰瘍性病変を認め,それに近接して前庭部にも複数の潰瘍性病変を認めた.割面では漿膜下脂肪織まで広範囲に白色充実性の病変を認めた(Fig. 4).
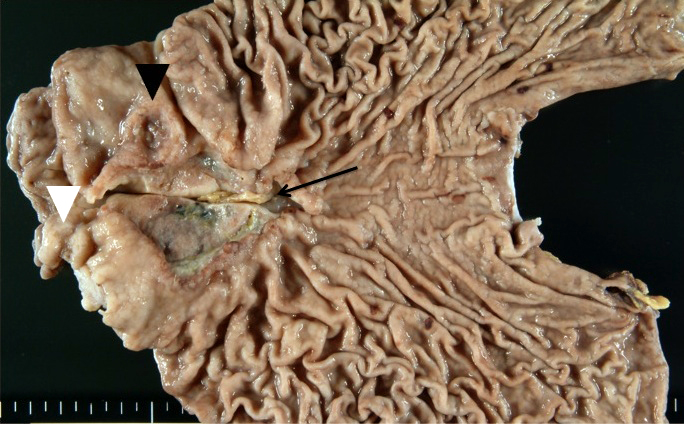
Macroscopic findings of the resected specimen. A large ulcerative lesion can be seen on the lesser curvature of the middle body (arrow) measuring 7×5 cm, and two more ulcerative lesions at the antrum (arrowheads). These lesions are adjacent to each other.
病理組織学的検査:胃体中部小彎の病変と前庭部の病変にはいずれも腫瘍細胞の浸潤を認め,それらは粘膜下で連続し,表層拡大型の腫瘍組織に複数の潰瘍を形成したものと考えられた.
腫瘍細胞は核小体の明瞭な中型から大型核を有し,核には切れ込みや脳回状のねじれなどが見られ,免疫染色検査の結果はCD3陽性,CD8陽性,CD30一部陽性,CD20陰性,CD4陰性,CD15陰性,ALK陰性,Granzyme B陰性,EBV陰性であった(Fig. 5).切除したリンパ節のうち,No. 3,4d,5,6,7,8aに腫瘍の浸潤を認めた.

Microscopic findings. (a) Ulcerative lesions at the middle body (arrow) and antrum (arrowhead), are continuous with each other through the submucosa (HE ×10). (b) Tumor cells have irregular nuclei, and are occasionally indented. (HE ×400). (c) Immunohistologically, CD3 was positive (×400), (d) but CD20 was negative (×400).
胃の凍結組織標本のサザンブロット法による検索6)~8)にてHTLV-1 proviral DNAの組み込みを認めたが,末梢血の検索ではHTLV-1 proviral DNAを認めなかったことから,HTLV-1関連胃原発悪性リンパ腫,Lugano分類でstage II1,胃癌取扱い規約第13版5)に準ずるとT2(SS),N2,H0,P0,M0,stage IIIAと診断した(Fig. 6).

Southern blot hybridization analyses using EcoRI (E) and PstI (P). (a) Analysis of the gastric tumor specimen shows the monoclonal integration of HTLV-1 proviral DNA. 10 μg of DNA is digested with each restriction enzyme, long terminal repeat (LTR) of HTLV-1 proviral DNA is used as a probe, and monoclonal integrated DNA is used as positive control. (b) Analysis of peripheral blood specimen is negative. 5 μg of DNA is digested with each restriction enzyme, and a full-length HTLV-1 probe is used. Lane M, size marker; lane 1, positive control (monoclonal integrated DNA); lane 2, negative control (human placental DNA); lane 3, DNA is extracted from lymphocytes in the peripheral blood of the patient.
術後経過:特に問題なく経過し,術後11日目に退院.その後は血液腫瘍内科に転科となり,術後23日目より補助化学療法としてTHP-COP療法(pirarubicin,vincristine,cyclophosphamide,predonisolone)を6クール施行.化学療法中に可溶性IL-2レセプターは正常値まで低下し,その後再上昇を認めていない(Fig. 7).術後は1か月から3か月に1回の診察と血液検査にてフォローし,術後27か月を経過して再発の徴候なく生存中である.
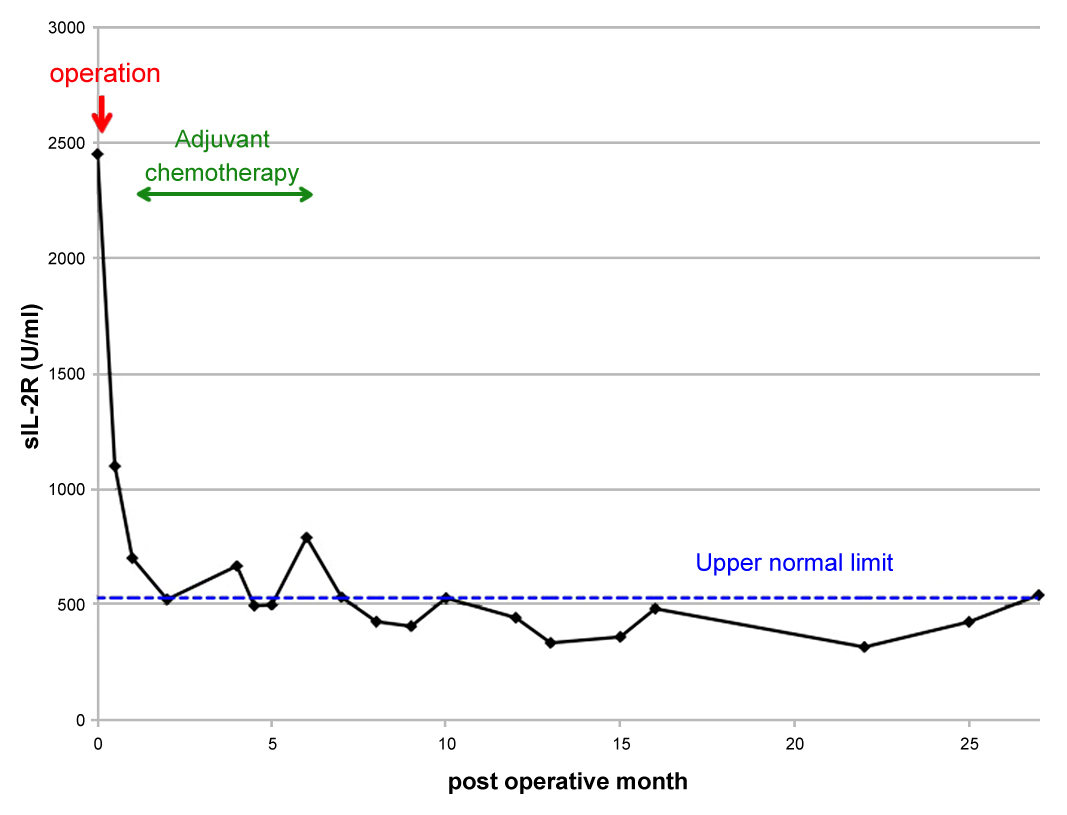
The value of soluble interleukin-2 receptor (sIL-2R) is normalized after operation and chemotherapy, and is maintained within the normal limit for 27 months. The broken line represents the upper normal limit.
胃原発悪性リンパ腫は,胃悪性疾患の約1.2〜2.3%程度とまれな疾患であるが9)10),そのほとんどがB細胞性で,T細胞性の頻度は約3.8〜6%と非常にまれある1)2).
Dawsonら11)が報告している消化管原発悪性リンパ腫の定義は,1)初診時に表在リンパ節を触知しない,2)胸部X線検査で縦隔リンパ節の腫大を認めない,3)末梢血液像で白血球数,分画に異常を認めない,4)肉眼的に浸潤は腸管およびその周辺領域に留まっている,5)肝臓,脾臓に転移がない,の5項目を満たすことであり,本症例はこの項目全てに合致することから胃原発悪性リンパ腫と診断した.
胃原発T細胞性悪性リンパ腫はHTLV-1関連のものと非関連のものに分類され,両者は同じT細胞に由来するが異なった性格を有すると報告されている12).HTLV-1感染は本例患者の出身地沖縄を含めた日本南西部に多発し,成人T細胞性白血病/リンパ腫(adult T-cell leukemia/lymphoma;以下,ATL/Lと略記)の原因とされる.ATL/Lは悪性度が強く,胃への浸潤頻度も約15~30%とまれではないとされており12)13),胃病変は全身性病変の一分症として現れることが多い.胃原発のATL/Lが存在するか否かは議論の残るところではあるが,坂田ら14)はその診断基準として,1)HTLV-1抗体陽性,2)胃生検組織の免疫組織学的検索でT細胞性,3)胃腫瘍組織でのHTLV-1 proviral DNAを陽性,4)末梢血および骨髄中に異常リンパ球を認めず,HTLV-1 proviral DNA陰性,の4項目を挙げており,本症例はこれらの項目にほぼ合致することからHTLV-1関連胃原発悪性リンパ腫と診断した.
岩下ら12)は,ATL/Lの消化管病変を,1)腫瘤形成型,2)多発隆起型,3)表層拡大型,4)肥厚型,5)混在型,の5型に分類しており,全身性ATL/Lの胃浸潤例では表層拡大型が42.1%と最も多く,他の胃原発悪性リンパ腫と比較すると多発性,びまん性の傾向があるとしている.一方,HTLV-1関連胃原発悪性リンパ腫では,全身性ATL/Lの胃浸潤と同様多発性,びまん性の傾向が強いものの,腫瘤形成型の頻度が高いという相違を認める.しかし,個々の症例において内視鏡的な腫瘍の肉眼所見から全身性ATL/Lの胃浸潤か,胃原発のATL/Lかを鑑別することは困難であり15),それらの鑑別には全身の画像検査や,病理,遺伝子検索など総合的な診断が必要である.
医中誌Webにて「HTLV-1」,「胃」,「悪性リンパ腫」をキーワードとして1983年〜2011年12月について検索,またPubMedにて「HTLV-1」,「gastric」をキーワードとして1950年〜2011年12月について検索し(会議録除く),さらにその引用文献も調べたところ,本邦でのHTLV-1関連胃原発悪性リンパ腫は34例報告されているが,そのうち腫瘍組織中のHTLV-1 proviral DNAが陽性であることを確認し,さらに末梢血もしくは骨髄中のHTLV-1 proviral DNAが陰性であることを確認して胃原発と診断されている報告は5例のみである(Table 1)14)16)~19).
| No. | Author | Year | Age | Gender | LDH | sIL-2R | Tumor type | Stage* | H. pyroli | Treatment | Prognosis |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Kojima16) | 1992 | 42 | F | WNL | ND | st | II1 | ND | S+Ch | 31 mo, alive |
| 2 | Takimoto17) | 1994 | 29 | M | High | ND | st | II1 | ND | S+Ch | 31 mo, dead |
| 3 | Sakata14) | 1994 | 63 | F | High | ND | m | II1 | ND | S+Ch | 6 mo, alive |
| 4 | Ito18) | 2004 | 65 | M | WNL | High | su | II1 | ND | S+Ch | 26 mo, alive |
| 5 | Tanaka19) | 2007 | 54 | M | WNL | High | su | II1 | ND | S+Ch | 8 years, alive |
| 6 | Our case | 45 | M | WNL | High | su | II1 | + | S+Ch | 27 mo, alive |
ND: not described, st: solitary tumor forming type, su: superficial spreading type, m: mixed type, S: surgery, Ch: chemotherapy, mo: months, * Lugano International Conference classification
本症例のように,全身性のHTLV-1感染が胃原発の悪性リンパ腫をもたらす機序については,症例数が少ないため明らかにはなっていないが,HTLV-1に感染したT細胞に発現する胃粘膜へのhoming receptorの関与を示唆する報告がある13).
さらに,Ohnitaら20)は,ATL/L患者のうち胃浸潤を伴うものは,伴わないものに比べてヘリコバクターピロリ感染が有意に多く,ヘリコバクターピロリ感染がATL/L細胞に発現するLFA-1などのhoming receptorの活性化やそのligandであるICAM-1の発現亢進に関与してATL/L細胞の胃浸潤につながる可能性があると報告している.
これまでのHTLV-1関連胃原発悪性リンパ腫の報告で,ヘリコバクターピロリ感染の有無が記載されているのは3例のみであるが,結果はいずれも陽性であった21)22).本症例でも血清抗ヘリコバクターピロリ抗体が陽性であり,その感染がリンパ腫の発生に関与した可能性がある.
胃原発悪性リンパ腫の治療は手術,化学療法,放射線療法などが単独あるいはそれらを組み合わせて行われているが,手術単独施行群と化学療法施行群では化学療法群の方が全生存が良いこと23),化学療法単独群と手術後化学療法群とでの全生存率が変わらないこと23)24),などを理由に,近年では患者のQOLを考慮し,根治切除可能な症例においてでも非手術治療が推奨され,手術の適応は穿孔や止血困難例などに限るとされる.しかし,これら治療法の比較はB細胞性胃原発悪性リンパ腫を対象にしていることが多く,T細胞性胃原発悪性リンパ腫はB細胞性に比較して化学療法の効果に乏しく予後不良であり2),さらにHTLV-1関連胃原発悪性リンパ腫はHTLV-1非関連に比べて予後不良であると報告されている4)25).
また,ATL/Lについては,VCAP-AMP-VECP療法(vincristine,cyclophosphamide,doxorubicin,prednidone(VCPA),doxorubicin,ranimustine,prednisone(AMP),vindesine,etoposide,carboplatin,prednisone(VECP))が非ホジキンリンパ腫に対する標準治療である(biweekly)CHOP療法(cyclophosphamide,doxorubicin,vincristine,prednisone )に比較して有意に全生存率の延長をもたらすことがJCOGリンパ腫グループから報告されたが26),生存期間の中央値は約13か月と依然として極めて不良であり化学療法のみでの治療には限界がある.さらに,近年,分子標的治療薬である抗CCR4抗体などの新規治療薬の効果が有望視されているが,いまだ臨床試験の段階である27)~29).また,全身性のATL/Lに対しては,化学療法で寛解が得られた場合に同種造血幹細胞移植が行われ,3年生存率が33%と報告されている30).
一方で,症例数は限られるものの,Lugano分類でstage I,IIであれば,本症例も含め手術を行うことにより長期生存を得られた報告も散見されることから15)16)18)19)22),HTLV-1関連胃原発悪性リンパ腫に対しては,現時点では積極的に手術を行うべきであると考える.
手術術式としては,胃悪性リンパ腫は粘膜下腫瘍様の拡がりを呈して病変の範囲を術前に診断することが困難なことが多く,また多発病巣が多く,残胃再発症例もあることから,M,A領域で単発の限局性病変を確実に把握できる場合を除き,胃全摘が第一選択とされることが多い9)31).リンパ節郭清の範囲については,一般にD2が適当であるとされる3)9).PETによる検索を行うことで術前のstagingの精度があがると報告されているが,一方で炎症,感染,肉芽腫性病変などによる偽陽性や,小病変での偽陰性の問題がある32).さらに,悪性リンパ腫におけるPETの検出能は組織型によって異なり,特にperipheral T-cell lymphomaでは検出感度が40%と低いとの報告もある33).胃悪性リンパ腫においてリンパ節転移の有無は重要な予後規定因子であるとされており9),リンパ節郭清は治療的な意義に加え,転移リンパ節を正確に診断して,予後予測や術後の補助療法など治療方針の指針とする診断的な意義も大きい.
術後の補助化学療法については,限局期のびまん性大細胞性B細胞性リンパ腫(diffuse large B-cell lymphoma)でも根治切除後に65%の再発を認め,さらにその多くは手術切除の及ばない全身性の再発であり23),T細胞性のリンパ腫の予後はB細胞性に比べて悪いことを考慮すると必須であると考えられる.HTLV-1関連胃原発悪性リンパ腫の補助化学療法として確立されたものはないが,前述のVCAP-AMP-VECP療法や新規薬剤の導入による効果が期待される.
利益相反:なし