2012 年 45 巻 12 号 p. 1194-1201
2012 年 45 巻 12 号 p. 1194-1201
症例は62歳の男性で,10年程前より糖尿病にて加療されており,2007年のCTで膵体尾部の腫大を指摘されたが経過観察となっていた.2010年8月頃より頻回の下痢を認めるようになり,同年12月に同症状および高血糖・高ケトン血症を認め前医入院となった.精査にて膵vasoactive intestinal polypeptide(以下,VIPと略記)産生腫瘍と診断され,2011年1月当院内科に転院となった.膵体尾部ほぼ全体を占める腫瘍で肝転移および胆囊総胆管結石を伴っており,脱水や電解質異常は保存的に補正できたものの,2 l/day近い下痢が改善しないため,手術目的に当科紹介となった.同年2月初旬に膵体尾部切除術,肝部分切除,胆囊摘出術および総胆管切開切石術を施行した.術直後より下痢は消退傾向となり,術後1日目には消失した.血中VIP値に関しても術後3時間で著明に低下し,高血糖や顔面紅潮,高カルシウム血症も術後2日目までには全て軽快した.
神経内分泌腫瘍(neuroendocrine tumor;以下,NETと略記)のうち膵vasoactive intestinal polypeptide(以下,VIPと略記)産生腫瘍は,過剰産生されたVIPの生理作用増強により,難治性水様性下痢,低カリウム血症,胃無酸症の三徴などを呈する,1958年にVernerら1)により,the watery diarrhea,hypokalemia,achlohydria syndrome(以下,WDHA症候群と略記)と報告された非常にまれな疾患である.今回,我々は同疾患に対する周術期加療を経験したため若干の考察を加え報告する.
患者:62歳,男性
主訴:水様性下痢
既往歴:22歳時虫垂炎にて手術加療,高血圧.
家族歴:特記すべきことなし.
嗜好歴:アルコール5合/day.
現病歴:10年程前から糖尿病と診断され加療されていた.また,2007年にCTにて膵体尾部の腫大を指摘されていたが(Fig. 1),経過観察となっていた.2010年8月より下痢が頻回となり,前医を受診した.CTにて膵の腫大が増悪しており,精査を勧められたが下痢が軽快していたため拒否し経過観察されていた.しかし,同年12月に頻回の下痢が出現し,かつ食事摂取不良およびインスリン自己中断による高血糖・高ケトン血症を認め,前医に入院となった.血液検査所見上,血中VIP値が異常高値であり,膵VIP産生腫瘍を疑われたため,精査加療目的に2011年1月中旬に当院内科に転院となった.
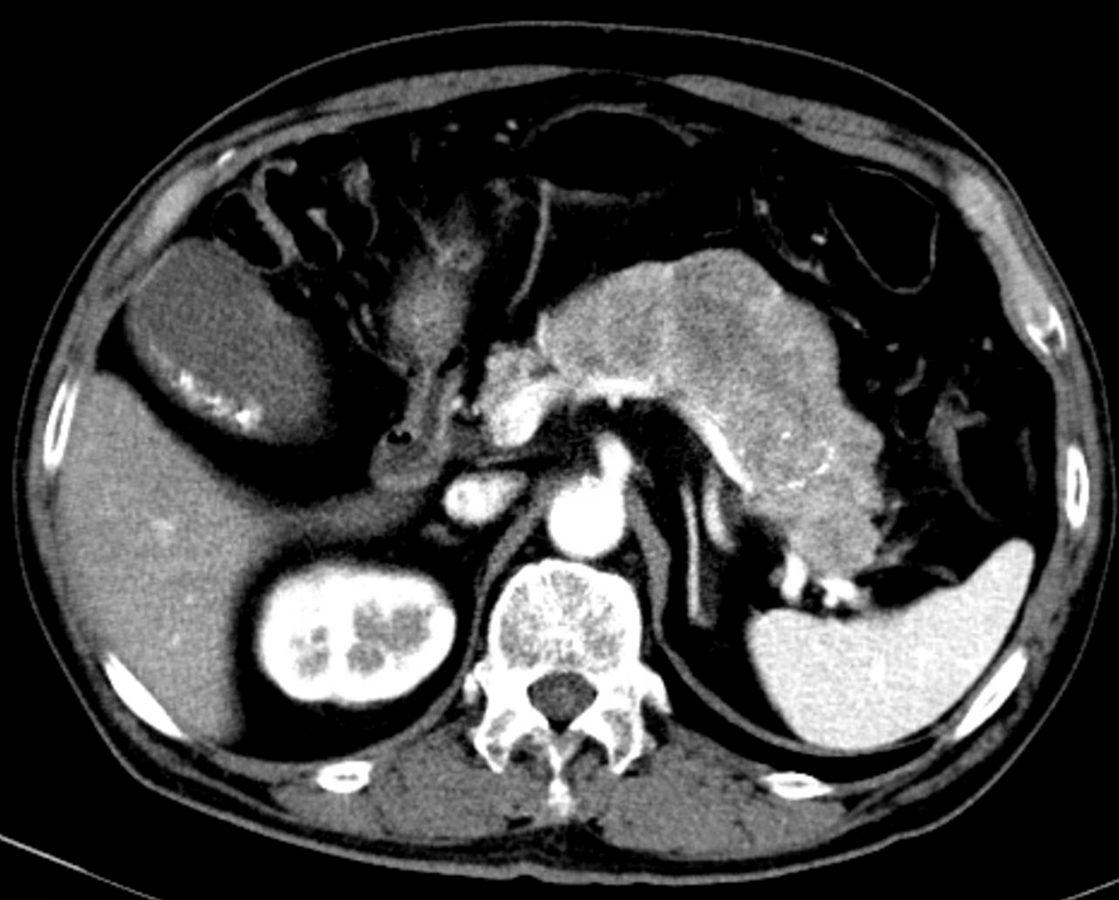
Abdominal CT in 2007 shows enlargement of the pancreatic body to the tail (4.2 cm).
入院時現症:身長162 cm,体重51.7 kg.血圧90/65,脈拍85,体温36.2°C.顔面の紅潮あり,腹部平坦・軟,右下腹部に虫垂炎の手術痕を認めた.
血液検査所見:BUN/Crの上昇,低カリウム血症,著明な代謝性アシドーシスを認めた.また,著明な高カルシウム血症も認めた.各種ホルモン検査も施行され,VIPは5,850 pg/ml(基準値:100 pg/ml以下)と異常高値を認めたが,その他は正常範囲内であった.その他肝胆道系酵素およびビリルビンの上昇を認めた(Table 1).
| WBC | 9,210 /μl | CRP | 0.1 mg/dl | PTH-rP | <1.1 pmol/l |
| RBC | 484×104 /μl | PTH | 31.7 pg/ml | ||
| Hb | 14 | PT-INR | 1.21 | Calcitonin | 42 pg/ml |
| Ht | 41.4 | APTT | 43.3 sec | FT3 | 2.63 pg/ml |
| Plts | 16.1×104 /μl | FDP | 9 μg/ml | FT4 | 1.18 pg/ml |
| TP | 5.9 g/dl | TSH | 0.85 μU/ml | ||
| T-Bil | 1.3 mg/dl | pH | 7.134 | ACTH | 20.5 pg/ml |
| D-Bil | 0.8 mg/dl | pCO2 | 19.8 mmHg | Cortisol | 23.8 MCG/dl |
| AST | 350 IU/l | pO2 | 119 mmHg | Gastrin | 79 pg/ml |
| ALT | 337 IU/l | HCO3– | 6.4 mmol/l | Glucagon | 63 pg/ml |
| ALP | 730 IU/l | BE | –22.0 mmol/l | VIP | 5850 pg/ml |
| γ-GTP | 51 IU/l | ||||
| LDH | 346 IU/l | CEA | 7.6 ng/ml | IgG4 | 21.5 |
| ChE | 107 IU/l | CA19-9 | 62 U/ml | ANA | <20 |
| CPK | 30 IU/l | DUPAN-II | 52 U/ml | ||
| s-Amy | 91 IU/l | BS | 166 mg/dl | ||
| BUN | 24 mg/dl | HbA1c | 7.7 | ||
| Cr | 0.93 mg/dl | ||||
| Na | 134 mEq/l | ||||
| K | 3.2 mEq/l | ||||
| Cl | 103 mEq/l | ||||
| Ca | 11.8 mg/dl | ||||
| P | 3.1 mg/dl |
腹部超音波所見:膵体尾部にびまん性に広がる比較的境界明瞭で,辺縁が分葉状,内部エコーが不均一な腫瘍性病変を認めた.
造影CT所見:門脈直上部からほぼ膵体尾部全体を占める内部造影効果の乏しい長さ15 cmの腫瘍性病変を認めた.また,腸管内や胆囊は内容液により拡張・緊満し胆囊結石・総胆管結石も認めた.下垂体,甲状腺,副甲状腺や副腎には明らかな異常を認めなかった(Fig. 2).
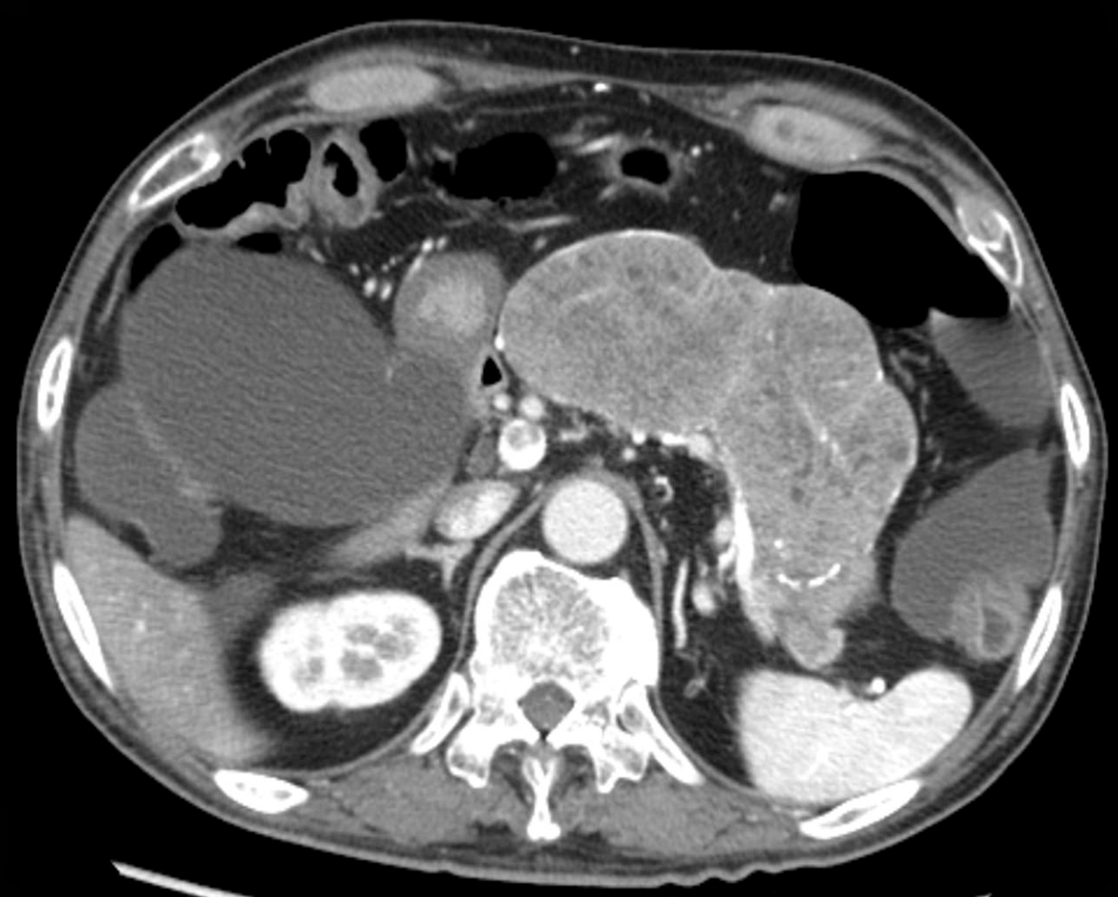
Abdominal CT on admission shows the pancreatic tumor was 5.5 cm and occupies the pancreatic body and tail.
腹部血管造影所見:膵体尾部の腫瘤は造影早期にて辺縁を中心に不均一に濃染し,脾静脈一部に狭小化が見られ浸潤が疑われた.また,S4肝表に門脈相にて低吸収,動脈早期相にて濃染,後期相ではリング状濃染を呈する8 mm大の結節性病変を認め,肝転移病変と考えられた(Fig. 3).
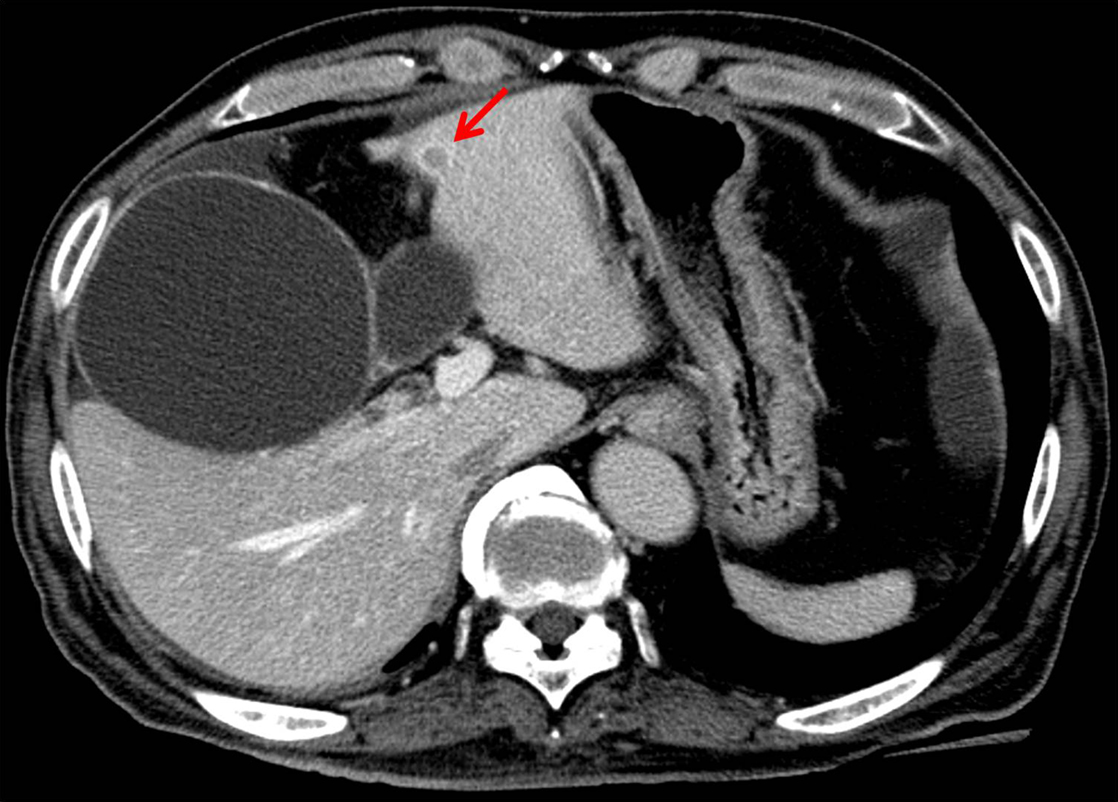
Abdominal CT on admission shows a metastatic lesion in segment 4 of the liver (arrow).
PET-CT所見:膵体尾部腫瘤に一致した,SUVmax早期8.4,後期9.0の集積を認めた.その他の部位には集積を認めなかった.
入院後経過:上記検査所見より,膵VIP産生腫瘍と診断された.総胆管結石に起因すると思われる肝胆道系障害を認めたが,発熱は無く腹部症状も認めなかったため保存的加療を開始し,脱水・電解質補正を行った.しかし,octleotide 100 μg×2/dayを開始するも2 l/day近い水様便を認めており,3~4 l/day近い補液と100 mEq/dayのカリウムの投与を必要とする状態が改善せず,肝胆道系酵素の低下も認めなかったため,2011年2月初旬に手術施行とした.
手術所見:門脈直上部から膵体尾部,脾門部にかけて腫瘤性病変を認めた.漿膜面には拡張した血管を認め,周囲との癒着が強く易出血性であった.門脈への浸潤は認めなかったため,門脈直上にて膵を切離し膵体尾部切除,脾臓合併切除を行った.また,胆囊は緊満し,膵臓と同様に漿膜面に血管拡張像を認め剥離の際に容易に出血した.胆囊摘出術および総胆管切石術も併施し,また肝S4転移巣も同時切除を行った.手術時間は7時間14分,術中出血量は1,370 mlであった.
病理組織学的検査所見:膵体尾部は表面平滑な充実性腫瘍がほぼ全域を占めており,膵尾部では周囲脂肪組織に浸潤していたが,剥離断端は陰性であり,脾動静脈への浸潤も認めなかった(Fig. 4).腫瘍細胞はクロマチンが増加した類円形~卵円形核と比較的豊富な淡塩基性~両染性,顆粒状胞体をもつ立方状~円柱状を呈しており,免疫染色検査にて,chromogranin・synaptophysin・VIPが陽性であった(Fig. 5).核分裂像は一つ程度で,Ki-67指数は1~2%と低値であった.以上より,高分化型膵VIP産生腫瘍と診断された.また,切除肝からも同様の所見が得られた.
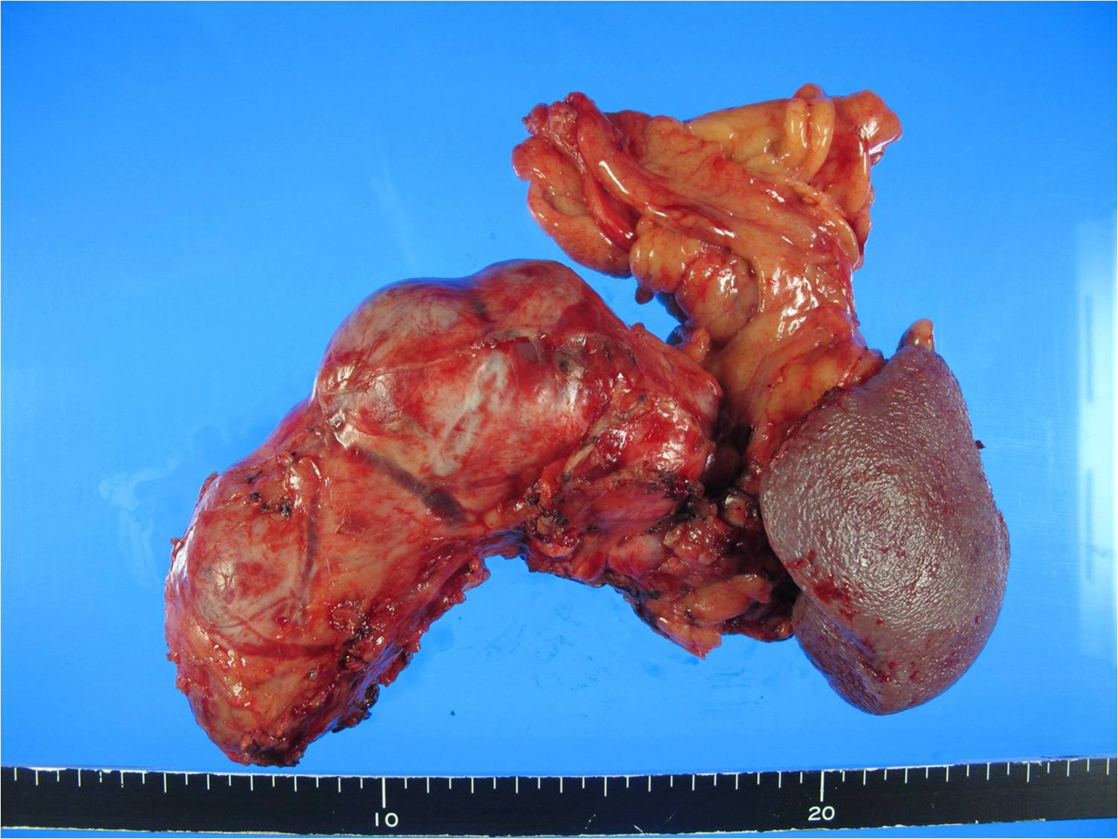
Resected specimen shows that the tumor grows expansively and occupies the pancreatic body and tail. There are also many dilated blood vessels on the surface.

Histological and immunohistochemical examinations of the resected specimen. A: Hematoxylin-eosin staining (×200) shows that the nuclei of tumor cells are oval with finely granular nuclear chromatin structures. B: Chromogranin is positive (×100). C: Synaptophisin is positive (×100). D: VIP is also positive (×100).
術後経過:標本摘出後より水様性下痢の量が低下し,術後1日目より100 ml/day程度と著明に改善した.また,標本摘出後3時間時点の血清VIP値は361 pg/mlと著減していた.顔面の紅潮および代謝性アシドーシスも術直後より改善を認め,高カルシウム血症に関しても徐々に改善し,術後2日目には正常値となった.血糖に関しても,やや高値であったものの,経口血糖降下薬の内服のみで済む程度に改善した.誤嚥性肺炎により退院に時間を要したが,術前の諸症状は再燃することなく経過し術後27日目に退院となった.退院後の血中VIP値は14 pg/mlと正常値内にまで低下していた.切除後28か月現在,無症状,無再発で健在である.
WDHA症候群は1958年にVernerら1)により最初の報告がなされ,Verner-Morrison症候群,VIPoma,pancreatic choleraなどとも呼ばれる.WDHA症候群を呈するVIP産生腫瘍は90%が膵内分泌腫瘍によるものであるが2)3),この他後腹膜・食道・肝臓・小腸・副腎・神経などにも発生することがある.発生頻度は欧米の報告では膵内分泌腫瘍のうちの10~15%3)で約1千万人に1人の発生率であり,本邦では膵内分泌腫瘍中の1.2%とされる非常にまれな腫瘍である4).医学中央雑誌にて1983年から2011年までで「膵」,「VIP」,「腫瘍」で検索を行ったところ(会議録を除く),44件の報告のみであった.本疾患の原因物質であるVIPは,血管拡張,胃液分泌抑制,胆汁・膵液・腸液分泌亢進作用を有し,膵管だけではなく全身の自律神経系に広く受容体の分布する神経伝達物質ペプチドホルモンである.Parkら3)は同物質の血中濃度が200 pg/ml以上で,1日700 ml以上の難治性の水様性下痢が持続し,かつVIP産生腫瘍が同定されればWDHA症候群と診断することとしている.本邦で報告されている例の多くは,頻回の下痢や嘔吐に対する精査にて発見されていた.しかし,自験例は2007年の時点より膵の腫大を指摘されており,この時点でVIPomaを発症していたことが推測されるが,当時は下痢を認めていなかった.その理由として,VIPの血中半減期が約0.6分5),組織内半減期が約3分と非常に短いとされており,症状が出現する血中濃度に達していなかったものと推測された.また腫瘍摘出後3時間で血中VIP濃度が著減し,下痢,顔面紅潮,高カルシウム血症が術後早期に改善した点もそれを裏付けるものと考えられた.また,高血糖はVIPによる肝グリコーゲン分解作用および低カリウム血症によるインスリン分泌抑制作用によるものと考えられているため2),切除により高血糖状態が改善したものと考えられる.
膵内分泌腫瘍の臨床病理学的分類に関しては,Table 2のようなWHO分類6)などが用いられており,予後予測因子として使用されている.WHO分類を用いた場合,本症例はlow grade/neuroendocrine neoplasm,grade 1になるものと考えられ,予後は良いものと考えられる.しかし,現状の分類では転移が発生した場合などの進行した病態は考慮されてなく,治療法決定に直接結びつくものではないとされており7),今後更なる改善が期待される.
| Grade | Differntation | Systems of nomenclature | Grading systems |
|---|---|---|---|
| Low grade | Well differntiated | Neuroendocrine neoplasm, grade 1 | <2 mitoses/10 HPF AND <3% Ki67 index |
| Intermediate grade | Neuroendocrine neoplasm, grade 2 | 2–20 mitoses/10 HPF OR 3–20% Ki67 index | |
| High grade | Poorly differntiated | Neuroendocrine carcinoma, grade 3, small cell carcinoma Neuroendocrine carcinoma, grade 3, large cell neuroendocrine carcinoma |
>20 mitoses/10 HPF OR >20% Ki67 index |
治療法としては,外科的切除術が原則であるが,本疾患の約60%は診断時に既に転移を認めると報告されている8).しかし,悪性例でも進行は緩徐であり9),再発部として最多とされる肝転移10)に関しても摘出術が有効であるといわれている8)10).本邦においては,前述の報告例44例のうち,肝転移を認めた症例は本例を含め6例であり,3例はoctreotide投与にて症状の軽快を認め,1例は肝両葉およびリンパ節多発転移例で原発巣切除を行ったが死亡していた.もう1例は多発肝転移を認めていたが,原発巣切除を行い症状を軽快させた後にTAEおよびstreptozotosinによる転移巣のコントロールを行っていた.しかし,これらに対し,本症例は肝転移巣を認めたが治癒切除が可能であり,切除後も無再発状態を維持している.長期のoctreotide投与により症状をコントロールしていた例は多数見られるが,octreotideが徐々に不応となり手術に転じた例は散見されるため,治癒切除が可能な場合は,転移巣に対しても積極的に外科的切除を行うことが望ましいと考えられた.しかし,手術の際は本例のごとくVIPの血管拡張作用による易出血性が想定されるため,注意が必要である.
切除不能例に対しては,ヨーロッパ神経内分泌腫瘍研究グループ(European neuroendocrine tumors study group;以下,ENETSと略記)は化学療法,octreotideの投与を推奨している11).Octreotideは症状の軽減のみではなく,腫瘍増殖抑制効果もあるとされ9)10),ソマトスタチン受容体subtype 2を発現する高分化型NETに対し推奨している.しかし,肝転移巣への効果は不明で分化度の低いNETには適応はないとされている.また,低分化型にはCDDPとetoposide,高分化型で増殖速度が遅い場合にはoctreotide単独やIFNαの併用が勧められ9),増殖速度が速い場合にはstreptozotocin(STZ)と5-FUが推奨されているが,STZも本邦では認可されていない.その他,肝転移例にはラジオ波焼却療法(RFA),経動脈的塞栓療法(TAE)などの治療法も推奨されているが,非切除症例に対する治療法は欧米と比べて後れをとっていることが明らかであり,今後の進展を期待したいところであるが,本邦にて2011年12月よりmammalian target of rapamycin(mTOR)阻害薬であるeverolimusが膵NETに対し保険適応となった.臨床試験にて,単独使用およびoctreotideとの併用の両群ともに有効性が認められており12),切除不能例に対する効果が期待される.
利益相反:なし