2013 年 46 巻 9 号 p. 654-661
2013 年 46 巻 9 号 p. 654-661
肺癌や胃癌,乳癌などの固形癌にネフローゼ症候群を合併した例は多数報告されている.Gastrointestinal stromal tumor(以下,GISTと略記)に随伴したネフローゼ症候群の報告例は,1950年から2012年9月までのPubMedで検索した結果,1例のみであった.今回,我々は胃GISTに随伴した膜性腎症を発症し,根治手術によってネフローゼ症候群が軽快した症例を経験したので報告する.症例は73歳の男性で,両下腿の浮腫を主訴に内科を受診した.血液・尿検査よりネフローゼ症候群と診断し,腎生検で膜性腎症の診断を得た.蛍光抗体法により悪性腫瘍に随伴する二次性膜性腎症が疑われた.精査で,膵臓や横隔膜脚に広範に接する直径10 cm大の胃GISTが疑われたため,胃全摘,膵体尾部切除を行った.術後,血清総蛋白やアルブミンは上昇し,尿蛋白/尿中クレアチニン比は低下した.
1966年にLeeら1)が悪性腫瘍とネフローゼ症候群との関連に関して報告して以来,悪性腫瘍にネフローゼ症候群を合併した報告例は多数報告されている.このうち,肺癌,胃癌,乳癌,大腸癌などの固形癌に合併する膜性腎症の報告例を多く認める2)3).しかし,gastrointestinal stromal tumor(以下,GISTと略記)に合併した膜性腎症の報告例はほとんど見受けられない2).今回,我々は胃GISTに随伴した膜性腎症でネフローゼ症候群を呈し,手術によって軽快した症例を経験したので報告する.
患者:73歳,男性
主訴:両下腿の浮腫
既往歴:異型狭心症,糖尿病
現病歴:2011年3月,糖尿病に対する定期尿検査で蛋白(3+)を指摘された.また,4月上旬より両下腿の浮腫が出現した.精査目的で施行した血液生化学検査で,血清アルブミン1.1 g/dlと低アルブミン血症を認めたために,ネフローゼ症候群の診断で内科紹介となった.
病理組織学的検査所見(腎生検):基底膜にスパイク病変を認めた.メサンギウム細胞および基質は軽度増加し,糸球体の腫大を認めた.小動脈に中等度の硬化像を認めたが,硝子化は軽度であり,糖尿病性変化は乏しいと考えられた(Fig. 1).以上より,膜性腎症(Stage II>III)と診断した.蛍光抗体法では,IgG4陽性である以外に,IgG2が強陽性を示したことから,一次性膜性腎症よりも二次性が強く疑われた(Fig. 2a, b).

Microscopic needle biopsy findings of renal tissue include spike formation on the basal membrane and mesangial proliferation. Vascular changes indicative diabetes mellitus were slight. Periodic acid-methenamine-silver stain (×200).

Immunofluorescence staining shows IgG2 grading of 3+ (a) and IgG4 of 1+ (b).
悪性疾患の検索目的で施行した上部消化管内視鏡検査およびCTで,胃上部後壁を中心とした直径8 cm程度の粘膜下腫瘍を認めた.内視鏡下穿刺吸引細胞診では,c-kit(–),CD34(–)である壊死組織が得られたのみであり,確定診断には至らなかった.5月に手術目的で外科紹介となった.縫合不全などの合併症のリスクは少なくないものの,厳重な周術期管理によって合併症は軽減し,良好な術後経過をとる症例が散見されることを説明したが,手術を拒否した.GISTが強く疑われたものの,病理組織学的には診断未確定であり,イマチニブは使用できないため,浮腫に対する利尿剤投与のみを強く希望された.外来では,2週毎の体重測定で浮腫増悪による体重増加があることや,血清アルブミンが低下し続けていることを具体的に提示し,対症療法では改善せず,手術が必要である旨を説明し続けた.7月下旬より腹部膨満感,下肢浮腫が増悪し,2か月で体重が8 kg増加したために,内科に入院した.ようやく手術の同意が得られたため,外科に再紹介となった.
入院時現症:TP 3.5 g/dl,Alb 0.4 g/dlと低値を示し,T-Chol 271 mg/dl,1日尿蛋白量11.10 gであることから,ネフローゼ症候群の診断基準を満たしていた.
上部消化管内視鏡検査所見:胃上部後壁を中心として,食道胃接合部~胃中部まで内腔に突出し,頂部に陥凹と露出血管を有する粘膜下腫瘍を認めた(Fig. 3).

Endoscopy shows a gastric submucosal tumor with a central umbilication located in the cardia of the posterior wall.
腹部CT所見:胃上部に主座を置く辺縁整の充実性腫瘍は,9.0×7.6 cmから10.7×9.1 cmに増大していた.同腫瘍は不均一に中等度造影され,内部には壊死と考えられる低吸収域を認めた(Fig. 4a).右横隔膜脚,膵体尾部に広く接していたが,明らかな浸潤所見は認めなかった(Fig. 4b).
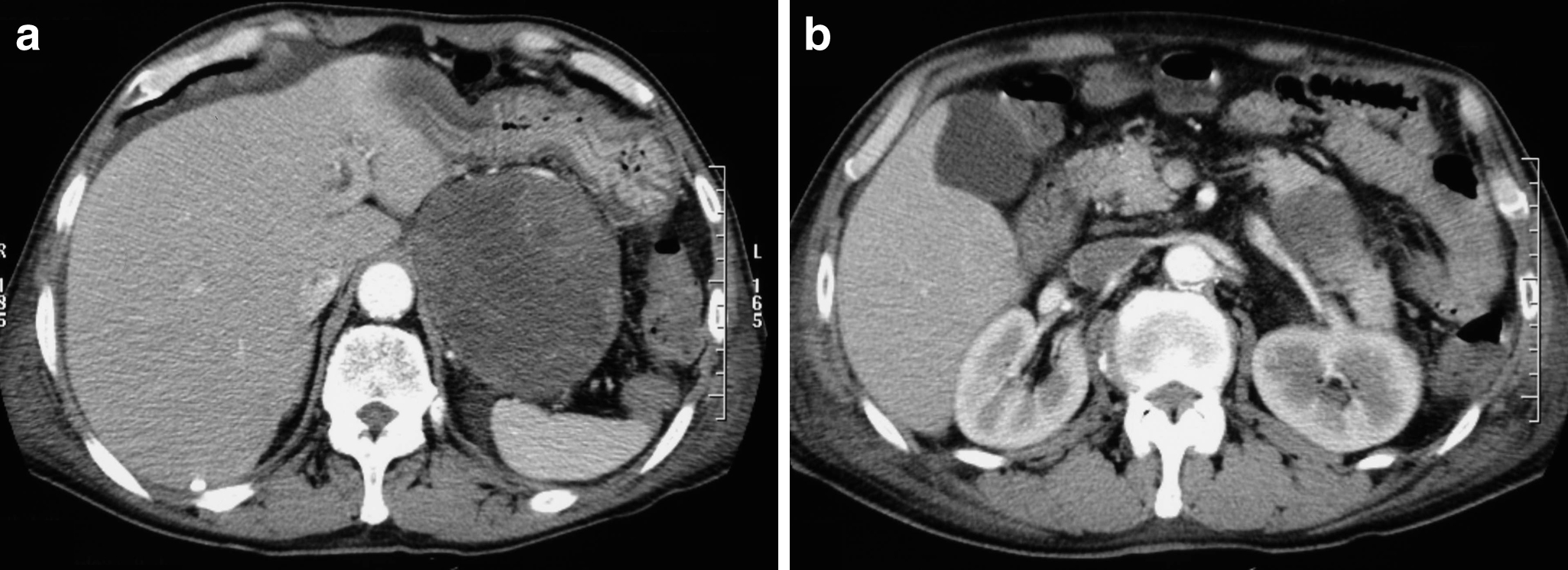
Enhanced CT shows a well-defined exophytic mass, 10 cm in diameter, located on the stomach. There was necrosis in the central area (a). The mass was widely distributed adjacent to the pancreas (b).
以上より,胃粘膜下腫瘍(GIST疑い)とそれに随伴したネフローゼ症候群と診断した.アルブミン12.5 g/日およびフロセミド20 mg/日投与を5日間行い,十分な手術説明の後に手術を施行した.
手術所見:胃上部後壁から発生し,後腹膜腔にめり込むように存在する10 cm大の腫瘍を認めた.同腫瘍は,横隔膜脚や膵臓,横行結腸に強く癒着し,剥離困難であった.このため,胃全摘術のみならず,横隔膜脚の一部,膵体尾部,脾臓,横行結腸の一部も切除した.手術時間は5時間35分,出血量は1,878 gであった.術中,赤血球濃厚液6単位,新鮮凍結血漿4単位を投与した.
病理組織学的検査所見(切除標本): 胃粘膜下層~漿膜下組織にかけて巨大な腫瘤を認めた.中心部に囊胞変性があり,漿液性の液性成分を有していた(Fig. 5).増殖していた紡錘形から類円形の腫瘍細胞は,免疫組織学的にc-kit(+),CD34(+),desmin(–),S-100(–)であり,GISTと診断した(Fig. 6).病変の大きさは,約7×5 cmであり,MIB-1 indexは数%であることから,Miettinenリスク分類ではグループ3a,Fletcher分類では中リスクと分類された.強く癒着していた横隔膜や膵体尾部,横行結腸には悪性細胞の直接浸潤を認めなかった.

The resected specimen shows solid tumor of the stomach, accompanied with cystic component in the central area.

Microscopic examination reveals that the tumor consists of spindle cells. Immunohistochemically, c-kit expressions are demonstrated (×200).
術後経過:軽度の吻合部狭窄を認めたが,1回の内視鏡的バルーン拡張で軽快し,術後30病日に退院となった.血清総蛋白およびアルブミン値は術後より増加し始め,10か月後には正常範囲となった(Fig. 7).また,随時尿を用いて「推定1日尿蛋白量」を測定し,ネフローゼ症候群の経過をみるために用いられる尿蛋白/尿中クレアチニン比の変化を検討した結果,尿蛋白/尿中クレアチニン比は術後早期より低下し始めた(Fig. 8).イマチニブによる術後療法を勧めたが拒否したため,経過観察とした.

Serum total protein and albumin gradually increases and reached reference ranges 10 months after the operation.
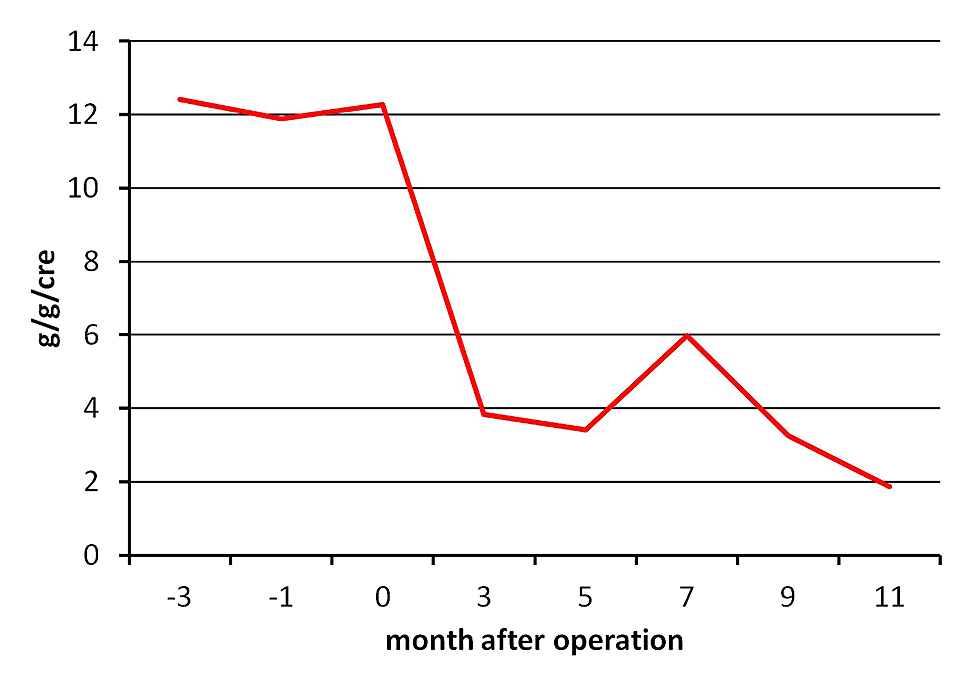
The urine protein to creatinine ratio decreases immediately after the operation. Nephrotic syndrome is evaluated as showing partial remission.
胃粘膜下腫瘍の鑑別として,GIST,リンパ腫,平滑筋細胞由来の腫瘍,神経系腫瘍,脂肪細胞由来の腫瘍,血管内皮細胞由来の腫瘍,基底細胞由来のカルチノイド,迷入膵,顆粒細胞腫などがある.このうち,GISTの一部や悪性リンパ腫,脂肪肉腫,血管肉腫では悪性度の高いものもあり,治療方針決定のためには病理組織学的検索が重要である.近年,粘膜下腫瘍に対する組織学的検査を目的として,超音波内視鏡下穿刺吸引やboring biopsyが行われている.しかし,検体採取率は80%程度であり,サンプリングエラーも考慮すると確定診断に至る症例は50%前後にとどまると推察される4).自験例では,穿刺吸引細胞診で壊死組織が採取されたのみであった.腫瘍頂部に露出血管があり,止血困難な出血が危惧されたため,再検査は行わず,確定診断に至らなかった.GIST診療ガイドラインで示されている胃粘膜下腫瘍の治療方針では,腫瘍径5.1 cm以上の粘膜下腫瘍は絶対的手術適応とされている5).自験例では,腫瘍径は8 cmであり,手術適応であった.
1966年にLeeら1)が101人の成人ネフローゼ症候群のうち11人に悪性腫瘍を合併していることから,ネフローゼ症候群と悪性腫瘍との因果関係を示唆する報告をして以来,悪性腫瘍とネフローゼ症候群との関連について言及した報告例は多い2).本邦では,石田ら3)は,ネフローゼ症候群を合併する悪性腫瘍42例のうち,胃(11例),肺(7例),悪性リンパ腫(5例)であり,腎組織型は膜性腎症が過半数を占めていたと報告した.GISTにネフローゼ症候群を合併した報告例はほとんどなく,1950年から2012年9月までのPubMedで「GIST」,「nephrotic syndrome」をキーワードに検索した結果,Jaakkolaら6)の症例報告のみであった.膜性腎症は,糸球体基底膜の上皮側に免疫複合体の沈着が蓄積し,基底膜が肥厚するために,臨床的にネフローゼ症候群を来す.膜性腎症のうち,全身性エリテマトーデスなどの自己免疫疾患,ブシラミンなどの薬剤,肝炎ウィルスなどの感染症,悪性腫瘍に随伴した場合には,二次性膜性腎症と呼ばれている7).二次性膜性腎症は,一次性と比較すると,メサンギウムの増殖を認める場合があることや悪性腫瘍関連の場合には多核白血球浸潤を認めることが多いと指摘されている.また,IgGサブクラスに関する蛍光抗体法では,一次性膜性腎症ではIgG4が優位であるが,二次性ではIgG1,2がIgG4と同等もしくはそれ以上に陽性を示すことが多い8).自験例では,メサンギウムの軽度増殖を認めることや,IgGサブクラス解析の結果より,悪性腫瘍に随伴した膜性腎症が強く疑われた.悪性腫瘍に対する治療により,膜性腎症が寛解もしくは軽快した報告例が散見されるが,このような症例ではIgGの沈着が減少するとされている2)9)~11).
悪性腫瘍を随伴するネフローゼ症候群は,腫瘍特異抗原やCEAなどの胎児性抗原が,それに伴う抗体と免疫複合体を形成し,腎糸球体基底膜に沈着することによって発生するIII型アレルギーの一つと推測されている12)13).外科的切除などの腫瘍治療によってネフローゼ症候群が寛解したり,また腫瘍の再燃や転移に伴ってネフローゼ症候群が再発したりする場合には,悪性腫瘍とネフローゼ症候群の関連性が疑われる14)15).上皮下沈着物中に腫瘍関連抗原とその抗体による免疫複合体が同定できれば,関連性は強く疑われる.さらに,ネフローゼ寛解後の腎生検において,免疫複合体の減少を証明できれば,悪性腫瘍とネフローゼ症候群の関連性は確実なものとなる.しかし,報告例を検索するかぎり,1970年代~1980年代の報告例以降は原因抗原に関する新たな報告例がなく,因果関係を立証することは困難と推察される12).自験例では,腫瘍関連抗原の同定を目的としてc-kitやCD34を用いて腎生検標本に免疫染色検査を施したが陰性であり,関連性の確定には至らなかった.悪性腫瘍に対する治療が奏効した場合,上皮下沈着物が基底膜内で分解されるまでには2~3か月かかるため,尿蛋白が減少するには6~18か月を要し,陰性化するには数か月~数年を要するとの報告が多い2)10)16)17).自験例では,手術によってネフローゼ症候群が改善し,術後10か月に血清総蛋白およびアルブミン値が正常範囲内となったことから,胃GISTとネフローゼ症候群には関連性があると考えられた.
切除可能GIST治療の第一選択は外科的完全切除であり,偽被膜を損傷することなく外科的に安全なマージンを確保することが原則である5).また,予防的あるいは系統的リンパ節郭清は不要とされている5).自験例では,CTや内視鏡所見よりGISTが強く疑われていたため,これらの原則に従って手術を行った.切除標本の迅速診断では,腫瘍は紡錘形の細胞から構成され,GISTが最も疑われたため,胃癌治療ガイドラインにおける系統的リンパ節郭清は省略した.切除標本の病理組織学的検討では,膵体尾部や横行結腸に悪性細胞の浸潤を認めなかったことから,合併切除は過大侵襲であった可能性がある.しかし,胃腫瘍と膵体尾部,横行結腸が強く癒着して浸潤が疑われたことから,偽被膜損傷とこれに伴う腫瘍細胞の腹腔内散布や流出を防ぐためには,胃と膵体尾部,横行結腸の一括切除もやむをえないと考えられた.
ネフローゼ症候群を有する悪性腫瘍に対して根治手術を行うことにより,悪性腫瘍とネフローゼ症候群の両方とも治癒しえる可能性があることから,積極的な外科治療が必要と考えられる.術前の低栄養状態は,縫合不全や肺炎などの術後合併症に大きく関係することが知られ,術前術後の栄養管理が重要視されている.Buzbyら18)は,消化管手術を受ける患者に関して,予後と深い関係がある検査項目を組み合わせて予後栄養指数(prognostic nutritional index;以下,PNIと略記)を考案した.本邦でも,小野寺ら19)によってStage IV消化器癌およびStage V大腸癌患者に対するPNIが提唱され,消化器癌手術における切除・吻合の可否を判定する有用な指標として報告し,消化器癌手術における有用な栄養指数として汎用されている20).ほとんど全ての栄養評価指数に血清アルブミン値が含まれていることから,ネフローゼ症候群を有する症例の場合は,中等度~高度栄養障害もしくは手術中~高リスク群となる.ネフローゼ症候群を有する悪性腫瘍に対して手術を行い,良好な術後経過をたどる報告例が少なくないことから,手術の危険度を正確に評価しえないと考えられる.
縫合不全や感染症などの術後合併症を回避するためには,血清アルブミン値が低い症例では,新鮮凍結血漿やアルブミンを投与して正常下限以上に改善しておくことが推奨されている21)22).井出ら9)は,ネフローゼ症候群を合併した胃癌症例に対するアルブミン製剤や新鮮凍結血漿投与について詳細に検討し,適切な血液製剤投与を行った後,早期に胃切除を行うことによって合併症なく良好な経過が得られると報告した.しかし,2009年2月に改訂された厚生労働省医薬食品局血液対策課の「血液製剤の使用指針」では,アルブミン製剤や新鮮凍結血漿の投与は量や投与期間に関して制限される方向にある23).このため,満足のいく総蛋白濃度やアルブミン濃度で手術を行うことが難しくなっている.井出ら9)の報告では,25%アルブミン製剤100 ml/日,新鮮凍結血漿5単位/日を術前7~10日投与し,低蛋白・低アルブミン血症を是正した後に手術を行った報告例は全例とも合併症を認めなかった.自験例では,術前に25%アルブミン製剤50 mlを5日間投与したが,1日尿蛋白量が11.10 gであることから,総蛋白濃度やアルブミン濃度の上昇を得られなかった.術前投与量や期間を考えると,不十分な投与量であった可能性がある.術後は新鮮凍結血漿2単位を7日間投与したが,総蛋白濃度 4.2 g/dl,アルブミン濃度 1.0 g/dlと満足のいく上昇は認めなかった.術後14病日に軽度の吻合部狭窄を認めたが,1回の内視鏡的バルーン拡張で改善し,以降は合併症なく,良好な経過をたどった.
自験例における術後血清総蛋白およびアルブミンの上昇や,尿蛋白/尿中クレアチニン比の低下を継時的に勘案すると,尿蛋白量が多く,手術侵襲によって蛋白異化が亢進する急性期のみ血液製剤を補給するだけで,良好な経過をたどる可能性が考えられた.
本論文の要旨は第67回日本消化器外科学会総会(2012年7月,富山)において報告した.
なお,稿を終えるにあたり,病理組織学的ご指導を賜りました当院検査科・杉田暁大先生と山内美佐先生に深謝いたします.
利益相反:なし