2013 年 46 巻 9 号 p. 692-699
2013 年 46 巻 9 号 p. 692-699
S状結腸間膜平滑筋肉腫の繰り返す再発に対して計5回の手術とifosfamide/adriamycin(以下,IAと略記)療法により良好な成績が得られたので報告する.症例は57歳の女性で,主訴は腹部腫瘤であった.腹部CTにてS状結腸間膜に60 mm大の腫瘤を認め,FDG-PETでは腫瘍にSUV max 4.1の集積を認めた.S状結腸間膜腫瘍の診断にて摘出術を施行した.病理組織学的に紡錘形で核異型の強い腫瘍細胞よりなり,α-smooth muscle actin(SMA)陽性,KITおよびCD34,S-100陰性で,平滑筋肉腫と診断された.初回手術後9,13,17か月目に再発する腹膜転移に対し摘出術を行った.初回手術後19か月目の腹部CTにて横行結腸間膜に再発巣が指摘された.IA療法を4コース行ったところ,腫瘍径が64 mmから25 mmに縮小し,5回目の摘出術を行った.初回手術より36か月,最終手術より12か月経過した現在再発所見なく生存中である.
結腸間膜腫瘍は比較的まれな疾患で,その中には悪性腫瘍として平滑筋肉腫やgastrointestinal stromal tumor(以下,GISTと略記)などの間葉系腫瘍が含まれる.このため平滑筋肉腫の組織学的診断には腫瘍細胞のα-smooth muscle actin(以下,SMAと略記)の発現のみならず,KITあるいはCD34の発現の検討が必要である1).一方,平滑筋肉腫に対する治療の基本は外科的切除であるが,その治療成績は必ずしも良好とはいえない.今回,繰り返す腹膜再発に対して計5回の手術とifosfamide(以下,IFOと略記)およびadriamycin(以下,ADMと略記)を用いたifosfamide/adriamycin(以下,IAと略記)療法により長期生存中のS状結腸間膜平滑筋肉腫の1例を経験したので報告する.
患者:57歳,女性
主訴:腹部腫瘤
既往歴:高血圧症
現病歴:高血圧症治療のため近医通院中に腹部腫瘤を指摘され,精査および加療目的に紹介された.
入院時現症:表在リンパ節を触知せず,胸部に異常所見を認めなかった.左下腹部に約10 cm大の可動性不良で弾性硬な腫瘤を触知した.
腹部造影CT所見:初回CTでは,S状結腸間膜に60×43×52 mmの不均一に造影される境界明瞭な腫瘤を認めた(Fig. 1).

CT. Preoperative findings. A tumor (60 mm) with clear circumference is observed in the mesosigmoid, and is heterogeneously contrasted.
FDG-PET所見:腫瘍に一致してSUV max 4.1の集積を認めた.その他に転移を疑わせる病変は認めなかった.
大腸内視鏡検査所見:S状結腸を含め腫瘍性病変を認めなかった.
以上より,S状結腸間膜に由来する間葉系腫瘍を疑い手術を施行した.
初回手術所見:腫瘍はS状結腸間膜内に存在し,明らかな腸管,その他の臓器への浸潤および腹膜転移は認められなかった.このためS状結腸,左結腸動脈および上直腸動脈は温存し,結腸間膜に覆われた状態で腫瘍を切除した.
病理組織学的検査所見:腫瘍の大きさは94×73×70 mmで,被膜に覆われていた.その割面は灰白色で,充実性成分,出血成分,壊死様成分が混在していた(Fig. 2).病理組織学的にHE染色では紡錘形で核異型の強い腫瘍細胞が束状に増殖していた.巨大な核や多核細胞が混在し,多形性もめだち,核分裂像も認められた(Fig. 3A).免疫染色検査ではα-SMA陽性(Fig. 3B),caldesmon陽性,calponin陽性,desmin陽性,KITおよびCD34陰性,S100陰性であった.以上の所見より,S状結腸間膜の平滑筋肉腫と診断された.Ki-67陽性率は59.5%と高値であった(Fig. 3C).

Surgically resected specimen. Tumor size is 94×73×70 mm covered with capsule. On the cut surface, the tumor shows gray in color, and necrosis and hemorrhage.

Histopathological findings. A: HE staining (HE, ×200). Tumor cells are fusiform-shaped and increased as the bundles with nuclear atypicality. Huge nuclei and polykaryocyte are mixed and polymorphia was observed with frequent mitosis. B: α-SMA immunostaining (α-SMA, ×200). The tumor cells diffusely show a positive reaction to α-SMA. C: Ki-67 immunostaining (Ki-67, ×200). The nucleus of the tumor cells frequently shows a positive reaction to Ki-67 antigen. The positive rate was 59.5%.
初回手術後の経過:初回手術後9か月目に右腎下極から尾側に向かって径110 mmの再発腫瘤を認め,S状結腸間膜平滑筋肉腫の腹膜転移の診断で摘出術を施行した.初回手術後13か月目に右傍結腸溝に径50 mmの再発を認め,摘出術を行った.さらに,17か月目に膀胱右側に径50 mmの腹膜再発を認め,摘出術を行った.この3回の手術時に肉眼的にS状結腸間膜切除部の局所再発や腹膜播種の所見は認められなかった.そして初回手術後19か月目に4回目の腹膜再発を認めた.転移巣は横行結腸間膜に存在し,腫瘍径は64 mmであった(Fig. 4A).再発期間が短く,外科的にコントロール不良と考えられたことと,手術に対する患者の精神的負担が増大していたことから,患者および家族と相談し,消化器外科領域での効果はいまだ定まったものではないが,整形外科領域で平滑筋肉腫を含む軟部肉腫に対して評価のあるIA療法を選択することとし,4コース施行した(Fig. 5).IA療法はIFO 1.5 g/m2をday 1~5に,ADM 20 mg/m2をday 1~3に投与した.1サイクルは5日間,休薬期間は28日とした.IA療法2コース終了後のCTでは腫瘍径43 mmと縮小し,4コース終了後には25 mmに縮小し(縮小率60.9%),化学療法の効果はpartial responseと判断された(Fig. 4B).4コース終了後には白血球 510/μl,好中球200/μlとgrade 4の有害事象を認めたが,granulocyte-colony stimulating factor(以下,G-CSFと略記)の使用にて回復した.有害事象として,骨髄抑制以外にはgrade 1の悪心・嘔気が認められたのみであった.初回手術から24か月目,IA療法開始後5か月目に5回目(再発4回目)の摘出術を行った.
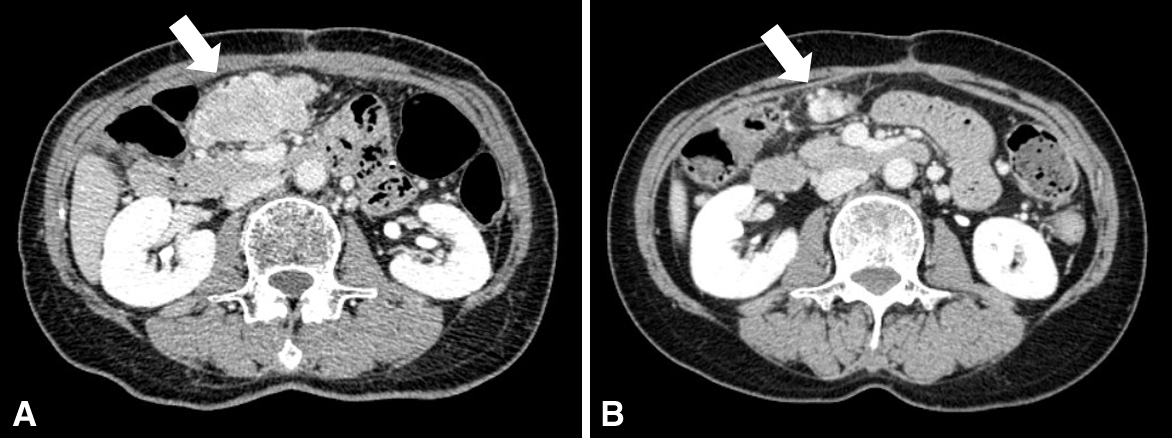
CT (4th recurrence). A: Nineteen months after first surgery, a metastatic tumor (64 mm: arrow) is observed at the transverse colon. B: Tumor diameter is 25 mm (arrow) after the 4th course of chemotherapy (reduction rate 60.9%). The chemotherapeutic effect is partial response.
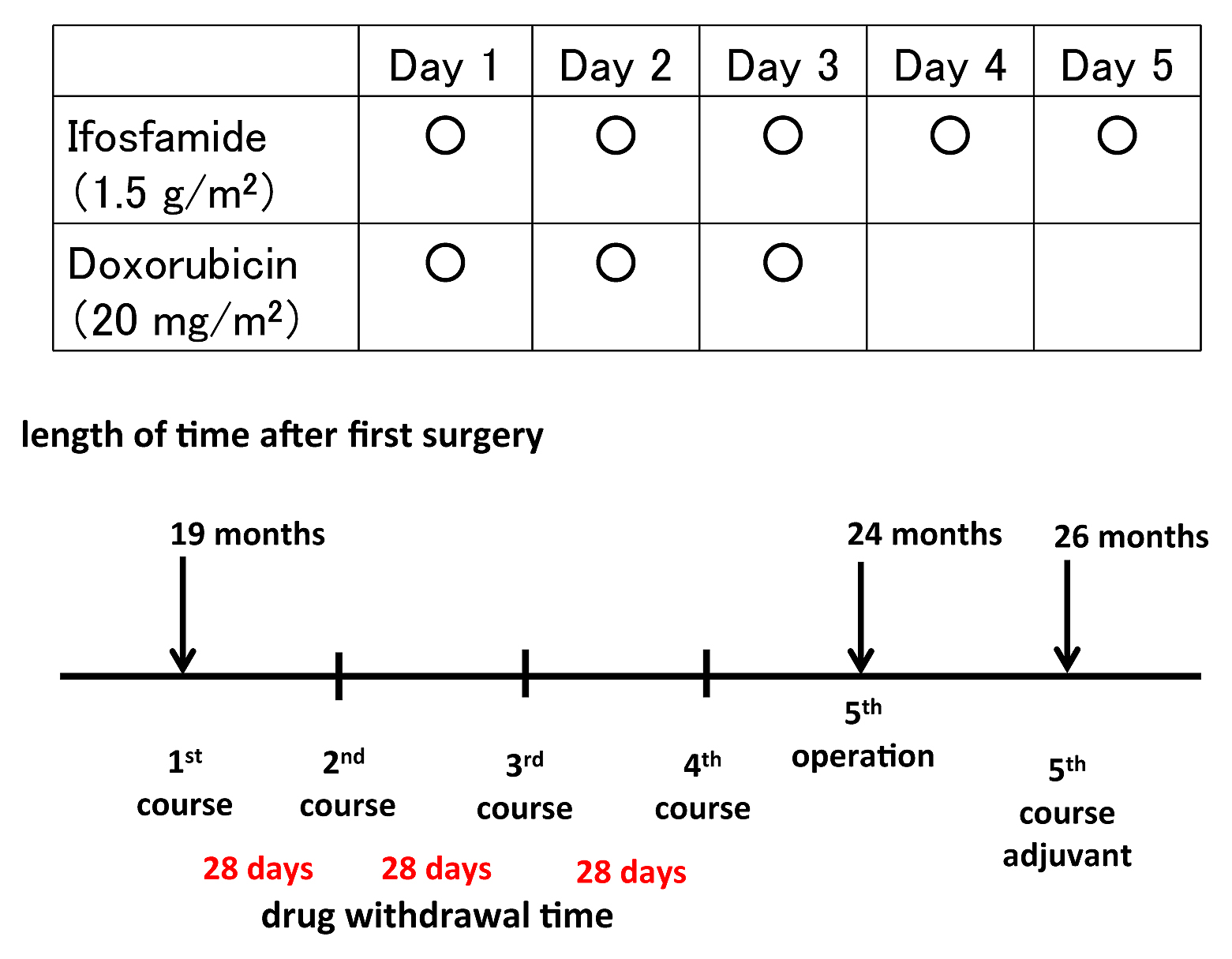
Regimen of chemotherapy using ifosfamide and adriamysin.
病理組織学的検査所見:腫瘍の大きさは32×21×18 mmで,被膜に覆われていた.HE染色では,初回手術時の組織所見と比較して,5回目手術時の組織所見において細胞構造の消失とエオシン好性成分の増加を認め,化学療法に伴う壊死の所見として矛盾しなかった(Fig. 6).また,5回目手術時の切除標本におけるKi-67陽性率は36.0%であった.

Histopathological findings after the 5th operation. HE staining (HE, ×200). Compared to the histological specimens of the 1st operation, the specimen of the 5th operation shows decay of cell structure and increased eosinophilic component.
手術後の経過:術後経過は良好で,術後2か月目にIA療法を1コース追加した.術前の化学療法で白血球減少を認めていたため,投与薬剤量を初回の80%としたところ,有害事象は認められなかった.5回目の手術後12か月,初回手術後36か月を超えて再発所見なく生存中である.
本邦における結腸間膜の平滑筋肉腫の報告例を集計した.医学中央雑誌を用いて1983年以降に「結腸間膜」および「平滑筋肉腫」をキーワードとして2012年10月までで検索した(会議録を除く).また,PubMedを用いて「mesentery」,「colon」,「leiomyosarcoma」をキーワードに1950年以降2012年10月までで検索した.平滑筋肉腫とGISTを鑑別する必要があるため,α-SMAなどの筋系マーカー,KITあるいはCD34,S100の発現を病理組織学的な検討にて診断されたものを基本とした.そしてα-SMAあるいはその他の筋系のマーカーが陽性となり,かつGISTの検索が行われた記述のある報告例のみを対象とした.このような病理組織学的診断のもとに報告された7例1)~7)の結腸間膜の平滑筋肉腫症例を用いて考察を行った(Table 1).本例を含めた8例の結腸間膜平滑筋肉腫の臨床病理学的な特徴は,平均年齢は54歳,男女比は女性8例と女性のみであった.原発部位に関しては上行結腸間膜が1例,下行結腸間膜が1例,S状結腸間膜が6例であり,S状結腸間膜由来が多く認められた.平均腫瘍径は122.4 mmであった.
| Author/Reference No. | Year | Age/Sex | Site | Size (mm) | Muscle marker | S100 | KIT | CD34 | Ki-67 index (%) | Mitosis | Chemotherapy | Recurrent pattern | Outcome (months) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yoshida2) | 2003 | 51/F | S | 180 | SMA (+) | (–) | (–) | ? | ? | ? | (–) | (–) | alive (16) |
| Okada3) | 2004 | 50/F | S | 140 | SMA (+), desmin (+) | ? | (–) | (–) | ? (positive) | <10/HPF | (–) | (–) | alive (5) |
| Fukunaga4) | 2004 | 62/F | S | 140 | SMA (+), desmin (+) | (–) | (–) | (–) | ? | 15/10HPF | (–) | liver | died (10) |
| Ito5) | 2007 | 61/F | A | 65 | SMA (+), desmin (+) | (–) | (–) | (–) | ? | ? | (–) | (–) | alive (19) |
| Saito1) | 2007 | 57/F | S | 150 | SMA (+) | (–) | (–) | (–) | 56 | >20/HPF | (–) | peritoneum | died (3.5) |
| Yamashita6) | 2010 | 39/F | D | 90 | SMA (+) | (–) | (–) | (–) | ? | 10/10HPF | (–) | (–) | alive (12) |
| Kato7) | 2012 | 53/F | S | 120 | SMA (+), desmin (+) | (–) | (–) | (–) | ? | ? | ? | ? | ? |
| Our case | 57/F | S | 94 | SMA (+), desmin (+) | (–) | (–) | (–) | 59.5 | 17/HPF | IA | peritoneum | alive (36) |
A, ascending colon; T, transverse colon; D, discending colon; S, sigmoid colon; SMA, smooth muscle actin; HPF, high power field
本例では初回手術後9か月,2回目手術後4か月,3回目手術後3か月,4回目手術後2か月と短期間のうちに腹膜再発を認め,その間隔は短くなっていった.臨床経過の中で再発に対する危機感によりCTを行う間隔が短くなり,結果的に再発の発見期間が短くなっていったと考えられた.手術時には腹腔内の観察を行っているが,他部位に転移はいずれも認められておらず,原発巣をはじめ,それぞれの転移巣は著しい増殖能を有していると考えられた.腫瘍の増殖能を反映する因子としてKi-67陽性率がしばしば用いられる.本例の平滑筋肉腫ではKi-67陽性率が50%を超えていた.これまで1例のみにKi-67陽性率が報告1)されているが,50%以上の高いKi-67陽性率を示し術後3.5か月で再発死亡している.症例数が少ないために十分な検討ができないが,結腸間膜平滑筋肉腫においてもKi-67陽性率が高いものは治療成績が不良である可能性がある.
本例では初回手術時のS状結腸間膜周辺には局所再発は認められず,初回手術時に原発巣の切除は十分であったと考えられた.本例の再発はそれぞれの腹膜再発が短期間とはいえ,異時性腹膜再発である.可能性としては初回手術時より細胞レベルで存在した腹膜播種巣が異時性に出現したのか,あるいは腫瘍が大きかったため手術操作によって播種性転移を引き起こしたのか,二つの要因が考えられるが,どちらによるものかは不明である.なお,Table 1に再発形式を記載した.再発が明記されているものは本例を含め3例のみであり,内訳は腹膜2例,肝臓1例で,播種性転移のみならず遠隔転移も認められた.
結腸間膜平滑筋肉腫の初回治療としては報告例全例において外科的切除が行われている.しかし,初回手術後3年以上の長期経過観察後の報告例は本例のみである.8例中2例1)4)が再発死亡と報告されているが,結腸間膜平滑筋肉腫の外科切除後の治療成績を明らかにすることは困難であった.再発転移が認められ,その進展に伴い腫瘍死する症例が認められた1).本例では繰り返し再発巣の切除を行ったが,4回目の再発時に外科的切除の限界を認識して化学療法を導入した.結果的に化学療法が奏効したため,より早期に化学療法の導入を検討する余地があったと考えられた.
平滑筋肉腫の転移および再発に対する満足できる有効な化学療法は標準化されていない.平滑筋肉腫を含む非円形細胞型(紡錘型)軟部肉腫に対する化学療法は整形外科領域においてよく検討されている.Gottliebら8)によってcyclophosphamide,vincristine,ADM,dacarbazineを用いたCYVADIC療法によって56%の奏効率が報告された.しかし,その後の追試によって期待された効果が得られなかった9).現在,これらの軟部肉腫に対する化学療法のkey drugはIFOとADMと考えられている.IFO単剤10)11)およびADM単剤11)での奏効率はそれぞれ25%前後,そしてIA併用療法では25%を超える奏効率が示されている12)13).IFOとADMともに用量依存性抗癌剤であり,高用量投与により奏効率の増加が期待されるが,単剤療法および併用療法における全生存期間OSの延長は認められていない12).このため本例ではIFOおよびADM通常量によるIA療法を施行し,4コース施行後にPRの結果を得た.しかし,有害事象として骨髄抑制が出現したため,更なる化学療法の追加は手術を含めた今後の治療に支障を来すと判断して5回目(再発4回目)の切除を行った.術後の病理組織学的検討においても化学療法の効果は認められ,Ki-67陽性率も低下していた.今回調査を行った結腸間膜平滑筋肉腫の症例において,化学療法が施行されていたのは本例のみであった.本例におけるIA療法では,腫瘍の縮小効果のみならず細胞レベルの播種性転移も制御できた可能性が推測される.平滑筋肉腫を含む進行再発非円形細胞型軟部肉腫に対するIA療法の生存期間中央値は12~13か月,5年生存率は10%といまだ不良であり12),本例でも今後慎重な経過観察が必要と考えている.消化器外科領域でのIA療法の検討は少なく,IFOとADMを用いた化学療法の症例としてTanedaら14)の報告による大網原発の平滑筋肉腫症例が認められる.今後の症例の蓄積に期待したい.
IA療法に関する有害事象では,骨髄抑制や心毒性,悪心・嘔吐,口内炎,脱毛が報告されている.本例ではgrade 4の白血球減少症を認めたが,G-CSFを使用することで対応は可能であった.その他の有害事象としては軽度の悪心・嘔気を認めるのみであった.IA療法を含めた多剤併用療法で問題となるのは骨髄抑制を主とした有害事象である.ADMおよびIFOは用量依存性薬剤であり,効果を得るには十分な薬剤投与量が必要とされるが,従来は有害事象を減らす目的で薬剤投与量を減量してIA療法が行われることが多かった.しかし,G-CSFを併用し,厳重な管理と投与スケジュールを工夫することにより十分な量の薬剤を投与することが可能である15).
利益相反:なし