2014 年 47 巻 12 号 p. 826-831
2014 年 47 巻 12 号 p. 826-831
遺伝性血管浮腫(hereditary angioedema;以下,HAEと略記)は,局所的な浮腫によって腹痛や呼吸困難などを起こす疾患で,気管内挿管が必要な全身麻酔における周術期管理において厳重な注意が必要とされている.今回,我々はHAEに併存した直腸カルチノイドの手術例を経験し,独自な周術期管理によって安全に低位前方切除術を施行したので報告する.症例は60歳の男性で,血便を主訴に当院を受診した.下部消化管内視鏡検査で直径20 mm大の直腸カルチノイドを認め,手術適応と判断した.原因不明の腹痛での入院歴およびHAEの家族歴があり,血清補体価,補体第一成分阻害因子(C1 inhibitor;以下,C1-INHと略記)活性低値よりHAEと確定診断した.術前にダナゾール,トラネキサム酸,C1-INH製剤を投与した後,硬膜外併用脊椎麻酔下に低位前方切除術を施行し,術後は浮腫発作なく良好に経過した.
遺伝性血管浮腫(hereditary angioedema;以下,HAEと略記)は比較的まれな疾患で,局所的な浮腫を起こし,腹痛や呼吸困難などを起こすといわれている1).今回,我々はHAEに併存した直腸カルチノイドの手術例を経験し,独自な周術期管理によって安全に低位前方切除術を施行したので報告する.
患者:60歳,男性
主訴:血便
家族歴:長女,次女,長男がHAEの診断で内服治療中,姉は53歳時の突然死
既往歴:10歳時急性虫垂炎手術.20~30歳代に原因不明の腹痛にて4度入院.30歳代より月に2回程度誘因なく発症し自然退縮する顔面浮腫を自覚していた.
現病歴:2010年1月,血便のため近医を受診し当院を紹介された.下部消化管内視鏡検査で直腸カルチノイドと診断され,直径20 mm大で手術適応と判断し,同年3月に加療目的で入院した.
入院時現症:身長168 cm,体重68 kg,体温36.5°C,血圧130/64 mmHg,脈拍90回/分 整,腹部は平坦,軟で,表在リンパ節を触知しなかった.
入院時検査所見:C4 4.5 mg/dl,CH50 <12 U/ml,補体第一成分阻害因子(C1 inhibitor;以下,C1-INHと略記)<25%と血清補体価の低値を認めた.血算および生化学検査,腫瘍マーカー値に異常所見を認めなかった(Table 1).
| Hematology | Biochemistry | ||
| WBC | 7,700/μl | TP | 7.4 g/dl |
| Hb | 13.9 g/dl | Alb | 4.3 g/dl |
| Hct | 40.7% | AST | 25 IU/l |
| Plt | 41.4/μl | ALT | 25 IU/l |
| Serology | T-Bil | 0.6 mg/dl | |
| C3 | 82.8 mg/dl | BUN | 8.8 mg/dl |
| C4 | 4.5 mg/dl | Cre | 0.63 mg/dl |
| CH50 | <12 U/ml | Na | 139 mEq/dl |
| C1-INH | <25% | K | 4.0 mEq/dl |
| Coagulation | Tumor Marker | ||
| PT | 10.3 sec | CEA | 1.8 ng/ml |
| APTT | 26.9 sec |
下部消化管内視鏡検査所見:下部直腸後壁に中心にdelleを伴う約20 mm大の粘膜下腫瘍様の隆起性病変を認めた(Fig. 1).
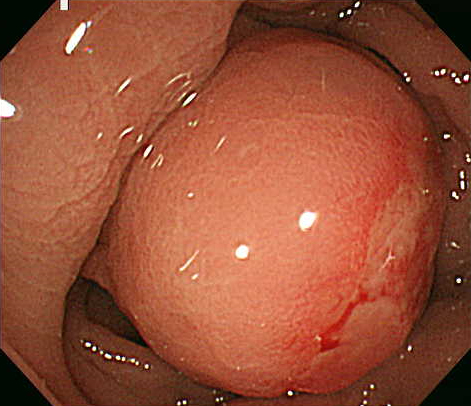
Total colonoscopy shows a rectal submucosal tumor with a central ulcer.
腹部骨盤造影CT所見:下部直腸後壁に全体がほぼ均一に造影される19 mm大の腫瘤を認めた.腫瘤は内腔に突出し,壁外への浸潤は認めなかった(Fig. 2).明らかなリンパ節転移,肝転移,腹膜播種の所見はなかった.
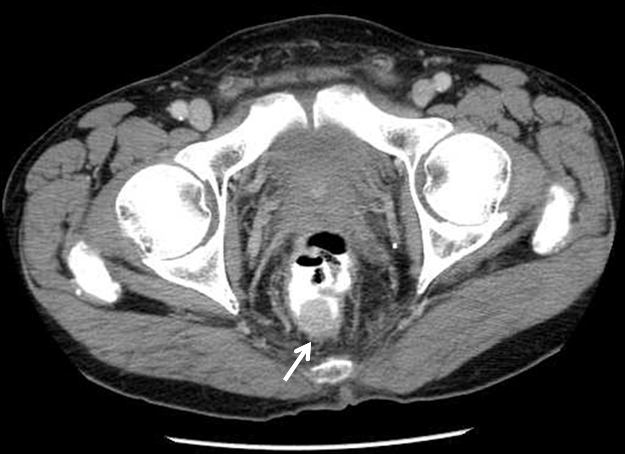
CT scan shows an enhanced 19-mm sized mass, which protrudes into the rectal lumen without periductal invasion, at the posterior wall of the lower rectum.
治療経過:浮腫発作の出現,家族歴,血清C4低値,C1-INH活性低値よりHAEと確定診断した.また,下部消化管内視鏡検査所見より直腸カルチノイドと診断した.CTでは明らかなリンパ節腫大を認めないが,大きさが10 mmを超えていること,および中心にdelleを認めることから,リンパ節転移の危険性を考慮し,リンパ節郭清を含む病変の切除の方針とした.HAEの浮腫発作の予防として,手術3日前よりトラネキサム酸1,500 mgおよびダナゾール400 mgの内服を開始し,手術2時間前にヒトC1-INH製剤1,000単位およびトラネキサム酸750 mgを投与し,硬膜外麻酔併用脊椎麻酔下に低位前方切除術およびtotal mesorectal excision(以下,TMEと略記),上方D3郭清を施行した.腸管吻合は33 mm径のサーキュラーステイプラーを用いてdouble stapling technique(以下,DSTと略記)で行った.
手術所見:肛門縁から6 cmの下部直腸後壁に可動性良好な隆起性病変を認めた.明らかなリンパ節腫大や腹膜播種,遠隔転移の所見はなかった.
摘出標本:腫瘍は大きさ18×18 mm大で,肛門側切除断端からの距離は25 mmであった.腫瘍割面では明らかな筋層浸潤はなかった(Fig. 3).

The resected specimen from the low anterior resection. The carcinoid tumor, which measured 18×18 mm in diameter, was located 25-mm from the anal excised end (a, b). The tumor does not invade the muscular coat at the dividing face of the resected specimen (c).
病理組織学的検査所見:腫瘍細胞のロゼット様構造を認め,chromogranin A陽性,synaptophysin陽性であった(Fig. 4).病理組織学的にrectal carcinoid,pSM(T1b),ly1,v0,pN1(1/32),sH0,sP0,cM0と診断した.

The pathological findings of the resected rectal carcinoid indicated a rosette-like formation (a). Tumor cells were positive for chromogranin A (b) and synaptophysin (c).
術後経過:術後にトラネキサム酸2,250 mgの投与を行った.術中術後とも浮腫発作なく良好に経過し,第11病日に退院した.現在,術後3年半経過しているが,カルチノイドの再発や転移は認めていない.浮腫発作は打撲などの身体的刺激や睡眠不足などの精神的ストレスが要因となり,1~2回/月の頻度で生じており,1か所に生じた浮腫が広範囲に広がることもあるが,トランサミンの内服によりおよそ12~48時間以内に軽快する.腹痛や呼吸困難などの入院加療を要する大きな発作は生じていない.
HAEはOsler2)によりQuincke浮腫と異なり遺伝性をもつ浮腫として認識された常染色体優性遺伝の疾患であり,発症頻度は1~15万人に1人とされる3).Donaldsonら4)によって血清中のC1-INHの欠損が原因であることが判明しており,C1が血中で無制限に活性化されることでC3a,C4a,C5aなどの補体分解産物が増加し,血管透過性が亢進する.さらに,C1-INHは凝固因子活性化を阻害する作用もあるため,凝固線溶系,カリクレイン-キニン系の活性化によりブラジキニンの産生が増加し,血管透過性が亢進するといわれている5).さまざまな刺激やストレスなどが加わると,もともと活性化されている補体系が一層活性化され,血管透過性亢進から皮膚や粘膜の浮腫を生じる.また,自律神経系および内分泌系による調節機構も血漿タンパク分解酵素の活性化に影響していると考えられている6)が,実際には明らかな誘因なく発作が生じることもあり,メカニズムは解明されていない7).
浮腫発作の短期的予防法はC1-INHの補充を目的としたヒトC1-INH製剤や新鮮凍結血漿の投与,抗プラスミン剤であるトラネキサム酸の投与,タンパク分解酵素阻害薬のメシル酸ナファモスタットなどがあり,抗ヒスタミン剤やエピネフリン,糖質ステロイドの投与は無効である.長期的予防法としては肝臓におけるC1-INHの産生増加をもたらすとされている男性ホルモン薬のダナゾールの投与8)が推奨されている.
また,カルチノイドはセロトニン産生細胞であるenterochromaffin細胞を発生源とした腫瘍と考えられており,人体のセロトニンの約90%が存在する消化管に好発する.消化管カルチノイドは直腸に多く,腫瘍径が2 cm以上になると固有筋層まで浸潤することが多く,リンパ節転移も高率となるため,癌に準じた根治術が必要であるとされる9).
今回,我々はHAEを併存した直腸カルチノイドの患者に対し開腹下低位前方切除術を行うこととしたが,浮腫の予防として周術期にトラネキサム酸,ダナゾール,ヒトC1-INH製剤を投与し,さらに気管内挿管刺激による気道粘膜浮腫を起こさないよう硬膜外麻酔併用腰椎麻酔下に施行した.C1-INHの投与なしに気管内挿管および全身麻酔管理を行い合併症なく経過したという報告10)もあるが,抗癌剤投与の刺激によって浮腫が発生し呼吸困難に陥ったという報告11)もあり,浮腫発現の要因や生じる病態の程度は予測しがたく,気道浮腫が生じた後の気管内挿管は困難なことが多いため,事前に周到な準備を行うことが必要と考える.手術時には手術侵襲,気管内挿管,術後疼痛,精神的ストレスなどが浮腫をじゃっ起する一因となりえるが,特に気管内挿管は気道の機械的刺激を伴うため,浮腫形成の強い誘因になる恐れがある12).上気道粘膜の浮腫による致死率は,適切な治療が行われない場合30~50%と極めて高く13),注意を要する.HAE患者に対する麻酔および周術期管理に関してはさまざまな報告や検討がなされているが,症例が少なくいまだ確立していない.気管内挿管は禁忌ではないが,気道への刺激が最小限となる方法が推奨されており,ラリンジアルマスクを用いた全身麻酔については,気道粘膜との接触面積がより広くなることで気道粘膜の浮腫を悪化させる可能性が指摘されており,現時点では推奨されていない14).気管内挿管および気管切開がいつでも行えるよう準備をしつつ,可能なかぎり気道への刺激が少ない麻酔方法を選択することが重要と考える.
また,本症例では低位前方切除術,TME,上方D3郭清,DST吻合といった標準的な術式および手技を行った.HAE患者における腸管吻合においては吻合部の浮腫による縫合不全が重大な合併症と考えられ,腸管切離などの手技は通常通り自動縫合器を用いて行ったが,腸管切除および吻合の際に腸管や吻合部の浮腫が生じていないことを十分確認した.手技は全身麻酔下と遜色なく行え,術後も合併症なく良好に経過した.
医学中央雑誌で「遺伝性血管浮腫」,「腸切除」をキーワードに1983年から2012年で検索したかぎり,HAE患者に腸管切除および吻合を行った報告は会議録で自験例のみであり,論文報告としては1例も認めず,本症例は本邦で初の報告例と思われる.HAE患者において消化管吻合を行う場合は縫合不全などの合併症が起こると,そのストレスにより浮腫がじゃっ起されて全身状態の悪化を招く危険性もあると思われ,慎重な対応が望ましいと考える.
利益相反:なし