2015 年 48 巻 1 号 p. 68-74
2015 年 48 巻 1 号 p. 68-74
症例は84歳の男性で,便通異常を主訴に当院を受診した.初診時の血液生化学検査の白血球数は10,900/mm3(好中球8,500/mm3)で,大腸内視鏡検査では直腸に全周性の2型腫瘍を認め,生検では未分化癌が検出された.腹部CTにて肝転移を認め,直腸未分化癌(A,N2, P0,H1)の診断でハルトマン手術を施行した.術後化学療法(cetuximab単独投与)を施行したが,肝転移巣の急激な増大,骨盤内再発を認め,術後53病日に多発性脳梗塞(Trousseau症候群)を併発し,術後58病日目に死亡した.切除標本の病理組織学的検査所見は未分化癌で,免疫染色検査ではgranulocyte-colony stimulating factor(以下,G-CSFと略記)が陽性だった.血清G-CSF値高値と併せてG-CSF産生腫瘍と診断した.G-CSF産生大腸癌はまれであり文献的考察を加えて報告する.
Granulocyte-colony stimulating factor(以下,G-CSFと略記)産生腫瘍はAsanoら1)が1977年にはじめて報告しており,その後,肺癌を中心にさまざまな臓器由来の腫瘍で報告がされているが2),大腸癌での報告はまれである.今回,急速に進行し,術後58病日に死亡したG-CSF産生直腸未分化癌の1例を報告する.
症例:84歳,男性
主訴:血便,便通異常
既往歴:肺結核(20歳代),前立腺肥大
家族歴:特記事項なし.
現病歴:受診5か月前より便に血液が混じるようになり,4か月前より便が細くなったことを自覚した.1か月前からは腹痛を伴う頻便となり近医を受診したところ,肝臓に腫瘤性病変も指摘され当院を2013年4月に紹介受診した.
入院時現症:身長162 cm,体重57.5 kg.腹部は平坦軟.表在リンパ節は触知しなかった.
初診時臨床検査所見:白血球10,900/mm3(好中球8,500/mm3)と増多.CRP 0.6 mg/dlと炎症反応の軽度上昇を認めた.腫瘍マーカーのCA19-9とCA125がそれぞれ56 U/ml,37.7 U/mlと軽度上昇していたが,CEA は4.1 ng/mlと正常値だった.その他の血液生化学検査で特段の異常はなかった.
大腸内視鏡検査所見:肛門縁12 cmから17 cmにかけた上部直腸(rectum above the peritoneal reflection;以下,Raと略記)に全周性2型腫瘍を認めた(Fig. 1a).内視鏡の通過は可能で,その口側に病変を認めなかった.腫瘍部の生検で未分化癌が検出された.
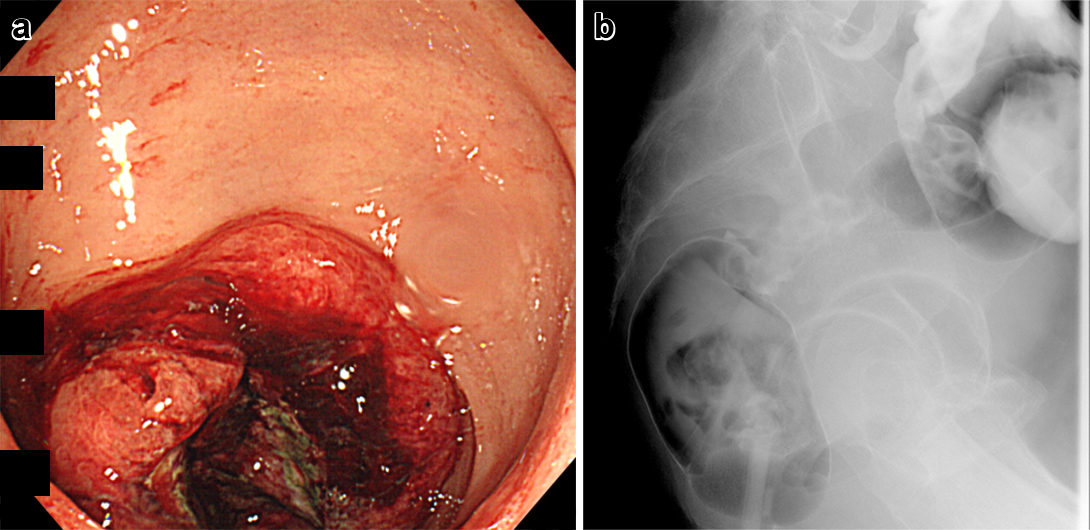
a: Endoscopic examination reveals a type 2 tumor in the rectum. b: Barium enema reveals an ulcerative tumor in the rectum.
注腸造影検査所見:Raに6 cmにわたり不整形狭窄像を認めた(Fig. 1b).
腹部CT所見:壁が不整に肥厚した直腸と,その近傍の直腸間膜内に数個の腫大リンパ節を認めた(cN2)(Fig. 2a).また,肝左葉内側区に3 cmの孤発性転移巣を認めた(cH1)(Fig. 2b).

Enhanced abdominal CT scan shows thickening of the rectal wall (a) and metastatic liver tumor (b).
手術所見:臨床病期Stage IV(A,N2,P0,H1)と診断し,初診日より41日目にハルトマン手術(D3郭清)を施行した.腹膜播種や側方リンパ節の腫大は認めなかった.
病理組織学的検査所見:腫瘍は70×85 mm,環周率100%の2型(Fig. 3a).HE染色で多形性細胞からなる腫瘍を認めた.腫瘍細胞はびまん性に増殖しており,ほとんど腺管構造が形成されていなかった(Fig. 3b).上皮系マーカーのAE1/AE3とCAM5.2,間葉系マーカーのvimentinがともに陽性であったこともあわせて直腸原発の未分化癌と診断した.腫瘍は漿膜下まで浸潤しており(pT3),高度のリンパ管侵襲と静脈侵襲を示した(ly3,v2).切除リンパ節15個中13個に転移を認めた(pN2).K-ras遺伝子は野生型であった.また,腫瘍組織内の好中球が増加していたためG-CSF抗体を用いた免疫組織化学染色を行ったところ陽性であり(Fig. 3c),血液検査の好中球数増多と術後採血でG-CSFが61.0 pg/mlと高値(基準値39.0 pg/ml以下)を示したことよりG-CSF産生腫瘍と診断した.

a: Macroscopic findings of the resected specimen. An ulcerative hard tumor is located in the rectum. b: Microscopic view of the tumor (H&E ×200). The accumulation of numerous neutrophils is noted in the area surrounding the tumor cells. c: Immunohistochemistrical staining with G-CSF antibody of the resected specimen (×200). The cytoplasmic staining of cancer cells was observed.
術後経過:経過良好で術後25日目に退院した.術後40日目のCTで肝左葉内側区の転移巣は7 cmに増大しており,他区域にも転移巣を認めた.術後40病日と47病日に化学療法(cetuximab単独投与380 mg/body)を施行したが,術後50日目に血尿で受診し,尿細胞診から未分化癌を検出した.同日のCTで内側区の転移巣は15 cmに増大し,骨盤内局所再発と側方リンパ節腫大を認めた.術後53日目に右半身不全麻痺を発症した.頭部CTで多発脳梗塞と診断した(Trousseau症候群:Fig. 4).術後58病日目に永眠され,病理解剖は施行しなかった.
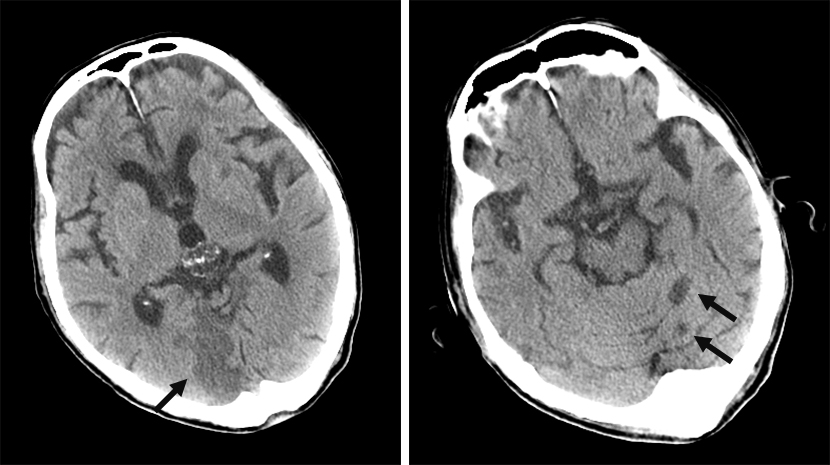
Brain CT scan shows multiple cerebral infarctions in the cerebrum and cerebellum (arrows).
G-CSF産生腫瘍は,Asanoら1)により1977年に肺癌症例で初めて報告された.その診断基準は,①著明な白血球の増加,②血清G-CSF活性値の上昇,③腫瘍切除による白血球の減少,④腫瘍組織内におけるG-CSFの証明とされる1).自験例は肝転移巣の切除が行われておらず①②④よりG-CSF産生直腸未分化癌と診断した.肺癌を中心に各臓器での報告があるが2),大腸癌での報告は非常にまれである.医学中央雑誌で1983年~2013年12月までを検索期間とし「大腸癌」,「結腸癌」,「直腸癌」,「G-CSF」のキーワード,さらに,1950年~2013年12月までのPubMedで「rectal cancer」,「colon cancer」,「colorectal cancer」,「G-CSF」のキーワードで検索すると会議録3編を含め10例が抽出された(Table 1)3)~12).自験例を含めた11例で検討すると,平均年齢63.5歳(44~84歳),性別は男性が8例と多い.原発巣の占居部位は,盲腸1例,上行結腸6例,直腸4例だった.主訴は腫瘍による腹部症状で特異的なものではないが,白血球数増加が特徴的であり,感染が否定的な場合はこの疾患を念頭におく必要がある.11例中10例に手術が行われたが,発見時に遠隔転移を伴っているものが8例と多く,根治術の可能例は3例であった.報告時1例以外は全例死亡しており,死亡例の手術から死亡までの平均日数は120日程と予後は極めて不良である.病理組織学的検査所見では低分化・未分化癌が9例と多く,全例が免疫染色検査と血液生化学検査結果よりG-CSF産生腫瘍と診断されている.
| No. | Author/Year | Complaints | Age/ Sex |
Location | WBC (/mm3) | TNM/Distant metastasis | Surgical procedure/Radicality | G-CSF (pg/ml) (normal) | Histology/Immunostaining | Chemotherapy | Cerebral infarction | Prognosis |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Ogasawara3)/2001 | right haypogastric pain | 73/F | C | 18,400 | T4N3M1/spleen, paraaortic LN | right hemicolectomy/R2 | 430 (<18) |
por/negative | none | (–) | 33D dead |
| 2 | Amaya4)/2003 | abdominal disconfort | 47/M | A | 26,000 | TxN+M+/liver | right hemicolectomy/R2 | 195 (<18) |
por/positive | regimen not discribed | (–) | 3M dead |
| 3 | Sida5)/2008 | abnormality of bowel movement | 63/M | R | 18,130 | T3N1M0/none | abdominoperinial resection/R0 | 115 (<18) |
undiff/positive | none | (–) | 26D dead |
| 4 | Takahashi6)/2008 | haypogastric pain | 57/M | R | 8,000 | TxN+M1/liver | low anterio resection/R2 | 840 (<18) |
undiff/positive | mFOLFOX6 | (–) | 2M dead |
| 5 | Matsuda7)/2009 | right haypogastric pain | 52/M | A | 16,900 | T4N2M1/liver, peritneum | right hemicolectomy/R2 | 640 (<18) |
undiff/positive | FOLFOX | (–) | 24 dead |
| 6 | Ueyama8)/2010 | right haypogastric pain | 53/F | A | 13,100 | TxNxM1/peritneum | none | 426 NA |
adeno (cytology)/positive | FOLFOX | (–) | NS |
| 7 | Kawaida9)/2010 | haypogastric pain | 81/F | A | 14,000 | T4N3M1/lung, paraaoltic LN, peritoneum | right hemicolectomy/R2 | 124 (<39) |
por/positive | FOLFOX4 | (–) | 8M dead |
| 8 | Shibahara10)/2011 | frecency of bowel movement | 63/M | R | 13,400 | T4N3M0/none | Hartmann/R0 | 110 (<18) |
por/positive | 5-FU/LV→FOLFIRI→mFOLFOX6 | (–) | 13M dead |
| 9 | Fujiwara11)/2011 | right haypogastric pain | 81/M | A | 17,000 | T3N2M0/none | ileocaecal resection/R0 | 334 (8.0~35) |
por/positive | none | (–) | 24M alive |
| 10 | Sumiyoshi12)/2012 | right hypochondrium pain | 44/M | A | 17,220 | TxNXM1/liver | right hemicolectomy/R2 | 24 (<18) |
wel-mod/positive | Bevacizumab-mFOLFOX6 | (+) | 4.5M dead |
| 11 | Our case | abnormality of bowel movement | 84/M | R | 10,900 | T3N2M1/liver | Hartmann/R2 | 61 (≤39.0) |
undiff/positive | Cetuximab | (+) | 58D dead |
C : cecum, A : ascending colon, R : rectum, LN : lymph node, por : poorly differenciated adenocarcinoma, undiff : undifferenciated adenocarcinoma, adeno : adenocarcinoma, mod : moderately differenciated adenocarcinoma, wel : well differenciated adenocarcinoma, M : month, D : day, NA : data not available
治療については,Fujiwaraら11)の報告した唯一の24か月生存例が示すように根治術が重要であるが,腫瘍の進行が早く迅速に対応する必要がある.化学療法で確立されたものはないが,FOLFOX/FOLFIRI療法を施行した柴原ら10)の報告例は死亡例ながら手術から13か月と比較的長く生存しており,強力な化学療法が予後を改善する可能性はある.しかし,分子標的薬についてはG-CSF産生腫瘍のinterleukin-17を介した血管新生はVEGFに依存せず,抗血管新生薬には抵抗性であるとの最近の報告がある13).また,自験例はk-ras野生型にてこの疾患に対して初めてcetuximabを投与したが,病気の進行を抑制することができなかった.1例のみの投与であり,今後の検証が必要である.放射線治療については5年無病生存のG-CSF産生肺癌の報告があり14),今後,大腸癌においても有望な治療選択肢となる可能性がある.
自験例と住吉ら12)の報告では死亡前に多発脳梗塞を発症した.悪性腫瘍により凝固亢進状態を生じ,脳動脈・静脈血栓症を併発し脳卒中を引き起こし,さまざまな神経症状を呈する病態をTrousseau症候群と称す15).その特徴は皮質性梗塞や穿通枝梗塞の混在,内頸動脈・椎骨動脈領域にも一致しない多発する脳梗塞といわれている15)16).G-CSFは,その神経保護・再生を期待して脳梗塞に対する臨床研究がすすめられているが17),その一方で,過剰なG-CSFによる顆粒球の増加は血液の粘張度を増加し,血栓をじゃっ起する.G-CSF産生腫瘍には血管内血栓,局所DICの所見がみられる5).G-CSF産生舌癌の剖検例では,多発脳梗塞に加え肺,肝臓,心臓,腎臓,副腎にも多数の血栓が観察された18).重要臓器の梗塞がこの癌の予後をさらに悪くしていると考えられた.
この疾病の病態解明・治療法の確立には症例の集積が必要である.そのためには我々臨床医がこの疾病を認識し,急激な経過をたどることを念頭におき迅速に対応しなくてはならない.さらに,G-CSF採血検査・G-CSF免疫染色は特殊検査で,現状として全ての医療機関で行えるわけではないが,遅滞なくこれらの検査が施行できる環境整備が重要である.
利益相反:なし