目的:大腸癌肝転移にペルフルブタン(ソナゾイドTM)を用いた術中造影超音波検査(contrast enhanced intraoperative ultrasound;以下,CE-IOUSと略記)の有効性を検証する.方法:対象は2011年4月より2013年3月までに大腸癌肝転移で肝切除を施行した18症例28結節である.画像診断として造影超音波検査(contrast enhanced ultrasound;CE-US),造影CT,造影MRI,PET-CTとの診断能力につき比較検討した.結果:術前画像評価で最も診断率が高かったのはMRIで88.9%,CTの正診率は75.0%.28結節全てCE-IOUSで指摘できたが,うち2結節に関してはperfusion defectを認めない高エコー腫瘤であった.この2結節は病理組織学的診断でpathological complete responseであった.化学療法後肝切除となった22結節,うち切除標本で5~10 mmの大きさであった9結節全てCE-IOUSで指摘可能であった.結語:CE-IOUSは大腸癌肝転移の術中局在検出率が最も高く,5~10 mmという微小な化学療法後の大腸癌肝転移でも全病変を検出可能であった.
原発性肝癌(以下,HCCと略記)に対するペルフルブタン(ソナゾイドTM)を用いた超音波検査で,肝病変検出率が向上したとの報告がある1)が,転移性肝癌に対しては,造影超音波検査(contrast enhanced ultrasound;以下,CE-USと略記)の有効性について検討された報告は少ない2)3).近年ペルフルブタン(ソナゾイドTM)を用いた術中造影超音波検査(contrast enhanced intraoperative ultrasound;以下,CE-IOUSと略記)は微小肝細胞癌の検出4)や切除範囲の設定5)に有効であるという報告がある.今回ペルフルブタンを用いたCE-IOUSでの大腸癌の肝転移病変検出率,特に化学療法後の微小病変について各種画像検査と比較検討した.
2011年4月より2013年3月までに旭川厚生病院でCE-IOUSを施行し切除またはラジオ波凝固療法(radiofrequency ablation;以下,RFAと略記)を施行した大腸癌の肝転移は18症例32結節であった.RFAを施行した4結節を除外し,病理組織学的評価を行った18症例28結節を対象とした.
術前の画像診断は,ペルフルブタンによる体表からのCE-US,造影CT,Gd-EOBによる造影MRI,PET-CTを行った.これらの画像診断とCE-IOUSを比較検討した.化学療法後の患者は化学療法後の画像評価を採用した.診断の正診については切除したものは病理組織学的評価を行った.RFA症例については病理組織学的に評価していない.各々の評価で診断の正診率を測定した.腫瘍径は切除標本で測定し,化学療法後の画像評価はRECIST1.1を使用した.化学療法後の病理組織学的評価は大腸癌取扱い規約第8版6)を使用した.
CE-IOUSの造影剤は,ペルフルブタン(ソナゾイドTM)を用いた.超音波検査用プローべは7.0 MHzのリニア型を使用,mechanical indicesは0.15に設定した.ペルフルブタンは体重に関係なく0.5 ml(4 μl)を投与し静注直後の早期相と10分後のKupffer相を評価した.術中画像評価は複数の術者(消化器外科専門医)が術中診断を行った.Table 1に検討対象18症例28結節のバックグラウンドを提示する.平均年齢は67歳,男性が15例で女性は3例であった.化学療法後の切除症例は9症例19結節であった.
| Characterictics | Number |
|---|---|
| Age | 66.9±7.2 (55–77) |
| Male : Female | 15 : 3 |
| Operation time | 242.0±89.3 min (143–415 min) |
| Intraoperative blood loss | 413.3±459.6 ml |
| Surgical procedure (including overlap) | |
| Partial resection | 17 |
| Lateral segmental resection | 2 |
| Posterior segmental resection | 1 |
| Subsegmental resection (S4, S5) | 2 |
| Complications | |
| Intraabdominal abscess | 2 |
| Wound dehiscence | 1 |
| Operation after chemotherapy | 9 cases (19 nodules) |
*Chemotherapy Regimen: mFOLFOX6+Bevacizmab 5 cases, FOLFIRI+Bevacizmab 2 cases, mFOLFOX6 1 case, Capecitabine 1 case
Table 2に,18症例28結節における各画像診断の肝病変検出率を示す.術前画像評価で指摘されずCE-IOUSで新たに指摘された病変は1病変でその病変はRFAが施行されており本検討では対象外となっている.術前画像評価で最も診断率が高かったのはMRIで88.9%,CTの正診率は75.0%であった.CTで確定診断できなかった結節は血管腫と限局性胆管拡張,MRIで確定診断できなかった病変は炎症性変化とそれぞれ診断していた.28結節は全てCE-IOUSで指摘可能であったが,2結節は高エコー腫瘤として指摘されperfusion defect像を確認できなかった.これらの2結節は切除後の病理組織学的評価でpathological complete response(以下,pCRと略記)が得られていた.
| Each diagnostic imagings | Number of nodules |
|---|---|
| CT | |
| Detected | 21 (75.0%) |
| Not detected | 5 |
| Misdiagnosed | 2* |
| CE-US | |
| Detected | 24 (88.9%)† |
| Not detected | 3 |
| Unexamined | 1 |
| MRI | |
| Detected | 24 (85.7%) |
| Not detected | 3 |
| Misdiagnosed | 1†† |
| PET-CT | |
| Detected | 16 (57.1%) |
| Not detected | 11 |
| Unexamined | 1 |
| CE-IOUS | |
| Detected | 28 (100.0%)††† |
| Not detected | 0 |
CE-US: contrast enhanced ultrasound, CE-IOUS: contrast enhanced intraoperative ultrasound. *One nodule was diagnosed hemangioma, the other was located bile duct dilatation. †High echoic lesions were 2 nodules and one nodule was detected iso-echoic-nodule. These nodules were evaluated atypical lesions. ††This nodule was diagnosed inflammatory change. These nodules evaluated atypical lesions. †††High echoic lesions were 2 nodules. These nodules were evaluated atypical lesions.
Fig. 1に,微小病変例を提示する.症例は60歳男性,肝S3にCTで転移を認めた(Fig. 1A).BevacizmabとmFOLFOX6による化学療法を6コース施行後のCTでは転移巣は指摘できなかった(Fig. 1B).造影MRIでは転移の存在は確認できた(Fig. 1C).CE-IOUSではperfusion defectを伴う転移病変と術中判断し外部分切除を施行した(Fig. 1D).切除標本では,8×8 mm大の腫瘤として指摘された(Fig. 1E).病理報告では転移と診断,効果判定はgrade 1bであった(Fig. 1E).
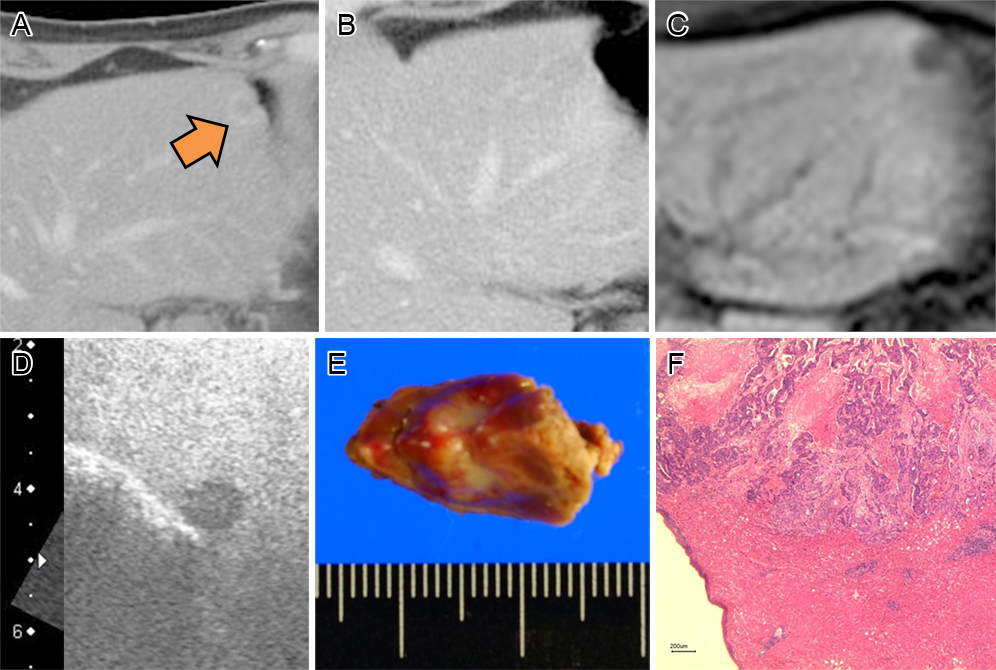
A case of a small lesion is shown. A) enhanced CT before chemotherapy. CT shows a low intensity area at S3 (arrow). B) CT after chemotherapy. CT does not show the metastatic lesion. C) enhanced MRI shows a diffuse low intensity area. D) contrast enhanced intraoperative ultrasound (CE-IOUS) shows a mass with perfusion defect. E) specimen shows a mass 8×8 mm in size. F) pathological findings show the metastatic tumor which was grade 1b.
Table 3はpCRの得られた4結節を示す.術前画像としてはCE-USで高エコー腫瘤や非典型像として指摘されることが多かった.CE-IOUSで全病変指摘可能であったが,2結節は高エコー腫瘤として指摘された.2病変に関しては術前のCT,MRIでも指摘できなかったが,CE-IOUSで指摘することが可能であった.
| Case number | Sex | Age | Location | CT | CE-US | MRI | PET | CE-IOUS | Specimen (mm) | Chemotherapy |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 61 | S2 | ND | D* | ND | ND | D | 10 | BV+mFOLFOX6 |
| S5 | D | D* | D | ND | D* | 15×15 | ||||
| S5 | ND | ND | ND | ND | D* | 15×15 | ||||
| 2 | F | 70 | S5 | D | D† | D | ND | D | 8×5 | mFOLFOX6 |
M: Male, F: Female, D: detected, ND: not detected, BV: bevacizumab, *These nodules were detected atypical high echoic nodule without perfusion defect. †This nodule was detected atypical iso echoic nodule.
Fig. 2に,Table 3のcase number 1の病変を提示する.MRIで化学療法前は約3.5 cmの腫瘤として指摘されていたが(Fig. 2A),化学療法後約1.5 cmまでの縮小が確認され(Fig. 2B)partial response(RECIST1.1)と判断した.術前の体表からのUS(Fig. 2C)・CE-IOUS(Fig. 2D)ではKupffer相でも,perfusion defectを認めない高エコー性腫瘤として指摘された.CE-IOUSで確認しながら肝部分切除を施行した.切除標本で繊維化を伴う腫瘤として指摘(Fig. 2E),同部位を病理組織学的検索では,壊死組織を伴う炎症性肉芽の形成,炎症細胞浸潤をのみで,残存腫瘍細胞は認めないと報告を受けた(Fig. 2F).
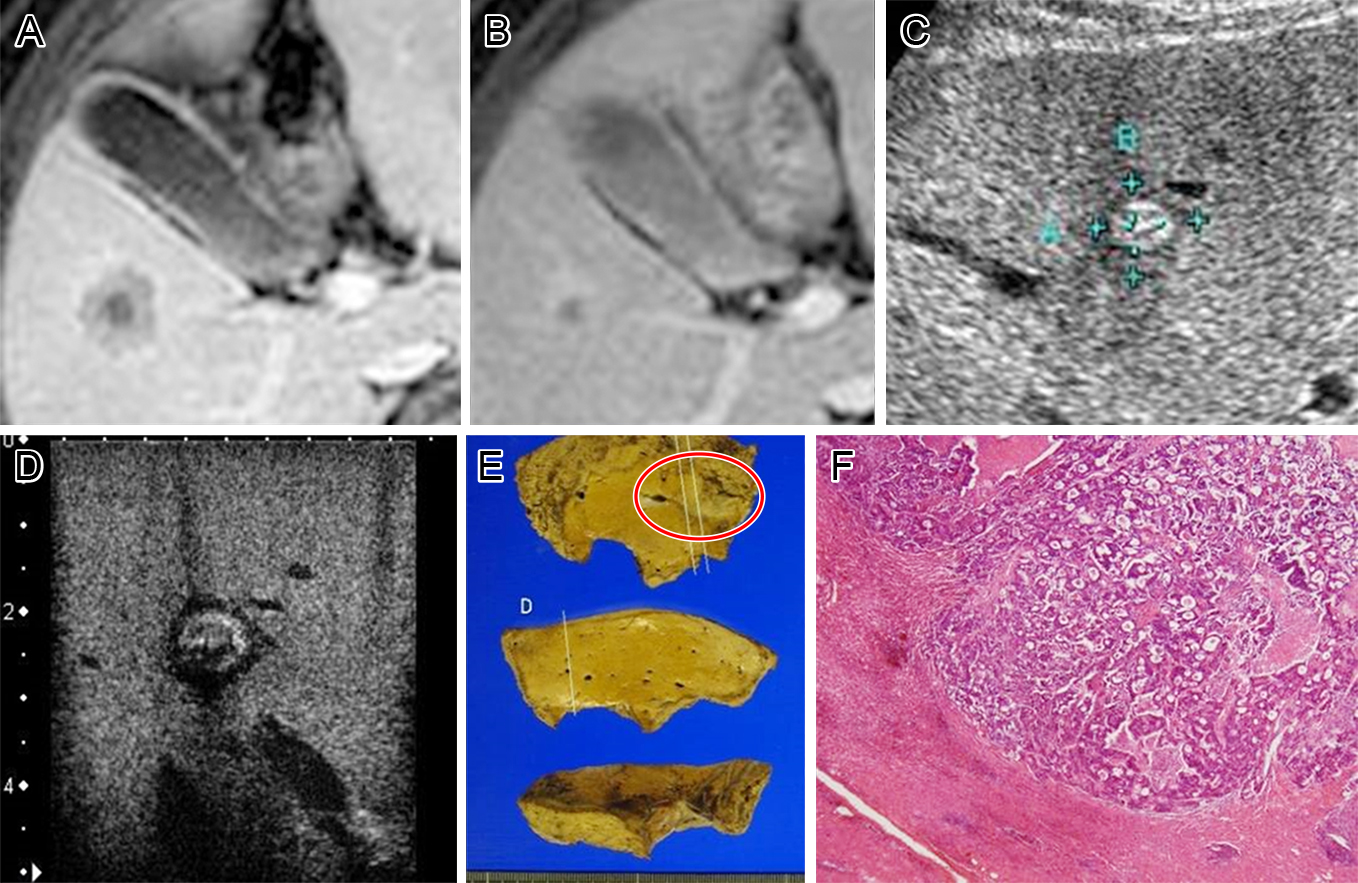
A case of pathological complete response (pCR) (case number 1 in Table 3). A) enhanced MRI before chemotherapy. MRI shows a low intensity area at S5. B) MRI after chemotherapy shows reduced tumor size. Evaluation by RECIST 1.1 was partial response (PR). C) contrast enhanced ultrasound (CE-US) shows hyperechoic nodules without any perfusion defect. D) contrast enhanced intraoperative ultrasound (CE-IOUS) shows hyperechoic nodules without perfusion defect. E) specimen shows the fibrotic tumor (circle). F) pathological findings show necrosis tissue with inflammatory cells and granuloma.
化学療法施行後に手術を行ったのは9症例19結節であった.Table 4に,化学療法後切除した19結節の腫瘍径別に同定率を示す.CE-USの指摘率は84.2%であり,うち3結節は典型的な転移の病変として指摘できなかった.PET-CTでの同定率は36.4%と低かった.CE-IOUSは全病変指摘可能であった.
| Nodule number | CT | CE-US | MRI | PET | CE-IOUS | |
|---|---|---|---|---|---|---|
| Total | 19 | 14 (82.4%) | 17 (84.2%) | 16 (84.2%) | 8 (42.1%) | 19 (100%) |
| 5–10 mm | 9 | 6 (66.6%) | 8 (88.9%)† | 7 (77.8%) | 1 (11.1%) | 9 (100.0%) |
| 11–20 mm | 9 | 7 (77.8%) | 8 (88.9%)†† | 8 (88.9%) | 6 (66.7%) | 9 (100.0%)* |
| 21 mm over | 1 | 1 (100.0%) | 1 (100.0%) | 1 (100.0%) | 1 (100.0%) | 1 (100.0%) |
†One nodule was atypical lesions as high echoic lesion and the other lesion was misdiagnosed as iso echoic lesion. ††One nodule was atypical lesion as high echoic lesion. *Two nodules were atypical lesions as high echoic lesion.
今回の我々の検討では,大腸癌肝転移に対するCE-IOUSは,検出感度が最も高く,有効であることが分かった.特に化学療法施行後の腫瘍径5~10 mmの微小病変の検出に優れていることが確認された.
CE-USの有効性であるが,Hatanakaら7)の報告では,肝病変108結節(HCCは90結節,肝転移は16結節,肝内胆管癌は2結節,5結節はadenomatous hyperplasia)に対する体表からのペルフルブタンによるCE-USの検出率は95.4%であり,またCE-IOUSはCTやMRI,術中の単純超音波と比較しても感度が高かった8),とする報告もある.今回の我々の検討でも病変検出率はMRIで88.9%,CE-IOUSは全病変を結節として指摘可能であった.
また,CE-IOUSは化学療法施行後の腫瘍径5~10 mmの微小病変まで,検出可能であることが確認された.大腸癌の肝転移に対し,積極的な肝切除を行うことで予後は改善が得られている9).近年,同時切除困難な大腸癌肝転移に対しては,原発病巣切除・化学療法施行後の肝切除症例が増加している10).一方,化学療法後の肝切除は病変が縮小するため,病変の局在確認が困難になることが多い.CTおよびAngio CTによる画像評価でCRとなった72結節中22結節(30.6%)に腫瘍が遺残していたという報告11)や画像上CRであった66結節中55結節(83%)の肝転移が病理学的に遺残していた,という報告12)もあり,たとえ画像上CRとなった病変であっても肝切除を施行すべきと報告されている13).今回の我々の検討では化学療法後5~10 mmの9病変に関してもCE-IOUSで検出でき,結果としてpathological CRとなった4病変も結節としては指摘可能であった.
しかし,この研究には限界がある.第一の問題として,今回の検討では,CE-IOUSで指摘されていない5 mm以下の転移に関しては見逃されている可能性がある.第二の問題として,今回の検討では術前に画像で評価した部位を中心に観察しているため,正診率が高く,術前画像で見ていない部分は詳細に検討していない,という診断バイアスがかかっている可能性がある.また,pCRは術前のCE-USでも非典型像を呈し,CE-IOUSではperfusion defect像の確認できない傾向になったが,これらの因果関係については症例数が少ないため検討していない.
ペルフルブタン使用方法は,体重にかかわらず投与量を決め,超音波設定も同一にしていたが診断上の大きな問題なく,消化器外科医にとっても術中の肝病変局在診断が容易であり,簡便な方法であった.
まとめとして,大腸癌肝転移の術中局在診断の方法としてCE-IOUSは,簡便であり病変の検出率が高く,5~10 mmという微小な化学療法後の大腸癌肝転移でも指摘可能であった.
利益相反:なし