Abstract
症例は49歳の男性で,胃検診で異常を認めたため精査を行ったところCTで胃大彎側のリンパ節腫大を伴う胃前庭部大彎と連続した12×8 cmの腫瘤を認めた.胃由来のgastrointestinal stromal cell tumor(以下,GISTと略記)の診断で手術を施行した.腫瘍は胃前庭部大彎より発生しており,右胃大網静脈領域(No6およびNo14v)のリンパ節腫大を認めた.リンパ節を術中迅速診断に提出したところCastleman病(Castleman’s disease;以下,CDと略記)の診断であったため胃局所切除術を行って手術を終了した.術後4か月後のCTでは再発所見を認めずリンパ節は消失していた.CDはリンパ濾胞の過形成に加え形質細胞が濾胞間に多数浸潤する組織所見を有する原因不明のリンパ増殖性疾患である.CDを合併したGISTの症例はこれまで報告がない.
はじめに
Castleman病(Castleman’s disease;以下,CDと略記)は1954年にCastlemanら1)により最初に報告された原因不明のリンパ増殖性疾患である.Gastrointestinal stromal cell tumor(以下,GISTと略記)は食道から直腸までの主として平滑筋層ないし粘膜筋板層に存在し受容体型チロシンキナーゼKIT(以下,c-kitと略記)を発現するCajal介在細胞より発生する粘膜下腫瘍である2).今回CDを合併した胃GISTの1例を経験した.GISTのリンパ節転移は3~4.3%とまれであり3)4),リンパ節腫大を伴うGISTの診断および治療方針を検討する際には本症例のように他疾患を合併している可能性を念頭に置く必要がある.これまでCDを合併したGISTの症例の報告はなくその治療方針も含めて文献的考察を加え報告する.
症例
患者:49歳,男性
主訴:胃検診異常
家族歴:特記すべきことなし.
既往歴:16歳時,虫垂切除術
現病歴:2009年10月の胃検診で異常を指摘され紹介医を受診,腹部超音波検査で腹腔内に巨大な腫瘍を認め精査・加療目的に当院を紹介,受診となった.
入院時現症:右腹部に手拳大の可動性良好な腫瘤を触知した.圧痛は認めなかった.
入院時血液検査所見:血算,生化学検査では異常所見を認めなかった.
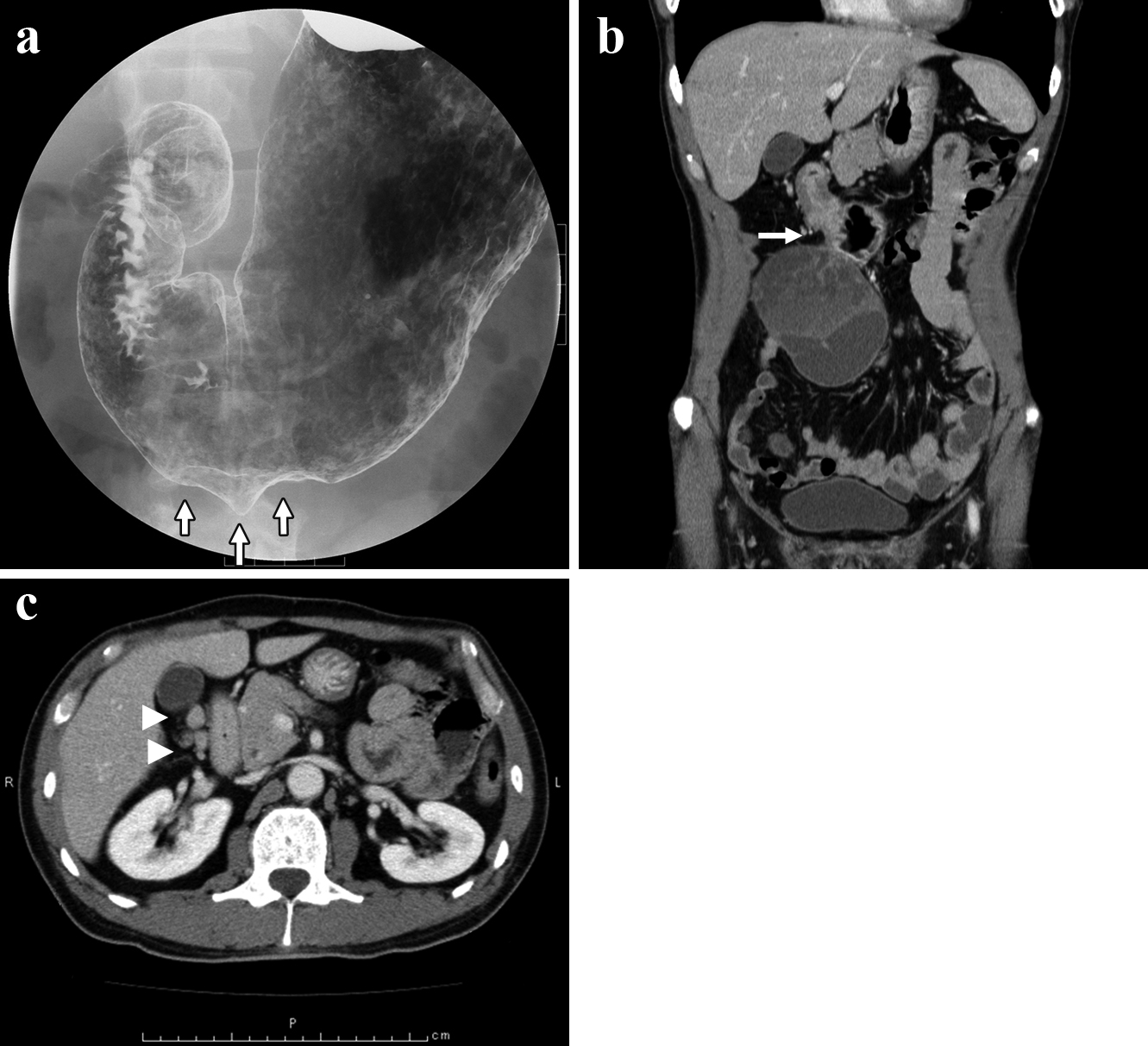
上部消化管造影検査所見:胃角部大彎に中心部に陥凹を伴い,立ち上がりのなだらかな粘膜下腫瘍を認めた(Fig. 1a).
腹部造影CT所見:胃前庭部と連続する12×8 cmの内部が不均一で隔壁様構造を伴う充実性腫瘤を認めた.胃前庭部周囲に腫大したリンパ節を多数認めた(Fig. 1b, c).
以上より,胃前庭部大彎側に発生した胃GISTの診断で腫大リンパ節を術中迅速組織診断に提出しGISTの転移であれば系統的郭清を含めた幽門側胃切除術に移行する方針とし手術を施行した.
手術所見:胃前庭部大彎に連続する直径約12 cmの腫瘍を認めた.腫瘍の他臓器への浸潤は認めなかった.幽門下領域に柔らかく腫大したリンパ節を数個認め(最大径:3 cm),そのうち2個の腫大リンパ節を摘出し術中迅速組織診断に提出したところCDの診断であったため胃局所切除術のみを行い手術を終了した.
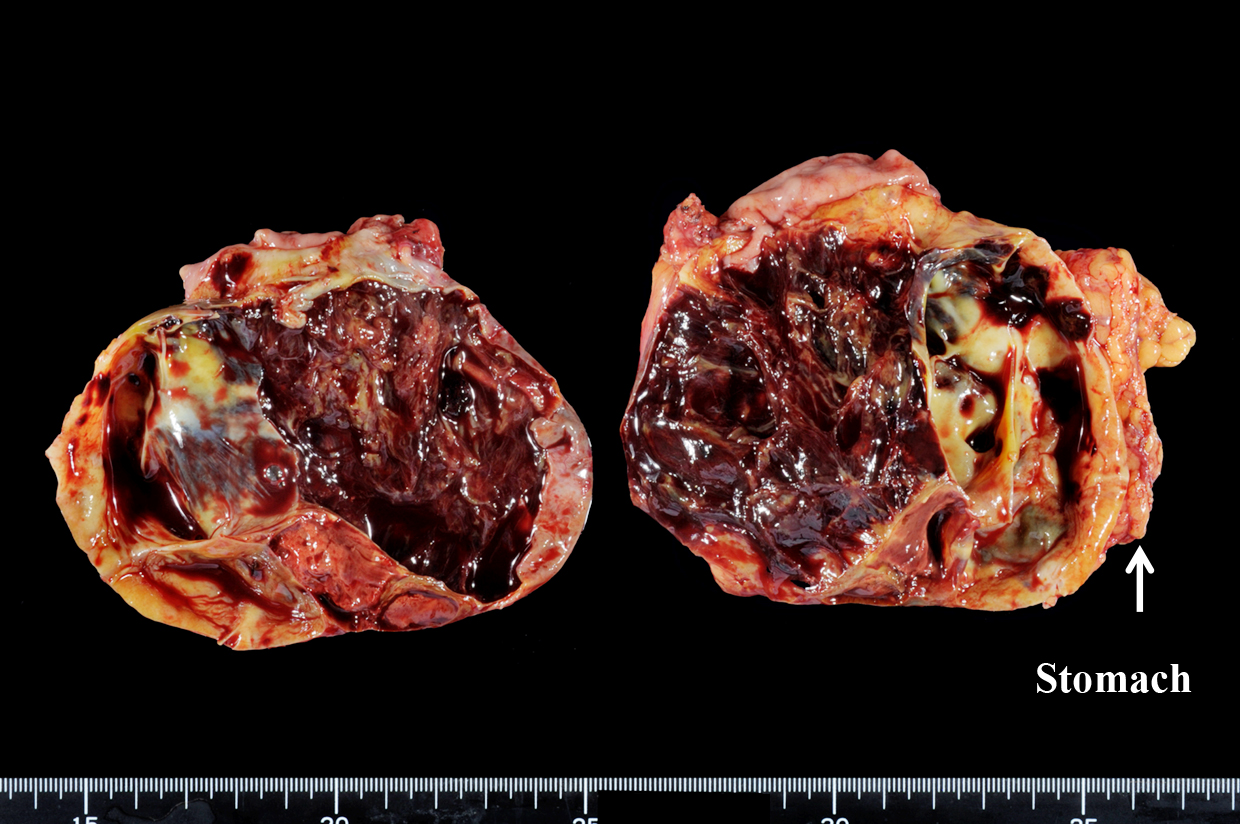
切除標本所見:腫瘍は胃壁より発生し径10.3×7.6 cmであった.表面漿膜は保たれており周囲臓器への浸潤は認めなかった.内部は高度出血や壊死を伴っており隔壁形成を認めた(Fig. 2).
病理組織学的検査所見:腫瘍は好酸性の胞体を持ち円形の核を有した細胞が充実性に増殖し免疫染色検査でc-kit(+),CD34(+),S-100(–)でありGISTの診断であった(Fig. 3a).摘出リンパ節はいずれもplasma cell typeのCDの診断であった(Fig. 3b).
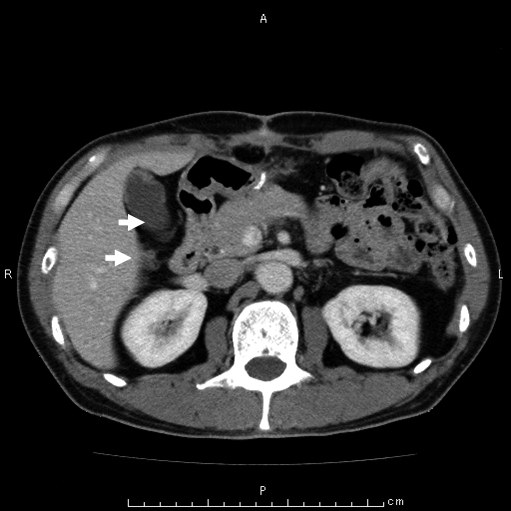
術後腹部造影CT所見:GISTの再発は認めず.前庭部~十二指腸周囲のリンパ節腫大は術中に摘出した以外の腫大リンパ節も含めて消失していた(Fig. 4:4か月後).
考察
CDはCastlemanら1)により報告されたリンパ増殖性疾患であり,近年CDがfollicular dendritic cell tumorに合併した報告もあり5)6)その関連性が示唆されているがいまだCDの明らかな発生原因は不明である.病理組織学的にhyaline vascular type(以下,HV typeと略記)とplasma cell type(以下,PC typeと略記),両者のmixed typeに分類され7),HV type CD:68.3~91%,PC type CD:6.2~13.3%と報告されている7)~9).臨床的には限局性の腫瘤形成性病変を呈する単発性Castleman病(unicentric Castleman’s disease;以下,UCDと略記)とリンパ節病変が多発する多中心性Castleman病(multicentric Castleman’s disease;以下,MCDと略記)に分類される.UCDはHV type CDのほぼ全例で,無症状で偶発的に発見されることが多く予後は良好である.症状がなく表在・浅在の腫大リンパ節より生検で診断がついた場合は経過観察でよいが,圧排症状の緩和や確定診断を目的とした切除が行われる場合もある9)10).MCDの多くはPC type CDであり難治性で非特異的な慢性炎症症状に加えて高ガンマグロブリン血症や種々の自己抗体の出現など多彩な検査異常を示す.また,二次的に合併するネフローゼ,間質性肺炎,血液疾患,自己免疫性疾患などが予後を左右する9)10).多剤併用抗癌剤やステロイド治療,放射線治療など試みられているが,死亡率25~59%と予後は不良である9)10).近年これらの病態に多機能サイトカインであるIL-6の腫大リンパ節からの過剰産生が関わることが明らかとなり11),ヒト化抗IL-6受容体抗体(tocilizumab)が治療に用いられている12).本症例においてはPC type CDであったが無症候性のUCDであったため無治療で経過観察中である.
GISTは食道から直腸までの主として平滑筋層ないし粘膜筋板層に存在しc-kitを発現するCajal介在細胞より発生する2).粘膜下腫瘍として診断され壁内発育型,管内発育型,管外発育型,混合型の発育様式を示す13).散発性GISTの85~90%にc-kit遺伝子の機能獲得性突然変異が14),約10%に血小板由来増殖因子受容体α遺伝子の機能獲得性突然変異がみられ15),これらがGISTの発生原因と考えられている.GISTの治療は腫瘍切除が原則であり,本症例においては肉眼的に腫瘍を治癒切除できたものの腫瘍径が10 cm以上であることから高リスク群となるためGIST診療ガイドラインに則って術後補助化学療法の適応であった16).しかしながら,本人が補助化学療法を希望されず,術後4年経過した現在も外来で慎重に経過観察中である.
CDと他疾患との合併に関しては肺癌を伴うIgG4関連肺疾患にCDが合併した症例17)や,早期胃癌や大腸癌,胆管癌とCDの合併の症例報告も散見されるが18)~20),PubMedで「gastrointestinal stromal tumor」,「Castleman’s disease」をキーワードとして1950 年から2014年まで,医学中央雑誌で「GIST」,「Castleman’s disease」あるいは「キャッスルマン病」をキーワードとして1977年から2014年まで検索したところ,GISTに合併したCDの報告はこれまで見られない.未分化な多能性幹細胞や造血前駆細胞に発現するCD34抗原がGISTの70~80%に陽性でGISTの診断の指標とされており21),CDのリンパ節でのCD34発現を検討した報告はあるが22)23),本症例ではいずれの発現も認めず関連は否定的である.
GISTの発生頻度は10万人に1~2人とされ16),本邦のCDの発生頻度が年間110人程度と推察される24)ことを考えると,両疾患が関連なく合併することは極めてまれと考えられる.しかし,GISTのリンパ節転移自体も3~4.3%とまれであり3)4),GIST症例に腫大リンパ節を認めた場合は本症例のようにCDを合併することや悪性リンパ腫を合併したGISTの報告もあり25),他疾患によるリンパ節腫大の可能性を念頭に置く必要がある.また,GIST症例におけるリンパ節の系統的かつ予防的郭清が予後を改善するという報告はなく,リンパ節転移を認めた場合でもリンパ節のサンプリングにとどめるべきと考えられている16).そのため腫大リンパ節がGISTの転移なのか他疾患の合併なのかを判断することは不必要な郭清による侵襲を避けるためにも必要である.本症例のようにGISTの周囲に腫大リンパ節を認めた場合,術中迅速組織診断を行いリンパ節転移か否かの診断をつけることが切除範囲の決定や治療方針を決めるために重要と考えられた.
利益相反:なし
文献
- 1) Castleman B, Towne VW. Case records of the Massachusetts General Hospital, case 40011. New Engl J Med. 1954;250:26–30.
- 2) 廣田 誠一, 羽尾 裕之, 磯崎 耕次.GISTの病理診断.外科治療2.2010;102:134–143.
- 3) DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231(1):51–58.
- 4) Pierie JP, Choudry U, Muzikansky A, Yeap BY, Souba WW, Ott MJ. The effect of surgery and grade on outcome of gastrointestinal stromal tumors. Arch Surg. 2001;136(4):383–389.
- 5) Ohgami RS, Zhao S, Ohgami JK, Leavitt MO, Zehnder JL, West RB, et al. TdT+T-lymphoblastic population are increased in Castleman disease, in Castleman disease in association with follicular dendritic cell tumors, and in angioimmunoblastic T-cell lymphoma. Am J Surg Pathol. 2012;36(11):1619–1628.
- 6) Cakir E, Aydin NE, Samdanci E, Karadag N, Sayin S, Kizilay A. Follicular dendritic cell sarcoma associated with hyaline-vascular Castleman’s disease. J Pak Med Assoc. 2013;63(3):393–395.
- 7) Keller AR, Hochholzer L, Castleman B. Hyalinevascular and plasma-cell types of giant lymph node hyperplasia of the mediastinum and other location. Cancer. 1972;29:670–683.
- 8) 浜田 史洋, 西山 宜孝, 藤原 恒太郎, 高須 伸治, 井上 文之, 折田 薫三.後縦隔発生Castleman lymphomaの1例―本邦報告218例の検討―.日本臨床外科学会雑誌.1992;53:2100–2103.
- 9) Bowne WB, Lewis JJ, Filippa DA, Niesvizky R, Brooks AD, Burt ME, et al. The management of unicentric and multicentric Castleman’s disease: a report of 16 cases and a review of the literature. Cancer. 1999;85(3):706–717.
- 10) Herrada J, Cabanillas F, Rice L, Manning J, Pugh W. The clinical behavior of localized and multicentric Castleman disease. Ann Intern Med. 1998;128:657–662.
- 11) Yoshizaki K, Matsuda T, Nishimoto N, Kuritani T, Taeho L, Aozasa K, et al. Pathogenic significance of interleukin-6 (IL-6/BSF-2) in Castleman’s disease. Blood. 1989;74(4):1360–1367.
- 12) Nishimoto N, Kanakura Y, Aozasa K, Johkoh T, Nakamura M, Nakano S, et al. Humanized anti-interleukin-6 receptor antibody treatment of multicentric Castleman disease. Blood. 2005;106(8):2627–2632.
- 13) 六車 一哉, 大平 雅一, 田中 浩明, 久保 尚士, 澤田 鉄二, 平川 弘聖.粘膜下腫瘍の治療方針と術前診断.消化器外科.2011;34(2):159–168.
- 14) Maeda H, Yamagata A, Nishikawa S, Yoshinaga K, Kobayashi S, Nishi K, et al. Requirement of c-kit for development of intestinal pacemaker system. Development. 1992;116(2):369–375.
- 15) Hirota S, Ohashi A, Nishida T, Isozaki K, Kinoshita K, Shinomura Y, et al. Gain-of-function mutations of platelet-derived growth factor receptor alpha gene in gastrointestinal stromal tumors. Gastroenterology. 2003;125(3):660–667.
- 16) 日本癌治療学会,日本胃癌学会,GIST研究会編.GIST診療ガイドライン第3版.東京:金原出版;2014. p. 32–34.
- 17) Ikari J, Kojima M, Tomita K, Nakamura T, Toyoda F, Otsuki Y, et al. A case of IgG4-related lung disease associated with multicentric Castleman’s disease and lung cancer. Intern Med. 2010;49(13):1287–1291.
- 18) 桑谷 俊彦, 福永 亮朗, 笹村 裕二, 武山 聡, 沼田 昭彦, 子野日 政昭.胆管癌にCastleman’s disease病を合併した一例.日本臨床外科学会雑誌.2010;71(3):870.
- 19) 林 達朗, 羽藤 慎二, 冨山 浩司, 万代 康弘, 伊野 英男, 内藤 稔.Castleman病および早期胃癌を合併した多発大腸癌の一例.日本消化器外科学会雑誌.2008;41(7):1295.
- 20) 安原 清司, 今泉 俊秀, 鈴木 衛, 中迫 利明,原田信比古, 羽鳥 隆,ほか.早期胃癌を併存した胃原発Castleman’s lymphomaの1例.東京女子医科大学雑誌.1993;63(3):301–305.
- 21) Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical spectrum of GISTS at different sites and their differential diagnosis with a reference to CD117 (KIT). Med Pathol. 2000;13(10):1134–1142.
- 22) Chen WC, Jones D, Ho CL, Cheng CN, Tseng JY, Tsai HP, et al. Cytogenetic anomalies in hyaline vascular Castleman disease: report of two cases with reappraisal of histogenesis. Cancer Genet Cytogenet. 2006;164:110–117.
- 23) Xiong Y, Zhang Y, Wang Y, Na J, Li T. Stroma-rich variant of hyaline-vascular Castleman’s disease: a clinicopathologic and histogenetic study. Zhonghua Bing Li Xue Za Zhi. 2010;39(1):14–18.
- 24) 市村 浩一, 田中 健大, 吉野 正.【リンパ節非腫瘍性疾患のみかた】follicular patternを呈する疾患 Castleman病(孤立性,ならびに多中心性).病理と臨床.2007;25(2):151–156.
- 25) Pamukçuoglu M, Budakoğlu B, Han O, Tad M, Oksüzoğlu B, Abali H, et al. An extraordinary case in whom gastrointestinal stromal tumor and low-grade malignant lymphoma are seen together in the stomach. Med Oncol. 2007;24(3):351–353.