2015 年 48 巻 8 号 p. 661-668
2015 年 48 巻 8 号 p. 661-668
目的:膵intraductal papillary mucinous neoplasm(以下,IPMNと略記)の良悪性の鑑別,特に微小浸潤癌の取扱いについて検討した.方法:2013年12月までに当院で切除した,膵IPMN 70例71病変(良性46例,悪性25例)を対象に,主膵管径,間質浸潤距離で分類し,悪性度や予後を検討した.結果:主膵管径10 mm以上16例,5~9 mm 24例,5 mm以下31例で,悪性は7例(43.7%),9例(37.5%),9例(29.0%)であった.年齢,囊胞径,主膵管径,壁在結節では,いずれも壁在結節が悪性度と関連していた(P≤0.05).間質浸潤距離でT1a(≤0.5 cm),T1b(>0.5 cmかつ≤1.0 cm),T1c(>1 cmかつ≤2 cm),T2(>2 cm)に分類すると,非浸潤癌8例,T1a 7例,T1b 2例,T1c 5例,T2 3例で,1996年以降の悪性IPMN 20例と通常型膵癌132例の予後比較では,T1a以下の悪性IPMNは5年生存率100%で,T1b以上(38.5%,P=0.013),通常型膵癌T1(41.6%,P=0.03)より有意に予後良好であった.結語:主膵管径10 mm以上,10 mm未満では壁在結節があれば悪性の頻度が高く,手術適応となる.T1aは早期癌と考えられ,治癒切除できる可能性が高い.
膵管内乳頭粘液性腫瘍(intraductal papillary mucinous neoplasm;以下,IPMNと略記)の手術適応は悪性化のリスクより,主膵管型IPMNでは主膵管径が10 mm以上のもの,分枝型IPMNでは悪性を強く示す閉塞性黄疸を伴う膵頭部の囊胞性病変,造影される充実性成分,主膵管径10 mm以上が「high-risk stigmata」とされている.主膵管径5~9 mmは「worrisome features」とされ,分枝型IPMNでは他の因子(囊胞径,壁在結節など)と総合して,詳細な治療のアルゴリズムが示されている.混合型は主膵管型IPMNと分枝型IPMNの双方の基準に合致するものとなっているが,正確な分類とその切除基準は明確ではない1).
組織別には,膵管内乳頭粘液性腺腫(intraductal papillary mucinous adenoma;以下,IPMAと略記)/low grade to intermediate dysplasia,膵管内乳頭粘液性癌(intraductal papillary mucinous carcinoma;以下,IPMCと略記)に分類され,IPMCは切除でほぼ治癒するIPMC非浸潤癌/high-grade dysplasiaとIPMC浸潤癌/invasive carcinomaに分類される(Table 1)2)3).微小浸潤癌(minimally invasive carcinoma)は浸潤癌の中で比較的浸潤の軽度のものであるが,浸潤の距離については明確な基準はない.これまでの報告例でも浸潤癌よりあきらかに手術予後は良く,微小浸潤癌は早期癌の病態と考えられ,その取扱いは治療方針を決める上で重要となる.
| WHO 1996 | WHO 2010 | Classification of pancreatic carcinoma 6th revised and enlarged edition 2013 |
||||
|---|---|---|---|---|---|---|
| Adenoma | IPMN | with low grede dysplasia | IPMN | IPMA | mild atypia | |
| Borderline (moderate dysplasia) | with intermediate-grede dysplasia | moderate atypia | ||||
| severe atypia | ||||||
| IPMC | Non-invasive IPMC | with high grade dysplasia | IPMC | non-invasive | ||
| Invasive IPMC | IPMN with an assosiated invasive carcinoma | minimally invasive | ||||
| invasive | ||||||
そこで,膵IPMNの良悪性の鑑別と,微小浸潤癌の取扱いについて自験例をもとに検討を行った.
1987年から2013年12月までに切除を行った,膵IPMN 70例71病変を対象とした.良性(IPMA/low to intermediate grade dysplasia)46例,悪性(IPMC/high grade dyaplasia~invasive carcinoma)25例,男性40例,女性30例,平均年齢は69歳,平均腫瘍径43.6 mm,平均膵管径7.0 mmであった(Table 2).
| Total | MPD ≥10 mm | MPD 5–9 mm | MPD ≤5 mm | |
|---|---|---|---|---|
| Number of lesion | 71 | 16 | 24 | 31 |
| Gender (male:female) | 40:30 | 10:6 | 15:9 | 15:16 |
| Age (year) | 68.5 (28–83) | 69.3 (55–76) | 69.2 (44–83) | 67.5 (26–83) |
| Cyst size (mm) | 43.6 (10–120) | 50.0 (10–100) | 43.2 (20–80) | 42.2 (10–120) |
| MPD (mm) | 7.0 (1–27) | 13.7 (10–27) | 7.4 (6–9) | 3.3 (1–5) |
| MN (–:+) | 25:46 | 4:12 | 7:17 | 14:17 |
| MN size (mm) | 9.4 (2–60) | 12.4 (0–38) | 7.5 (0–35) | 9.3 (2–60) |
| IPMC (%) | 35.2 (25/71) | 43.7 (7/16) | 37.5 (9/24) | 29.0 (9/31) |
MPD: main pancreatic duct, MN: mural nodule
病変の部位は,膵頭部34例,膵体部18例,膵尾部14例,膵体尾部4例,膵頭部-尾部1例で,手術は標準手術として,膵頭十二指腸切除術18例,幽門輪温存膵頭十二指腸切除術19例,膵体尾部切除27例,膵全摘術2例に,縮小手術として,腹腔鏡下膵体尾部切除術2例,脾温存膵体尾部切除術2例,十二指腸温存膵頭切除術1例に施行した.
膵IPMNを,主膵管型,混合型,分枝膵管型を全て含め,主膵管径10 mm以上,主膵管径5~9 mm,主膵管径5 mm以下と分類し,年齢,囊胞径(病巣の最大径),主膵管径,壁在結節について悪性との関連を検討した.壁在結節は主にEUS画像で,EUS画像がない場合にはCT画像,腹部超音波画像などの術前画像診断で測定した.浸潤癌は切除標本に膵癌取扱い規約に準じて割面を入れ,膵管の拡張が最もみられる場所で,基底膜からの浸潤距離を測定した.間質浸潤の距離に応じてT2(>2 cm),T1(≤2 cm)は亜分類を作ってT1a(≤0.5 cm),T1b(>0.5 cmかつ≤1.0 cm),T1c(>1 cmかつ≤2 cm)に分類して,その治療成績について検討した.
また,1996年以降のIPMCの手術症例20例を,同時期に手術を行った通常型膵癌132例と,腫瘍の深達度(T因子),リンパ節転移の有無(N因子)において,それぞれ予後を比較した.
70例71病変(主膵管型6病変,混合型34病変,分枝膵管型31病変)全体では,壁在結節(P<0.0001)が良悪性の鑑別に有用であった.年齢(P=0.4517),主膵管径(P=0.098),囊胞径(P=0.1883)はいずれも悪性度との相関はみられなかった(Table 3).
| All patients (n=71) | MPD ≥10 mm (n=16) | |||||||
|---|---|---|---|---|---|---|---|---|
| Benign | Malignant | P value | Benign | Malignant | P value | |||
| (n=46) | (n=25) | SRA | MRA | (n=9) | (n=7) | SRA | MRA | |
| Age (year) | 69.2 | 67.2 | 0.4517 | 0.5172 | 69.0 | 69.9 | 0.8185 | 0.8033 |
| Cyst size (mm) | 41.3 | 49.2 | 0.1883 | 0.555 | 37.0 | 68.0 | 0.028 | 0.3069 |
| MPD (mm) | 6.3 | 8.3 | 0.0988 | 0.0536 | 11.9 | 16.1 | 0.1058 | 0.1902 |
| Mural nodule (mm) | 4.4 | 18.8 | <0.0001 | <0.0001 | 6.9 | 19.6 | 0.05 | 0.028 |
| MPD 5–9 mm (n=24) | MPD ≤5 mm (n=31) | |||||||
|---|---|---|---|---|---|---|---|---|
| Benign | Malignant | P value | Benign | Malignant | P value | |||
| (n=15) | (n=9) | SRA | MRA | (n=22) | (n=9) | SRA | MRA | |
| Age (year) | 71.3 | 65.9 | 0.1654 | 0.0673 | 67.9 | 66.7 | 0.8124 | 0.6918 |
| Cyst size (mm) | 44.0 | 41.0 | 0.6178 | 0.201 | 41.1 | 45.0 | 0.7422 | 0.1601 |
| MPD (mm) | 7.2 | 7.6 | 0.3613 | 0.9273 | 3.4 | 2.9 | 0.2847 | 0.2803 |
| Mural nodule (mm) | 3.3 | 14.4 | 0.0011 | 0.0007 | 4.0 | 22.4 | 0.0002 | 0.0001 |
MPD: main pancreatic duct, SRA: simple linear regression analysis, MRA: multiple linear regression analysis
主膵管径10 mm以上の16例(主膵管型5例,混合型11例,平均主膵管径13.8 mm)のうち,悪性は7例(43.7%)で,壁在結節(P=0.05),囊胞径(P=0.028)が悪性度と関連していた.年齢(P=0.8185),主膵管径(P=0.105)はいずれも悪性度との相関はみられなかった(Table 3).
主膵管径5~9 mmの24例(主膵管型1例,混合型23例,平均主膵管径7.4 mm)のうち,悪性は9例(37.5%)で,壁在結節(P=0.0011)が悪性度に関連していた.年齢(P=0.1654),主膵管径(P=0.3613),囊胞径(P=0.6178)はいずれも悪性度との相関はみられなかった(Table 3).
主膵管径5 mm以下の31例(分枝膵管型31例,平均主膵管径3.3 mm)のうち,悪性は9例(29.0%)で,壁在結節(P=0.0002)のみが悪性度と関連していた.年齢(P=0.8124),主膵管径(P=0.2847),囊胞径(P=0.7422)はいずれも悪性度との相関はみられなかった(Table 3).
また,主膵管径3群間の比較では主膵管径が大きい程悪性度が高い傾向にあった(主膵管径10 mm以上43.7%,5~9 mm 37.5%,5 mm以下29.0%).囊胞径も,主膵管径が大きいほど大きい傾向にあり,壁在結節の割合も主膵管径が大きいほど高い傾向にあった(Table 2).
主膵管径5 mm以下の症例においては,壁在結節を認めない症例は全て良性であった.また,壁在結節の大きさと悪性度との間にも関連がみられた.
壁在結節大きさについてROC曲線(receiver operating characteristic curve)を作成すると,AUC(area under the curve)は0.924と良好な診断精度を示しており,曲線からcut-off値を8 mmに設定すると,感度(sensitivity)81.8%,特異度(specificity)88.9%となった(Fig. 1).
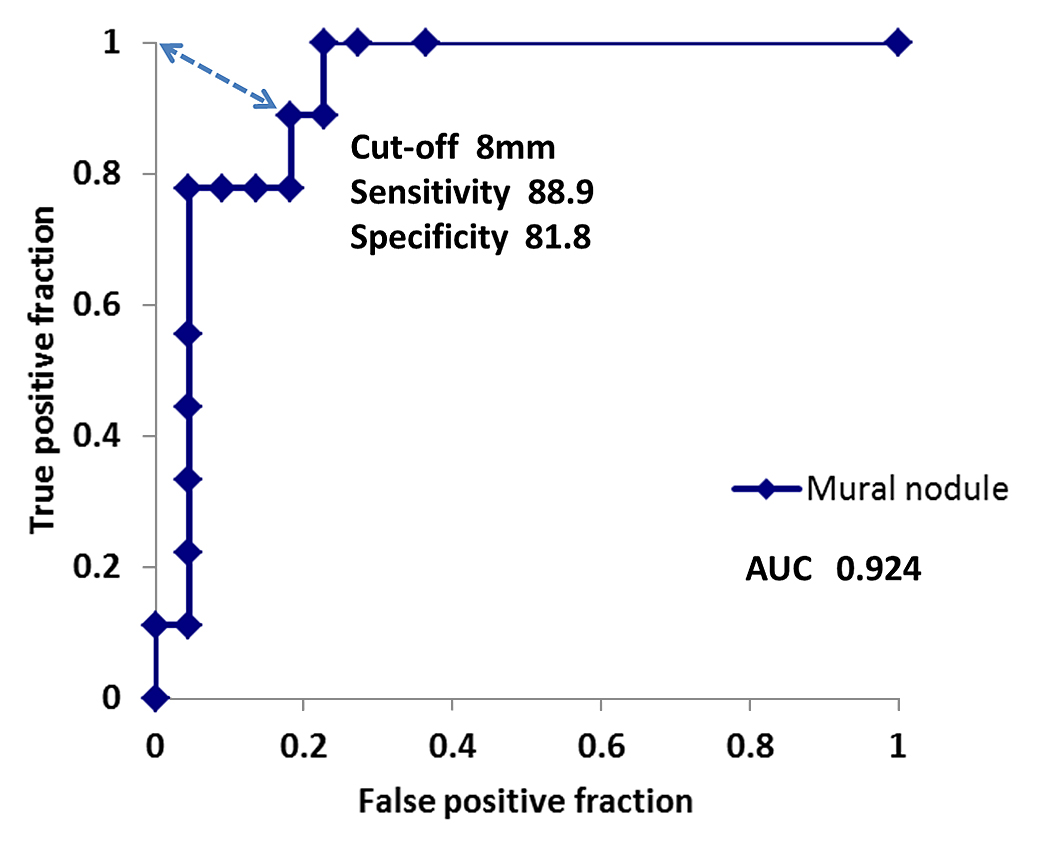
ROC curve of IPMNs with an MPD of ≤5 mm.
主膵管型,混合型,分枝膵管型と形態学的型分類での検討も行ったところ,主膵管型6例(平均主膵管径16.5 mm)のうち,悪性は3例(50.0%)で,囊胞径(P=0.0456)のみが悪性度と関連していた.年齢(P=0.2491),主膵管径(P=0.4818),壁在結節(P=0.5172)に悪性度との相関はみられなかった.
混合型34例(平均主膵管径9.0 mm)のうち,悪性は13例(38.2%)であり,壁在結節(P=0.0002)のみが悪性度と相関していた.年齢(P=0.4101),主膵管径(P=0.1552),囊胞径(P=0.6142)はいずれも悪性度との相関はみられなかった.
分枝膵管型31例は,主膵管径5 mm以下と全例同じで,壁在結節(P=0.0002)のみが悪性度と関連していた.
主膵管型,混合型,分枝膵管型の3群間では,主膵管型(50.0%)>混合型(38.2%)>分枝膵管型(29.0%)の順に悪性度が高かった.
2. 微小浸潤距離とリンパ節転移,予後との関連IPMCの間質浸潤について検討すると,間質浸潤のない非浸潤癌(high grade dysplasia)が8例,T1a(≤0.5 cm)が7例,T1b(>0.5 cmかつ≤1.0 cm)が2例,T1c(>1 cmかつ≤2 cm)が5例,T2(>2 cm)が3例であった.
リンパ節転移は,T1c 3例とT2 2例にみられた.再発は非浸潤癌1例,T1b 1例,T1c 1例,T2 1例にみられ,T1aには認めなかった.
また,1996年以降に手術した通常型膵癌132例と同時期に手術したIPMC 20例との予後を比較すると,T1a以下のIPMCでは5年生存率100%で,T1b以上のIPMC(38.5%,P=0.013)や,通常型膵癌T1(41.6%,P=0.03)と比較しても,有意に予後は良好であった.しかし,T1b以上のIPMCの予後(38.5%)は,通常型膵癌T2(35.0%)と同程度であった(Fig. 2).

Survival curves in patients with pancreatic invasive ducal carcinoma (IDC) and IPMCs according to T stage (depth of invasion).
また,リンパ節転移例については,リンパ節転移のないIPMCでは5年生存率(84.6%)で,リンパ節転移のあるIPMCの5年生存率(0%)よりも有意に予後は良好であった(P=0.006).リンパ節転移のある場合については,IPMC,通常型膵癌(4.4%)とも予後に差はなかった(Fig. 3).
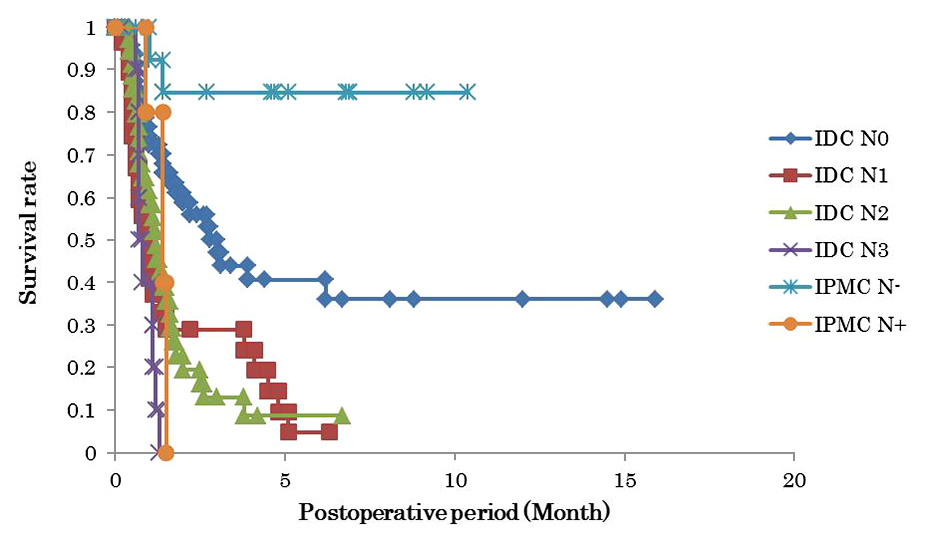
Survival curves in patients with pancreatic invasive ducal carcinoma (IDC) and IPMCs according to N stage (number of positive lymph nodes).
1982年に大橋ら4)によって粘液産生膵癌,あるいは予後のよい膵癌として報告されたIPMNは,その後に多くの知見が蓄積されて,その疾患概念も普及した.近年,IPMNと診断される症例は増加し,2006年にはIPMN/MCN国際診療ガイドライン初版5)が刊行され,国際的なコンセンサスも得られた.2012年には改訂版(以下,新ガイドラインと略記)1)が刊行され,さらに詳細に診断や治療に関しての指針が示された.
新ガイドライン1)では,主膵管型IPMNを「5 mmを超えるびまん性の主膵管拡張」と定義し,5~9 mmの主膵管拡張を悪性度についての「worrisome features」,10mm以上の拡張を「high-risk stigmata」と規定した.10 mm以上のものは悪性の頻度が高いため,可能であれば切除となっているが,主膵管5~9 mmの「worrisome features」を,どのように悪性度評価をし,経過観察もしくは手術適応としていくかの問題はまだ解決されていない.
また,分枝型IPMNは「主膵管と交通する5 mmを超える分枝の拡張」と定義され,新たに診療方針のアルゴリズムが示された.①CTまたはMRI上悪性を強く示す閉塞性黄疸を伴う膵頭部の囊胞性病変,②造影される充実性成分,③主膵管径≥10 mm以上を「high-risk stigmata」,①囊胞径≥30 mm以上,②造影される壁肥厚,③主膵管径5~9 mm,④造影効果のない壁在結節,⑤尾側に閉塞性膵炎を伴う主膵管狭窄およびリンパ節腫大を含むものを「worrisome features」と定義した.悪性のリスク因子を持たない患者で経過観察を伴う保存的な治療方針も可能とされている.
新ガイドライン1)によって,壁在結節の存在や,細胞診陽性が手術適応についてより重要な因子として考えられ,囊胞径は手術適応の絶対的なものではなくなった.以前から,壁在結節の存在は悪性度と強く相関していると考えられ,特に壁在結節高の増大に応じて病変の進展がみられるため,壁在結節高についても,さまざまな報告がなされてきた6)~13).しかし,手術適応のカットオフ値としては5~10 mmと差があり,今回のアルゴリズムには含まれていない.
今回の自験例の検討からは,主膵管径3群間の比較において,主膵管径が大きい程,囊胞径が大きく,悪性度が高い結果であった.IPMN/MCN国際診療ガイドラインと同様に,主膵管径10 mm以上の主膵管型「high-risk stigmata」は半数近くが悪性であり,手術適応と考えられた.主膵管径5~9 mmのworrisome featuresも悪性の割合が37.5%と高く,特に壁在結節を認めるものは手術適応と考えられた.
一方,主膵管径5 mm以下では壁在結節の有無が切除の目安となる.壁在結節高は悪性の頻度と相関があり,特に8 mm以上では切除の積極的な適応と考えられる.一方,アルゴリズムで示されている囊胞径は,今回の検討では悪性度との間に有意な相関関係は認めなかった.
「微小浸潤癌」の定義については膵癌取扱い規約第6版補訂版では,「微小浸潤癌(minimally invasive)は膵管壁をわずかに越える浸潤」と定義されているが,同時に「微小浸潤をどの程度まで浸潤とするかについて定見はなく,膵管壁からの浸潤距離(mm)を記載することが勧められる」と注釈されている3).
非浸潤性IPMNおよび微小浸潤癌と浸潤性IPMCの区別が重要となるのは,微小浸潤癌は非浸潤癌と変わらず切除後の予後は良好であるという点である.
これまでの報告された微小浸潤癌の切除成績では,微小浸潤癌の5年生存率は79~88.9%と,IPMC由来浸潤癌の5年生存率24~38%と比べて予後良好であった14)~22).また,2007年に日本膵臓学会が行った調査では,IPMN由来浸潤癌の5年生存率は37.6%であるのに対し,IPMN非浸潤癌は84.2%と良好で,IPMN微小浸潤癌は73.2%とやや低い傾向にあるものの,統計学的優位差はなく非浸潤癌と同様に良好である23).
「微小浸潤癌」は報告者によってさまざまな定義がなされているので,このような非特異的な用語は使用しない方が望ましい.新ガイドラインは,代わりに,AJCC/TMNを含む従来の分類を浸潤癌に使用する方が適切で,そのうえにT1(≤2 cm)に亜分類を作ってT1a(≤0.5 cm),T1b(>0.5 cmかつ≤1.0 cm),T1c(>1 cmかつ≤2 cm)に分類する方法を推奨しており24),今回我々もこの分類方法を用いて検討を行った.
自験例の検討では,リンパ節転移は間質浸潤距離10 mm以上のT1c以上で認められ,予後はT1a以下のIPMCで5年生存率100%であり,T1b以上のIPMC(38.5%),通常型膵癌T1(41.6%)と比較しても,有意に予後良好であった.逆にT1b以上のIPMCの予後は,通常型膵癌T2(35.0%)と同程度であった.悪性度の低い早期の病変として,「微小浸潤癌」を区別する場合には,間質浸潤距離5 mm以下(T1a)が一つの基準になると考えられた.
「微小浸潤癌」が早期癌の段階であればリンパ節郭清の省略や機能温存手術など,縮小手術の対象となる可能性がありうる.自験例ではT1a以下に再発,リンパ節転移の症例はみられなかったが,これまでの報告では微小浸潤癌の再発が約8.1%,リンパ節転移が約5.4%報告されており15)~22),安易な縮小手術は治癒切除できる段階で発見されたIPMCの根治性を損なう可能性があり,縮小手術の適応は慎重に行うべきと考えられた(Table 4).
| No | Author | Year | No. of patient | Recurrence (%) | Lymph node metastasis (%) | 5 year survival rate (%) |
|---|---|---|---|---|---|---|
| 1 | Yamao15) | 2000 | 8 | 1 (12.5)*1 | (—) | 8 (100.0)*6 |
| 2 | Doi16) | 2002 | 11 | (—) | 1 (9.1) | (—) |
| 3 | Adsay17) | 2002 | 4 | 1 (25.0)*2 | 1 (25.0) | (—) |
| 4 | Suzuki18) | 2004 | (—) | (—) | (—) | 74 (88.9) |
| 5 | Takahashi19) | 2006 | 3 | 1 (33.0)*3 | 0 (0.0) | (—) |
| 6 | Nakagohri20) | 2007 | 6 | 1 (17.0)*4 | 0 (0.0) | 5 (83.0) |
| 7 | Nara21) | 2008 | 26 | 2 (7.6)*5 | 0 (0.0) | 20 (79.0) |
| 8 | Nakata22) | 2011 | 10 | 0 (0.0) | 2 (20.0) | (—) |
| 9 | Our case | 7 | 0 (0.0) | 0 (0.0) | (—) | |
| Total | 74 | 6 (8.1) | 4 (5.5) |
*1 local recurrence, *2 liver metastasis, *3 peritoneal dissemination, *4 local recurrence/peritoneal dissemination, *5 pancreas, *6 3 year survival rate
今後はIPMNの分類,微小浸潤癌の明確な診断基準を確立し,さらなる症例の蓄積,検討を重ねることが重要である.
利益相反:なし