Abstract
症例は55歳の男性で,腹痛を主訴に救急搬送された.既往歴に心房細動を認めた.腹部造影CTにて回結腸動脈の閉塞,回腸の血流低下と浮腫状の変化を認め,上腸間膜動脈閉塞症と診断した.身体所見,画像所見から腸管の壊死を疑い,緊急診断的腹腔鏡を施行した.腹腔内を観察すると,回腸末端から1 mほどの範囲でやや色調が変化した腸管を認めたが蠕動は良好であったため,腸管壊死には至っていないと判断した.術中血管内治療を施行し,血流改善を認めた.再度腹腔鏡にて腸管の色調に悪化がないことを確認し,手術を終了した.術後経過良好で14日目に退院となった.診断的腹腔鏡と術中血管内治療の併用で開腹手術を回避しえた症例はまれであった.腸管のviabilityが不明な本症に対して血管内治療施行可能な手術室において診断的腹腔鏡を施行することで迅速に治療法の選択と実行が可能となり,腸管壊死を認めなければ開腹手術を回避することができる.
はじめに
近年,上腸間膜動脈(superior mesenteric artery;以下,SMAと略記)閉塞症に対するinterventional radiology(以下,IVRと略記)による治療により経過良好であった症例の報告が認められる1).しかし,閉塞部位や血管解剖の個人差によって腸管壊死に至るまでの時間にばらつきがあり,画像診断のみで手術またはIVRといった治療方針を決定することが難しいことが多い.今回,腸管のviabilityが不明な本症に対して診断的腹腔鏡にて腸管の状態を評価し,手術室に於いてIVRを施行することで開腹手術を回避し,良好な経過であった症例を経験したので報告する.
症例
患者:55歳,男性
主訴:腹痛
既往歴:発作性心房細動,てんかん
現病歴: 8時間前より突然の腹痛を発症した.下痢症状もあり,痛みも治まらないことから救急要請し,当院救急外来を受診した.
現症:体温34.8°C,脈拍112回/分,血圧153/105 mmHg.腹部は平坦・軟,全体に強い自発痛を訴えるものの腹膜刺激徴候は認めなかった.
血液検査所見:白血球数11,400/μl,CRP 0.42 mg/dlと炎症反応高値を認めた.AST 27 U/l,LDH 172 U/l,CPK 36 U/lと逸脱酵素の上昇を認めなかった.Lac 2.16 mmol/lと軽度の上昇を認めた.PT-INR 1.01と延長は認めなかった.
血液ガス分析所見(room air):pH 7.488,pCO2 28.3 mmHg,pO2 60.0 mmHg,HCO3−21 mEq/l,BE-2.1であった.
心電図所見:上室性期外収縮を伴う頻脈であり,心房細動は認めなかった.
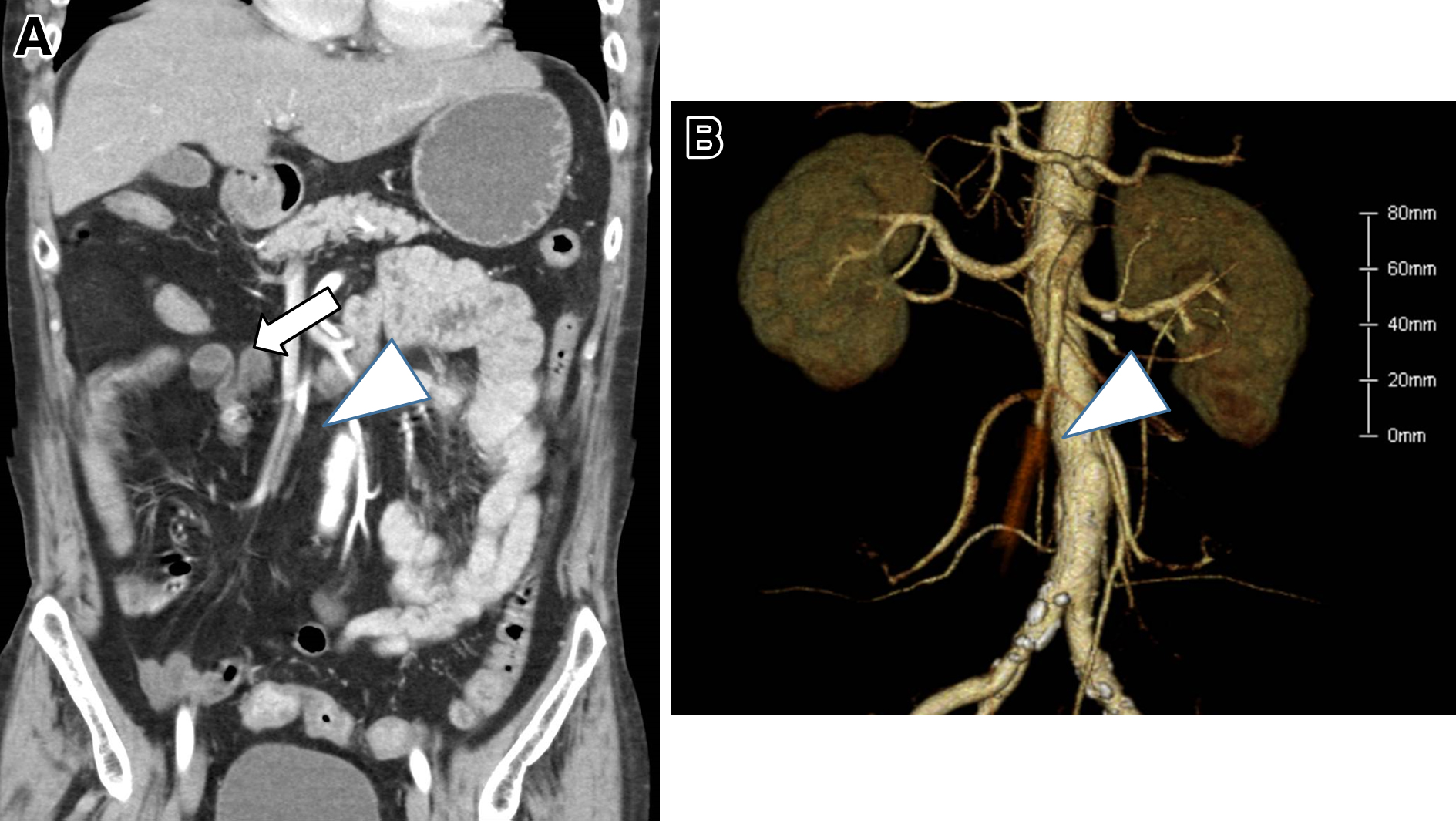
腹部造影CT所見:右結腸動脈は造影され,回結腸動脈分岐直下の領域に造影欠損を認めた.上行結腸は造影効果を認めたが,回腸においては全長約1 mの領域で腸管壁の拡張と造影不良を認めた(Fig. 1).
以上より,SMAの末梢領域における閉塞症と診断した.IVRも検討し,放射線科にコンサルトを行ったが,造影CTにて腸管の造影不良域を認め,虚血性壊死が否定できなかった.そのため,腸管の虚血性壊死の有無の確認のため診断的腹腔鏡を施行する方針とした.壊死を認めなかった場合,迅速なIVR移行も考慮し,IVR施行可能な手術室を選択した.
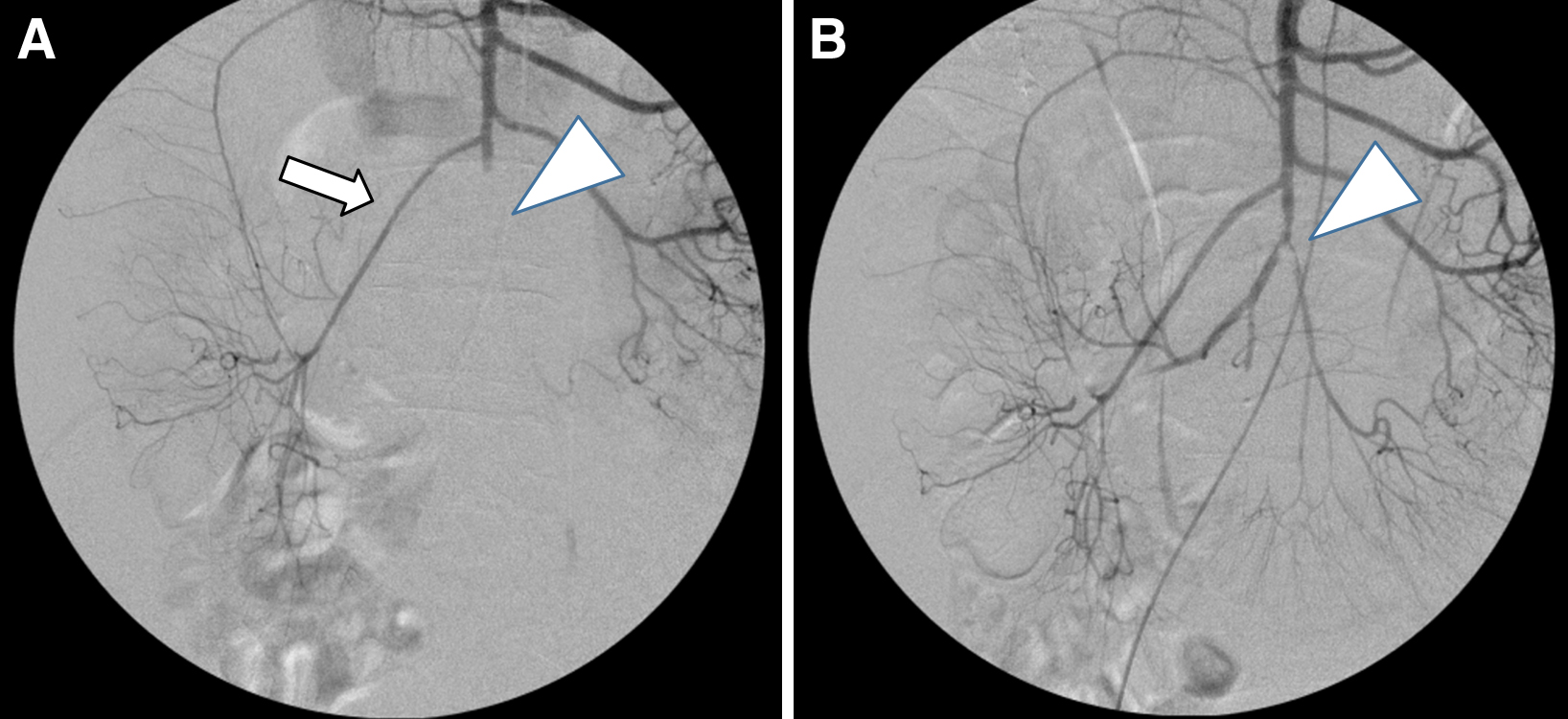
手術および術中IVR所見:臍部に12 mmトラカール,右側腹部,左下腹部に5 mmトラカールを挿入し,3孔式で手術を開始した.腸管を入念に観察したところ,CTにて腸管虚血が疑われた部位において,やや色調が暗く変化した腸管を認めた.粘膜側の虚血性変化によるものと考えられた.しかし,回腸の漿膜側の色調に悪化はなく,蠕動運動も確認できた.腸管切除は不要であると判断し創を仮閉鎖し,同一手術室にて術中IVRに移行した.右大腿動脈より穿刺にて6Frロングシースを挿入し,6FrガイディングカテーテルにてSMAを選択した.造影にてCT所見と一致して回結腸動脈の分岐直後に閉塞を認め,末梢回腸の限局的造影欠損が見られた.さらに,4Frカテーテルを血栓内に進め,ウロキナーゼを合計30万単位動注し,さらに血栓破砕・吸引も施行した.その結果閉塞部は大部分が再開通し,回腸の造影効果も改善した(Fig. 2).再度のIVRに備えてカテーテルは留置したままとした.仮閉鎖創を再開創し,腹腔鏡にて観察した(Fig. 3).腸管は色調,蠕動ともに良好であったため,閉創し,手術を終了した.
術後経過:術後1日目に造影CTでは腸管壁肥厚所見は認めるものの血管は開存しており,造影効果も認めたことからカテーテルを抜去した.腸管の狭窄症状がないことを確認した後,術後9日目に経口摂取開始した.術後はヘパリン12,000単位で抗凝固療法を9日間施行し,ワルファリンカリウム3 mgの内服開始に合わせて減量し,11日目に終了した.術後12日目に単純CTを施行した.腸管壁の肥厚も改善傾向であり術後14日目に退院となった.
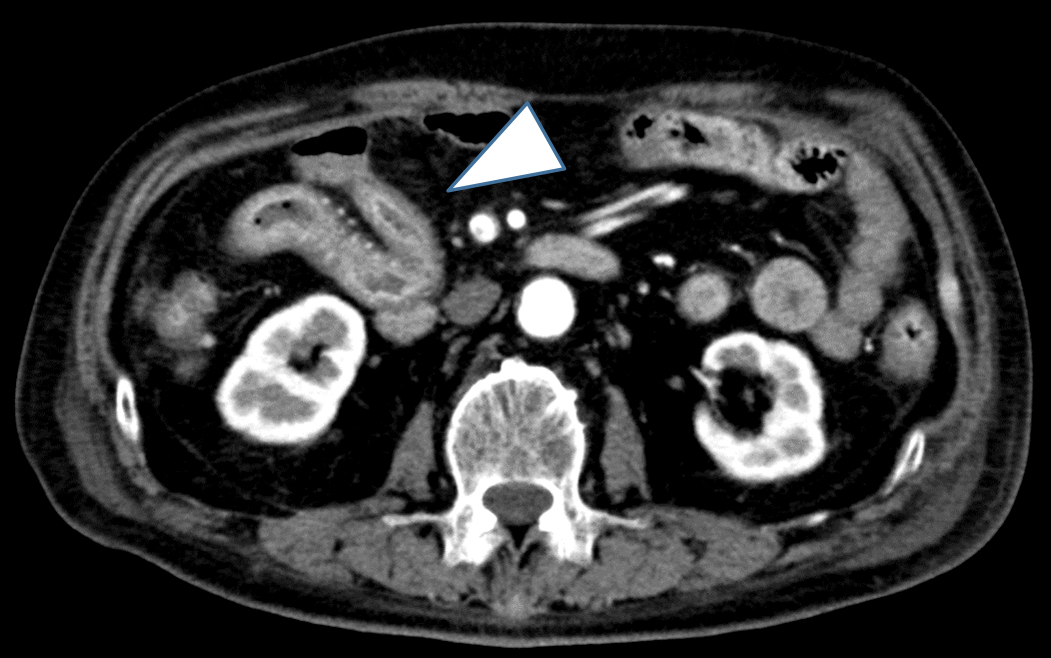
術後5か月で造影CT施行も含めたフォローアップを行ったが,小腸の限局性壁肥厚を認めるもののSMA閉塞症の再発や小腸狭窄症状は認めなかった(Fig. 4).
考察
SMA閉塞症は急性腹症の0.1~1%2)と比較的まれではあるが,診断に難渋することも多く本邦の報告では死亡率が約30%にも達する重篤な疾患である3)4).70歳以上の高齢や心房細動がリスクファクターとされている3).腸管が壊死に至っていた場合,手術による腸管切除が必要となるが,近年では腸管壊死に至っていない症例にIVRを施行した症例が多数報告されている5)6).治療方針を決定するにあたり,腸管のviabilityの評価が非常に重要である.白血球数やAST,LDH,CPK,CRPなどの採血項目は腸管壊死に至った場合は上昇するが,それ以前の段階での評価に有用とはいいがたい7).また,本症の診断や血管閉塞部位の同定のためには造影CTや腹部血管造影検査が有用とされているが腸管のviabilityの評価は確実ではなく,IVRによる治療後に腸管切除を余儀なくされた症例も報告されている8).
発症からの経過時間に応じて治療方針を決定するべきという考え方もある.Batellierら9)は腸管壊死に至るgolden timeを10~12時間としている.また,茂木ら10)は閉塞部位によりgolden timeを設定しており,A型(高位完全虚血型)は中結腸動脈分岐までの閉塞で5時間以内,B型(中間位不完全虚血)は中結腸動脈分岐から回結腸動脈の閉塞で腸管壊死の症状がない場合は48時間以内,C型(末梢血流不全型)は回結腸動脈分岐より末梢の閉塞は数日~数週間を目安としている.しかし,高橋ら8)によれば発症から2時間以内かつCRP 0.2 mg/dl以下でIVRを推奨しており,報告によってその適応については必ずしも一致していない.血管解剖の違いや閉塞形式,側副血行路の有無などにより腸管壊死に至るまでの時間は症例によって異なっているのが実状と思われる.茂木ら10)の分類に従うと,本症例はC型に分類されるが,症状が非常に強く,造影CTにて造影効果不良も認めたことから,早期に腸管壊死に至った可能性も考えられる.個々の症例に応じて腸管のviabilityの評価をより確実に行うためには従来は試験開腹を行っていた.しかし,近年では絞扼性イレウスなど腸管viability評価が必要な疾患に対する診断的腹腔鏡の有用性が報告されている11).診断的腹腔鏡の施行により大きな開腹創を要することなく腹腔内の観察を行うことができ,より確実に腸管の状態を確認することが可能である.また,近年では大動脈ステントグラフトの普及などによりIVRが可能な手術室も増加傾向にある.そのような手術室を利用して診断的腹腔鏡を行うことで,術前に腸管の壊死が不明な場合であっても迅速にIVRへの移行が可能である(Fig. 5).本症例においても診断的腹腔鏡からIVRに移行し,血栓除去および血流の再開通が可能であった.また,坂本ら1)は血流再開通後の問題点の一つとして血流再開後の虚血腸管の回復程度を知る適切な評価法がないことを挙げている.IVR単独では腸管の観察が不可能であるが,本症例ではIVR施行後に再度腹腔内を観察し,腸管の色調や蠕動の有無を確認することが可能であった.診断的腹腔鏡とIVRの同時施行により,直後の腸管の評価は労せず行うことができると考えられた.本症例では血栓除去が可能であったが,IVRにて血栓除去が不可能であった場合でも迅速に手術操作に戻ることも可能であり,より高い安全性の確保が見込まれる.また,本症に対して必要に応じて術翌日のsecond look operationが推奨されているが12)13),これに関しても腹腔鏡を使用することでより低侵襲に観察可能となると考えられる.

しかし,注意すべき点としてはIVR後に虚血性小腸炎を来し,小腸切除をせざるをえなくなった症例14)やSMA閉塞症の再発による小腸穿孔での死亡例15)も報告されている.診断的腹腔鏡による観察は試験開腹と比較し,拡大視効果はあるものの触覚を欠くという点もある.そのため,術後の狭窄性小腸炎には十分な注意が必要と思われる.佐田ら16)は本邦における虚血性小腸炎140例の検討を行っており,発症から手術までの日数は平均59.4±56.6日と報告しており,退院後も十分な期間のフォローアップが必要と考えられた.本症例では術後4か月のフォローアップを行ったが,小腸の限局的肥厚を認めるものの,狭窄症状は認めなかった.虚血性小腸狭窄に対してダブルバルーン小腸内視鏡にて診断しバルーン拡張を行うことで手術を回避しえた症例も報告されている17).
我々が医学中央雑誌にて「上腸間膜動脈閉塞症」,「腹腔鏡」をキーワードに1977年から2016年1月の論文報告を検索しえた範囲内(会議録を除く)では本症に対して診断的腹腔鏡とIVRを施行した症例は認めなかった.本症に対してIVR可能な手術室において診断的腹腔鏡を施行することで,不要な開腹を避け,より正確な診断を行うことで,迅速な治療の選択と実行が可能であると考えられた.
利益相反:なし