2016 年 49 巻 9 号 p. 882-888
2016 年 49 巻 9 号 p. 882-888
症例は34歳の女性で,嘔気と腹痛を主訴に近医を受診した.CTで肝右葉を主座とする長径20 cmの腫瘤を認め,肝血管腫の診断で当科を紹介受診した.手術待機期間中に腹痛が増悪し,緊急入院となった.術前精査で肝前区域~内側区に23×15 cmの肝血管腫を認め,右肝静脈と中肝静脈は圧排され,肝右3区域にうっ血に伴う側副血行路を認めた.左肝静脈と門脈臍部は開存していた.肝右3区域切除でCT volumetryによる有効肝切除率は80%と算出されたが,Tc-99m-labeled galactosyl human serum albumin single photon emission CT/CT(99mTc-GSA SPECT/CT)fusion imageで算出した機能的肝切除率は39.2%であり,十分な残肝能を予測できたため,肝右3区域切除術を施行した.術後経過は良好で,術後14日目に退院した.
肝血管腫は最も頻度の高い肝良性腫瘍であり,直径が5 cm以上のものが巨大肝血管腫とされている1)2).一般的に多くの肝血管腫は無症状であるが,自然破裂・Kasabach-Merritt症候群・腹痛などの臨床症状を来した場合に手術適応となる3).
今回,巨大肝血管腫の肝切除にあたり,肝右3区域切除における有効肝切除率(effective resection of ratio;以下,ERRと略記)が80.0%と,ICG R15が15%以下かつERRが60%以下とする当科の葉切除以上における一期的な切除基準4)を満たさなかったが,術前のTc-99m-labeled galactosyl human serum albumin single photon emission CT/CT(以下,99mTc-GSA SPECT/CTと略記)fusion imageによる機能的肝切除率(functional resection of ratio;以下,FRRと略記)の検討の結果,切除可能と判断し,良好な結果を得た1例を経験したため,報告する.
患者:34歳,女性
主訴:嘔気,腹痛
既往歴:特記事項なし.
現病歴:嘔気,腹痛を主訴に近医を受診した.CTで肝右葉を主座とする長径20 cm大の腫瘤を認め,肝血管腫の診断で当科紹介となった.手術待機中に腹痛の増悪を認め,緊急入院となった.
入院時現症:身長157.5 cm,体重49.1 kg.呼吸循環動態は安定しており,発熱は認めなかった.眼球結膜に黄染なし.
入院時血液検査所見:WBC 4,100/mm3,Hb 8.1 g/dl,Ht 24.1%,Plt 13.4×104/mm3,T-bil 2.6 mg/dl,AST 33 IU/l,ALT 38 IU/l,LDH 120 IU/l,γ-GTP 314 IU/l,ALP 913 IU/l,BUN 10 mg/dl,Cr 0.67 mg/dl,PT 77.8%,FDP 48.1 μg/ml,D-dimer 22.3 μg/mlと貧血と胆道系酵素の上昇および線溶系の亢進を認め,腫瘍内出血が懸念された.血清電解質異常は認めなかった.
肝予備能所見:ICGR15 9.1%・Child-Pugh 6点A・Liver damage Aと肝予備能の低下は認めなかった.
画像所見:肝前区域~内側区域に23×13 cm大の境界明瞭な腫瘤性病変を認めた.造影早期相で辺縁に結節状の濃染域を認め,後期相で遷延する造影効果を伴っており,肝血管腫として矛盾しない所見であった(Fig. 1).右肝静脈と中肝静脈は腫瘍の圧排に伴い,狭窄していたが,左肝静脈は開存していた(Fig. 2).肝右3区域にはうっ血に伴う側副血行路が発達し,左肝静脈への流入が認められた(Fig. 3).門脈臍部(umbilical portion;以下,UPと略記)は腫瘍によって強く圧排されていたが,内腔は開存していた.門脈右枝は腫瘍の圧排により,確認できなかった.
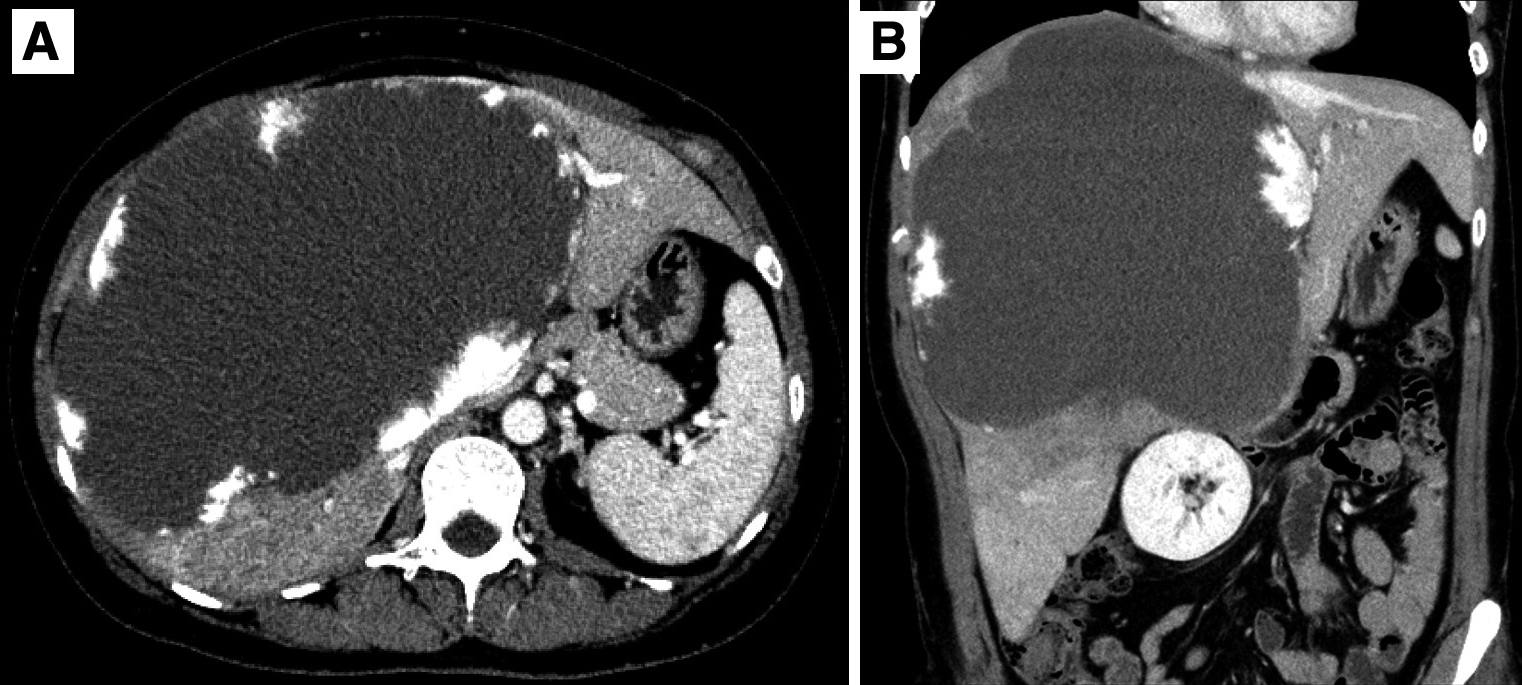
Abdominal enhanced CT. A: the cross-sectional image of a 23×13-cm mass with early phase peripheral nodular enhancements and late phase filling-in malformations in the anterior and medial segment of the liver. B: a coronal reconstruction image.
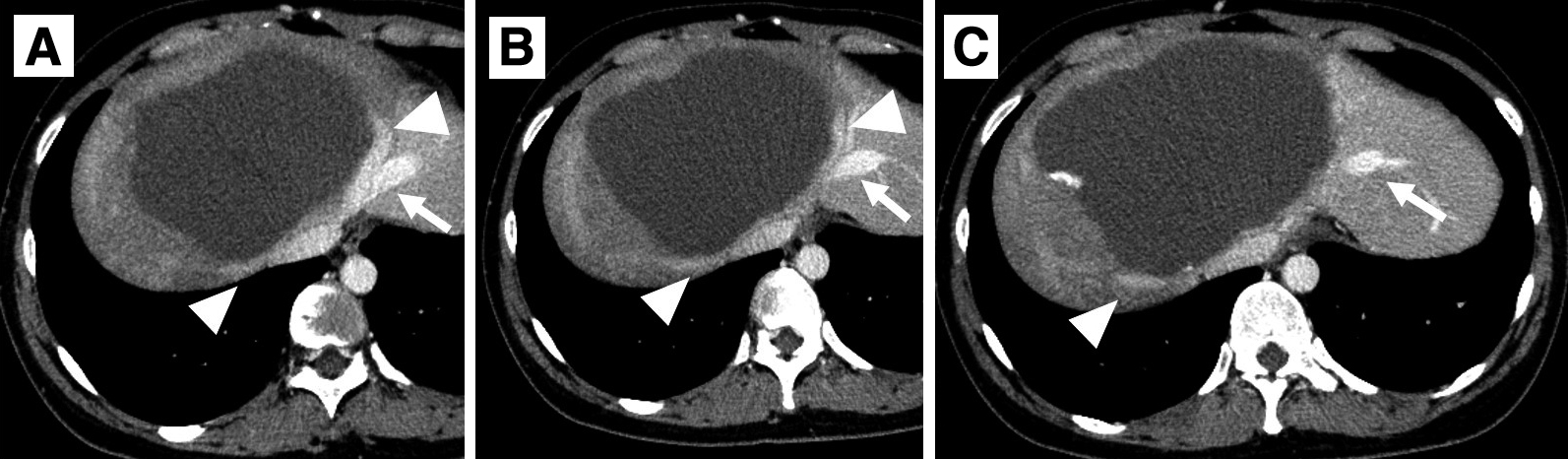
Abdominal enhanced CT. Stenoses of the right and middle hepatic veins (arrowheads) due to tissue mass. Although the left hepatic vein (arrow) is compressed in the dorsal direction, its venous flow is preserved.
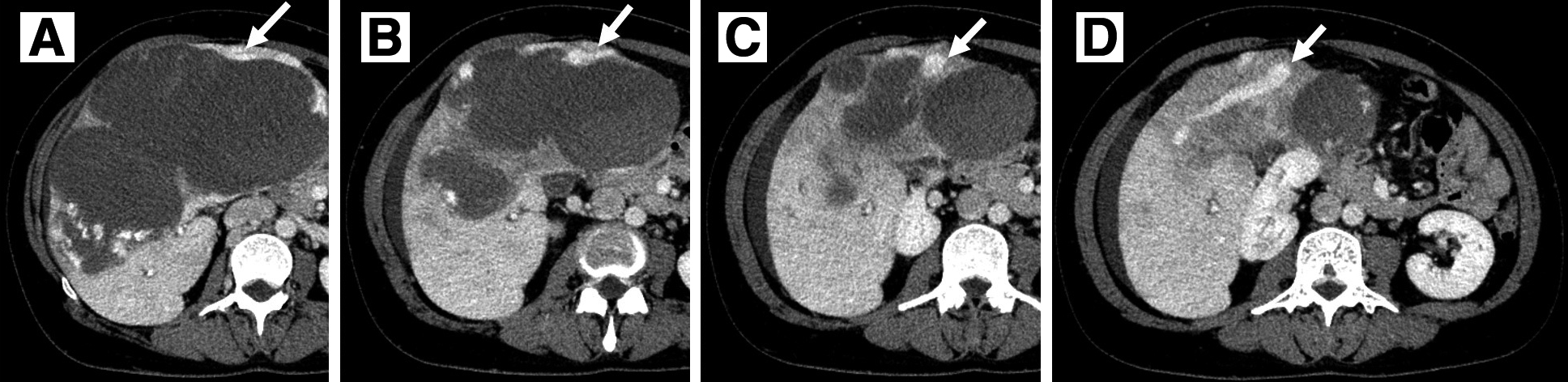
Abdominal enhanced CT. Collateral pathways in the right trisection of the liver as a result of hepatic venous congestion (arrow).
3D-CT volumetry(以下,CTvと略記)では腫瘍を除いた全肝が1,566 ml,腫瘍が2,818 mlであった.ERR=[推定切除肝体積/全肝体積×100(%)]として肝右3区域切除で計算すると,推定切除肝体積=1,253 mlであり,ERR=80.0%であった(Fig. 4A).しかし,腫瘍が全肝の大部分を占めていたため,99mTc-GSA SPECT/CT fusion imageに基づいて99mTc-GSAの肝取り込み値(liver uptake counts)を算出した.FRR=[推定切除肝取り込み値/全肝取り込み値×100(%)]として計算したところ,肝右3区域切除でもFRR=39.2%となり,残存する外側区が全肝機能の60.8%を担っていることが予測された(Fig. 4B).FRRをERRに置き換えて検討すると,当科の切除基準4)を満たしたため,手術の方針となった.
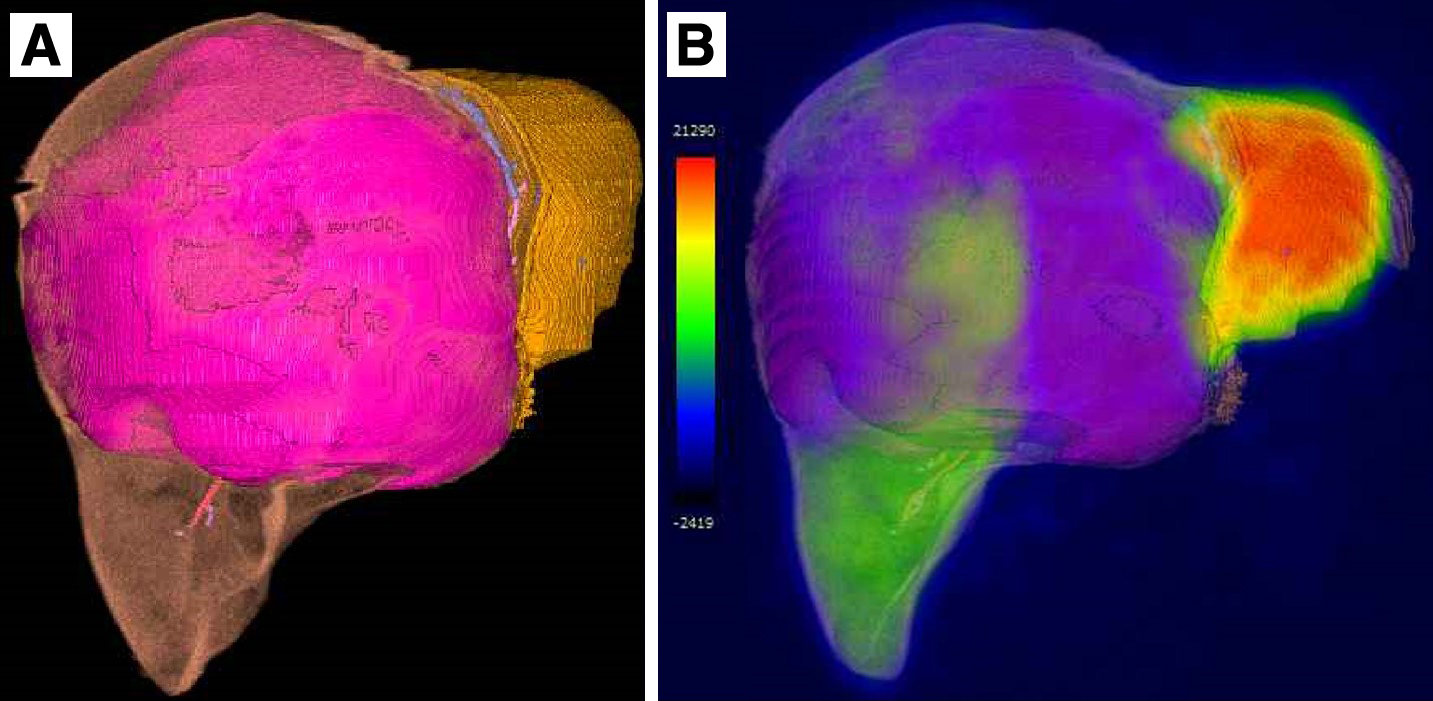
Estimations of hepatic functional reserve after a right trisectionectomy. A: Results of a three-dimensional-CT volumetry estimated the effective resection ratio to be 80.0% (with a remnant liver volume of 313 ml). B: A 99mTc-GSA SPECT/CT fusion image predicted the functional resection ratio to be 39.2% and that the lateral segment would provide 60.8% of the whole liver function.
手術所見:本症例に対し,肝右3区域切除を施行した.開腹すると前区域~内側区を占居する弾性軟,暗赤色の腫瘤を認め,肝外側区は左側へ圧排されていた(Fig. 5A).始めに,肝門部で右肝動脈および門脈を切離し,腫瘍の血流遮断を行い腫瘍径の縮小が得られた後,肝実質の切離へと移った(Fig. 5B).UPから内側区へのグリソンを処理した後,右の胆管を切離した.腫瘍および肝表面の側副血行路からの出血はあったものの,左肝静脈およびUPを温存して肝実質切離を終了した(Fig. 5C).
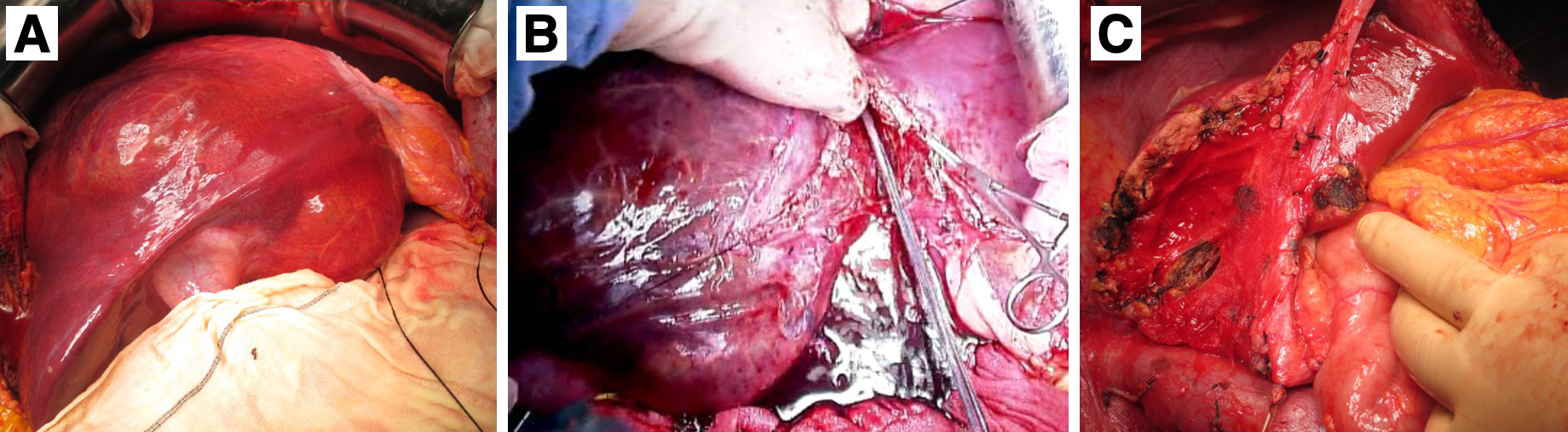
Intra-operative findings. A) The large dark-red tumor occupied the anterior and medial segment of the liver. B) The right hepatic artery and portal vein were divided to reduce the blood flow to the tumor resulting in the shrinkage of the tumor. C) After dissecting the Glisson’s sheath to the medial hepatic segment from the umbilical portion of the left branch of the portal vein (UP), we divided the right hepatic duct. The left hepatic vein and UP could be preserved.
手術時間は5時間22分・出血量は4,825 mlであった.
切除標本所見:割面では最大8.9×8.6 cm大の暗赤色調,海綿状腫瘤性病変を認めた.
病理組織学的検査所見:異型に乏しい内皮細胞に裏打ちされた,互いに吻合する脈管構造が密に増生し,内部に血液を認めた.脈管壁には線維化を認め,cavenous hemangiomaとして矛盾しない所見であった(Fig. 6).
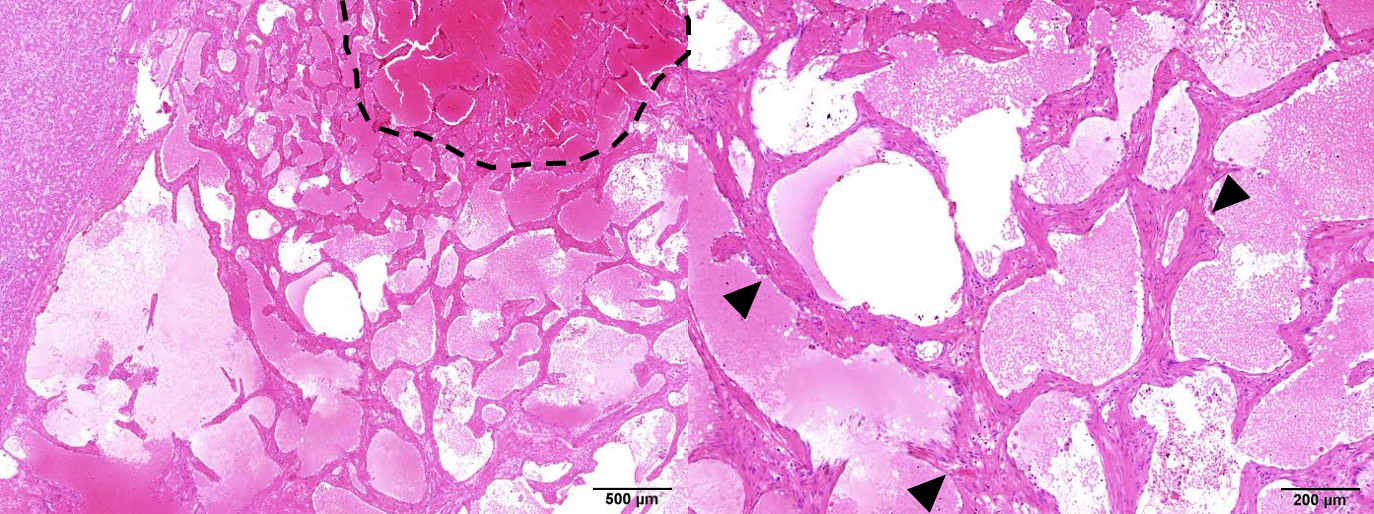
Histology of the tumor. The cavernous vasculature structures, lined by a single endothelial cell layer, increased in number and anastomosed with each other (arrowheads). The vascular compartments are separated by fibrous septae and filled with blood (marked by a dotted line, HE stain).
術後経過:術後1週目のCTでは,明らかな異常所見は認めず,UPの開存は良好であった.CTvでは残肝量は624 mlと増大し,術後肝不全など,明らかな合併症なく,術後14日目に退院した.
肝血管腫は最も頻度の高い肝良性腫瘍であり,直径が5 cm以上のものが巨大肝血管腫とされている.有病率は3~20%とされ,中年女性に好発し,女性発症率は男性の5~6倍といわれている1)2).
大部分が無症状であり,治療介入と経過観察は必要ないが,自然破裂・Kasabach-Merritt症候群・腹痛などの臨床症状を来した場合に手術適応となるとされている3).吉本ら5)は手術の絶対的適応として①腫瘍破裂例,②Kasabach-Merritt症候群合併例があり,相対適応として①腹痛や腫瘍に伴う圧迫症状を来したもの,②5 cm以上,③外傷性破裂の危険性,④悪性との鑑別が困難な症例が挙げられると報告している.Schnelldorferら6)の報告によると,289人の巨大肝血管腫の症例を非手術群(n=233人)と手術群(n=56人)に分けてretrospectiveに調査した結果,非手術群において破裂・出血などで治療介入が必要となった患者は2%であり,10 cm以上の極めて巨大な肝血管腫であっても,合併症の発生頻度と明らかな関係は認めなかった.そのため,巨大肝血管腫であっても自覚症状がなければ十分に経過観察が可能であり,予防的腫瘍摘出は推奨されないとしている.本症例では,急激な腹痛増悪と貧血・凝固異常の進行を認めており,手術適応としては妥当と考える.
その他,巨大肝血管腫に対する治療法としてはTAEが挙げられ,腫瘍径の縮小を得た報告もなされている7)が,その効果は一時的であり,凝固異常の再燃と栄養動脈の再開通が起こるとされている8)9).また,TAE後では処置後の炎症に伴い,周囲組織の癒着が問題となることがしばしば経験される.本症例ではUPと腫瘍が広範囲に渡って接しており,UPを温存できなくなる可能性を考慮して術前のTAEは施行しなかった.
巨大肝血管腫の肝切除では大量肝切除が必要となることが多く,術前の残肝機能評価が重要と考えられる.肝機能正常例では,残肝率の限界は25~30%と報告されており10)11),本症例では肝右3区域切除における残肝率が20%であり術後肝不全のリスクが高いと考えられた.しかし,CTvは肝臓の定量的な評価には優れているが,正常肝細胞と障害肝細胞を区別して評価することができない.そのため,全ての肝細胞が同一の機能を有していると仮定した場合にのみ,機能的な評価が可能である12).しかし,実際には本症例のような巨大肝腫瘍の場合,① 圧排による直接的な肝細胞への障害,② 胆管狭窄(閉塞)による胆汁うっ滞,③ 門脈狭窄(閉塞)による門脈血流の減少に伴い,肝機能の低下が生じる13).Akakiら14)は,肝左葉あるいは右葉切除が必要な肝腫瘍を片側の門脈狭窄(閉塞)の有無で分け,ERRと99mTc-GSA SPECT/CT を用いて算出したFRRを比較している.この報告では,片側の門脈狭窄(閉塞)を有する群で有意にERRが大きく,FRRとの乖離を認めた.これは門脈血流の低下に伴って機能の低下した肝細胞も切除肝体積として評価されてしまうため,ERRは過大評価されたことが原因であるとしている.以上のように巨大肝腫瘍では,CTvのみでは正確な残肝機能の評価は困難であり,残肝の機能的な評価が必要であると考えられる.
このような症例に対して我々は99mTc-GSA SPECT/CT fusion imageに基づいて,99mTc-GSAの肝取り込み値(liver uptake counts)を算出し,これをFRR=推定切除肝取り込み値/全肝取り込み値として計算している.99mTc-GSAシンチグラフィは肝細胞膜上に存在するアシアロ糖蛋白レセプターが肝細胞障害の程度に応じて減少することを利用した肝機能の評価法である.急性および慢性の肝障害においても従来の肝機能検査と相関し,またシャントや黄疸の影響を受けないことから残肝の機能的な評価が可能とされている15).本症例では肝右3区域切除におけるFRRが39.2%となり,ERR≒FRRとして当科の切除アルゴリズム4)に当てはめ,手術適応とした.
International Study Group of Liver Surgery(以下,ISGLSと略記)は術後肝不全を「術後5日目以降の総ビリルビン上昇・プロトロンビン時間延長」と定義し,Grade A(術後管理に影響なし),Grade B(通常の術後経過とは異なるが侵襲的治療は不要),Grade C(侵襲的治療が必要)と分類している16).本症例ではISGLSによる術後肝不全の定義に従っても術後肝不全は認めず,経過良好で術後14日目に退院した.
本症例から,CTvでERRが切除基準を超える症例であっても,99mTc-GSA SPECT/CT fusion imageで残肝能が保たれていれば,安全に切除可能であることが示唆された.現在,99mTc-GSA SPECT/CT fusion imageを用いた術前評価の報告は散見される12)13)が,FRRを用いた明確な肝切除基準はなく,肝切除におけるFRRの上限は不明である.
巨大肝血管腫では大量肝切除が必要となることが多く,従来のCTvを用いた評価では手術適応から外れる症例がある.このような症例において99mTc-GSA SPECT/CT fusion imageによる術前評価を行うことで術後の残肝能を正確に予測でき,切除可能な症例をサルベージできる可能性がある.今回は,ERR≒FRRとして当科の肝切除基準4)を適応したが,今後,FRRを用いた肝切除アルゴリズムの構築が必要であると考える.
利益相反:なし