2018 年 51 巻 10 号 p. 640-648
2018 年 51 巻 10 号 p. 640-648
小腸腫瘍は早期の発見が困難で,腸閉塞や出血,穿孔性腹膜炎を契機に診断されることがあるが,遊離腹腔への穿孔を伴わない腸瘻,膿瘍の状態で診断されることはまれである.症例は78歳の男性で,2週間前からの腹痛を主訴に当院を受診した.腹部CTで腹腔内に内部に気泡を含み水平面を形成する約10 cm径の不整形腫瘤を認め入院精査とした.消化管造影で複数か所の小腸とこの膿瘍腔への造影剤の交通を認め,膿瘍を介した小腸-小腸瘻と診断した.瘻孔の治療および腫瘍の確定診断の目的で手術を行った.膿瘍壁は小腸,結腸の腸間膜に広く癒着しており,内腔には2か所の小腸が開口していた.2か所の小腸切除術を行ったが膿瘍壁の全摘出は断念した.病理組織学的検査で腸管症型T細胞リンパ腫と診断し,化学療法を行ったが術後250日で死亡した.瘻孔を形成した悪性リンパ腫について検討し,同様の病態を呈しうる小腸gastrointestinal stromal tumor(GIST)の瘻孔形成症例と比較した.
小腸腫瘍は全消化管腫瘍の3~6%とされ1)~3),検査が一般化していないこともあって,症状が出現してから診断されることが多い.症状としては腹痛,嘔気などの通過障害に起因するものや,下血や貧血などの出血によるものが知られている.腫瘍の破裂やこれに伴う腸穿孔からの急性腹膜炎を契機として診断された報告も散見されるが,腫瘍の内腔から腸瘻を形成した報告はまれである.
今回,我々は2か所の小腸が腫瘍と瘻孔を形成した腸管症型T細胞リンパ腫(enteropathy-associated T-cell lymphoma;以下,EATLと略記)の症例を経験した.
患者:78歳,男性
主訴:腹痛,下痢,嘔気
既往歴:特記事項なし.
現病歴:2週間前から症状が出現し,近医を受診して内服薬を処方されたが,症状が増悪したため当院に救急搬送された.
来院時現症:身長165 cm,体重53 kg,体温35.4°C,血圧125/83 mmHg,脈拍数83回/分.腹部は軽度膨満を認め,左腹部に圧痛を認めた.
血液検査所見:白血球数11,700/μl,CRP 5.51 mg/dl,Hb 12.2 g/dlと炎症反応高値と軽度の貧血を認めた.
腹部造影CT所見:左腹部に,内部に気泡を含み水平面を形成する約10 cm径の不整形腫瘤を認めた.膿瘍壁は腸管壁と同程度の造影効果を伴っていた.上部空腸との連続性が疑われ,またほかの小腸とも近接していた.腹水や腹腔内遊離ガスは認めなかった(Fig. 1a, b).

Abdominal enhanced CT scan shows that the irregularly shaped mass formed an air-fluid level (a, arrows) and invaded the upper jejunum (b, arrows).
空腸の穿孔による膿瘍形成と診断し入院して精査,加療を行った.
イレウス管造影検査所見:鼻孔から約130 cmでチューブ先端が膿瘍内に到達した.ここから造影すると,肛門側の腸管への流出が見られた(Fig. 2a).

(a) Radiographic study in the small intestine shows a large cavitary lesion through an ileus tube (arrows) and connecting distal intestine (arrowheads). (b) Enema examination shows an outflow of contrast medium from the terminal ileum and reveals the same cavity which is contrasted through the ileus tube (arrows).
注腸造影検査所見:回腸末端から腸管外への造影剤の漏出が見られ,この腔は上部空腸と交通する膿瘍腔と同一であった(Fig. 2b).
胸部CT所見:両肺に淡い結節影を多数認め,炎症性変化もしくは転移性腫瘍が疑われた.
以上より,膿瘍腔や小腸と瘻孔を形成していることなどから,悪性リンパ腫,gastrointestinal stromal tumor(以下,GISTと略記),原発性小腸癌などの腫瘍性病変または異物による穿孔などを念頭に,治療および確定診断を行う目的で,第12病日に手術を行った.
手術所見:広範囲の腸管と間膜を巻き込んで癒着した腫瘤を認めた.膿瘍腔を開放して剥離すると,トライツ靭帯から40 cm,バウヒン弁から10 cmの2か所の小腸がこの腔に開口していた.膿瘍は横行結腸~下行結腸と小腸に囲まれており,膿瘍壁はこれらの腸管および腸間膜と広範囲で一体化していた(Fig. 3).瘻孔を形成していた小腸2か所は切除吻合したが,膿瘍壁の完全切除は不可能と判断した(Fig. 4).
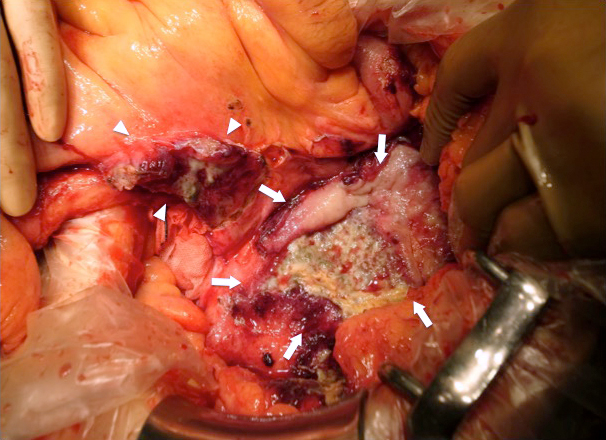
Intraoperative finding shows widespread invasion of tumor into the mesentery of the small intestine (arrowheads) and the colon (arrows).

Macroscopic appearance of the resected specimen. The tumor has fistulas with the jejunum 40 cm from Treitz’s ligament and the ileum 10 cm from the Bauhin valve.
病理組織学的検査所見:腸管壁の全層に中型から大型の類円形細胞のびまん性増殖を認めた(Fig. 5a, b).免疫染色検査ではCD20が陰性,CD3,CD56が陽性であり,腸管症型T細胞リンパ腫(EATL)と診断した.

(a) Histological findings on HE stain (×25). Tumor cells are seen invading all layers of the small intestine. (b) HE stain (×200). Atypical medium-sized or large-sized lymphocytes found to be diffusely proliferated within the tumor.
術後は遺残した腫瘍からの分泌が続きドレナージを継続した.術後25日目よりCHOP療法(cyclophosphamide,doxorubicin,vincristine,prednisolone)を開始した.1コース終了後,腫瘍増大を認めprogressive diseaseと判断し,術後46日目よりGDP療法(gemcitabine,dexamethasone,carboplatin)に変更した.2コース施行後腫瘍縮小を認め,ドレーン抜去が可能となり術後106日目に退院したが,術後148日目に横行結腸浸潤による血便が出現し,術後172日目に再入院となった.DeVIC療法(dexamethasone,etoposide,ifosfamide,carboplatin)に変更したが,その後脳転移を認め全身状態が悪化し,術後250日目に原病死した.
小腸腫瘍は全消化管腫瘍の3~6%であり,悪性腫瘍に限ると全消化管の1~2%を占めるにすぎない1)~3).原発性悪性小腸腫瘍の内訳は,欧米では小腸癌とカルチノイドが多数を占めるが,我が国では小腸癌,GIST,悪性リンパ腫が約1/3ずつでありカルチノイドは少ない4)5).近年ではカプセル内視鏡やダブルバルーン内視鏡の普及によって術前に診断される症例が増加しているものの,検診で行われる検査ではなく早期発見はいまだ困難な状況である.症状が出現してから診断されることが多く,初発症状としては腹痛や吐き気など通過障害に起因するものや下血や貧血などの腫瘍からの出血による症状,腫瘍の巨大化による腹部腫瘤の自覚などが一般的である.腫瘍の破裂による腹膜炎で発症することもあり緊急手術で対応されるが,遊離腹腔への穿孔を伴わない腫瘍と腸管の瘻孔形成を来す症例はさらにまれである.
本症例はガスを含み厚い壁を持つ腹腔内膿瘍を認め,上部下部消化管造影検査で2か所の小腸との交通が確認された.腸管に瘻孔を形成した小腸原発腫瘍を第一に考え,悪性リンパ腫やGISTを疑っていた.以前我々は中心壊死から腸管と瘻孔を形成したGISTの症例6)を経験しており,本症例の膿瘍はその画像と酷似していた.比較のため同症例の腹部造影CT所見を示す(Fig. 6a, b).内部にair-fluid levelを有する12 cm大の肥厚した膿瘍壁を有する不整径腫瘤を認め,小腸と広く接していた.腹腔内膿瘍として保存的治療ののち待機的に手術を行うと,空腸と一塊となった腫瘍性病変を認め,これを含め小腸部分切除を行った.壊死した腫瘍内腔と空腸とが瘻孔を介し交通していた.病理組織学的検査でGISTの診断で,腫瘍内の中心壊死により小腸と瘻孔を形成していたものと考えられた.本症例はこれとCT所見上酷似していたが,病理組織学的検査で腸管症型T細胞リンパ腫との診断であった.そこで,腸管内腔と瘻孔を形成する疾患について過去の報告例を集計した.

Abdominal enhanced CT scan of reference No. 6, a case of gastrointestinal stromal tumor of the small intestine demonstrating fistula formation with the small intestine (a). This tumor is broadly close to the small intestine (b, arrow). These images appear to be remarkably similar to Fig. 1.
医学中央雑誌で「小腸」,「瘻孔」をキーワードとして1964~2017年の期間で検索したところ,大腸癌・直腸癌,クローン病,憩室炎が多く,これらで半数近くを占めていた.次に悪性リンパ腫,GIST,小腸癌,デスモイド腫瘍,平滑筋肉腫,神経内分泌癌,卵巣癌,卵巣類皮囊腫,膀胱癌,炎症性偽腫瘍(inflammatory pseudotumor),悪性神経鞘腫,腸結核,腸管ベーチェット病などの報告が見られた.その中で,大腸癌・直腸癌,十二指腸原発例,遊離腹腔への穿孔例を除外し,本症例のように腫瘤を形成し,かつ小腸と瘻孔を形成していたものは,悪性リンパ腫7)~14),GIST6)15)~21)ともに8例あり,その他,デスモイド腫瘍22),神経内分泌癌23),卵巣類皮囊腫24),悪性神経鞘腫25)が1例ずつであった.そこで本症例を加えて悪性リンパ腫9例,GIST 8例について比較検討した(Table 1, 2).GISTの瘻孔形成は全例が1か所の小腸との間のみであったのに対して,悪性リンパ腫の症例では全例が腫瘍内腔の膿瘍を介して複数か所の腸管,もしくは膀胱と瘻孔を形成していた.GISTは腫瘍の増大に伴って発生母地の腸管粘膜に潰瘍(delle)を形成し,腫瘍の中心が壊死して腸管内腔に自潰することで消化管出血や瘻孔の原因となる.一方悪性リンパ腫では,腫瘍細胞が腸壁全層性にびまん性に浸潤した結果,腸管壁が脆弱化することで穿孔に至る.穿孔に至るまでの期間に浸潤性に発育し他臓器と癒着していると,多方向への瘻孔形成を生じる一因となるのではないかと推察される.両疾患ともに全例で手術が行われており,腫瘍の遺残について明言されている報告は本症例のみであった.長期予後の記載があるものは少ないが,GISTでは再発が確認された症例はなく,悪性リンパ腫では記載のある7例のうち4例は短期間で死亡していた.
| No | Author/Year | Age | Sex | Location | Fistulae | Surgical procedure | Histology | Chemotherapy | Outcome |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Jimi7)/ 2003 |
64 | M | Terminal ileum | Terminal ileum-tumor, tumor-ascending colon | Right hemicolectomy | T-cell lymphoma | CHOP | 32 months, alive |
| 2 | Kato8)/ 2004 |
73 | M | Terminal ileum | Ileum-tumor, tumor-bladder | Partial ilectomy, partial cystectomy | DLBCL | CHOP | 8 months, alive |
| 3 | Murata9)/ 2007 |
49 | F | Jejunum | Jejunum-tumor, tumor-jejunum | Partial jejunectomy, total hysterectomy, partial cystectomy | DLBCL | R-CHOP | 8 months, alive |
| 4 | Kobayashi10)/ 2009 |
77 | M | Terminal ileum | Ileum-tumor, tumor-sigmoid colon | Right hemicolectomy, sigmoidectomy, partial ureterectomy | DLBCL | R-THP-COP | 15 months, dead |
| 5 | Takeshima11)/ 2009 |
62 | M | Terminal ileum | Jejunum-tumor, tumor-ileum | Partial jejunectomy, partial ilectomy, partial sigmoidectomy | EATL | CHOP | 48 months, alive |
| 6 | Shinji12)/ 2012 |
75 | M | Terminal ileum | Ileum-tumor, tumor-bladder | Partial ilectomy, partial cystectomy | DLBCL | THP-COP | 5 months, alive |
| 7 | Onishi13)/ 2013 |
61 | F | Jejunum | Jejunum-tumor, tumor-descending colon | Partial resection of jejunum and descending colon, transverse colostomy | EATL | CHOP | 4 months, dead |
| 8 | Toyooka14)/ 2013 |
80 | M | Ileum | Ileum-tumor, tumor-rectum | Partial ilectomy, sigmoid colostomy | DLBCL | — | 5 months, dead |
| 9 | Our case | 78 | M | Small intestine | Jejunum-tumor, tumor-ileum | Partial jejunectomy, partial ilectomy, partial sigmoidectomy | EATL | CHOP, GDP | 8 months, dead |
DLBCL: diffuse large B-cell lymphoma, EATL: enteropathy-associated T-cell lymphoma, (R-)CHOP: (rituximab) cyclophosphamide, hydroxydaunorubicin, vincristine, prednisolone, (R-)THP-COP: pirarubicin, cyclophosphamide, vincristine, prednisolone, GDP: gemcitabine, dexamethasone, cisplatin
| No | Author | Year | Age | Sex | Location of tumor/fistula | Surgical procedure | Outcome |
|---|---|---|---|---|---|---|---|
| 1 | Nakamura15) | 2000 | 82 | F | Small intestine | Partial resection of small intestine | 14 months, alive |
| 2 | Yada16) | 2004 | 47 | M | Ileum | Partial resection of small intestine | 15 months, alive |
| 3 | Wakita17) | 2005 | 60 | F | Small intestine | Partial resection of small intestine | — |
| 4 | Masaki18) | 2006 | 60 | F | Jejunum | Partial jejunectomy | — |
| 5 | Maeda19) | 2009 | 80 | M | Small intestine | Partial resection of small intestine | — |
| 6 | Inaoka6) | 2013 | 29 | M | Jejunum | Partial jejunectomy | 12 months, alive |
| 7 | Imai20) | 2014 | 62 | M | Jejunum | Partial jejunectomy | — |
| 8 | Takaoka21) | 2014 | 57 | M | Jejunum | Partial jejunectomy | 12 months, alive |
EATLはB細胞リンパ腫と比較して穿孔のリスクが高いことが知られている.今回の瘻孔を形成した悪性リンパ腫の集計では7例中4例がT細胞性であった.小腸悪性リンパ腫の組織型はB細胞性が84%,T細胞性が17%との報告があり26),疾患の頻度と合わせるとT細胞性リンパ腫は瘻孔形成のリスクも高いことがうかがえる.
消化管原発悪性リンパ腫の診断にはDawsonら27)の診断基準が用いられる.診断基準は,①表在リンパ節の腫大がない,②胸部単純X線検査所見で縦隔リンパ節腫大がない,③末梢血の血球検査で白血化がない,④肉眼的に腫瘍が腸管または所属腸間膜リンパ節に限局している,⑤肝臓・脾臓に腫瘍を認めない,の5項目を提唱している.本症例もこれら全てを満たしていた.また,消化管悪性リンパ腫の病期分類にはLugano国際会議で作成された臨床病期分類が用いられる28).本症例では術前より指摘されていた肺病変に対して,肺生検が施行されたが,病理組織学的検査所見からEATLの転移性病変であることがわかり,stage IVであった.2008年のWHO分類ではEATLは形態学的,免疫学的,遺伝学的特徴からI型,II型の二つに分類された29).I型はEATLの80~90%を占め,大型の腫瘍細胞からなり,核の多形性が目立つのを特徴とし,多くはCD8とCD56は陰性となる.また,I型の70%以上がセリアック病を基礎疾患とし欧米人に多い.II型はEATLの10~20%程度で,単形性の中型の腫瘍細胞を特徴とし,多くはCD8とCD56が陽性となり,セリアック病との関連はなく本邦報告例ではほとんどがII型である.臨床的にはI型は吸収不良,体重減少などセリアック病に関連した症状を呈し,II型は腸管穿孔や腸閉塞を来すことが多い30).本症例ではセリアック病の既往がなく,消化管全層にわたる中型から大型の一様なT細胞浸潤を認め,CD56陽性であることからII型EATLと診断した.
治療は瘻孔や穿孔に対しては手術を行い,その後に化学療法を施行することとなる.我々外科医は,悪性リンパ腫は全身病であり術後の化学療法が治療の主体であると認識しがちであるが,小腸悪性リンパ腫の予後因子として組織型,病期などに加えて治癒切除を挙げる報告もある30).可能なかぎり腫瘍の完全切除を目指すべきと考えられるが,瘻孔を形成するほどの進行例では広範囲の臓器に浸潤していることも多い.化学療法に関してEATLでは確立されたレジメンがなく,CHOP療法が選択されることが多いが満足のいく結果は得られていない.本症例でもCHOP療法は無効であり,GDP療法によって一旦は腫瘍の縮小を得たが,短期間で腫瘍は増大に転じ約8か月で死亡した.小腸悪性リンパ腫,特にEATLは予後不良な疾患であり,小腸内視鏡検査による早期発見と有効な化学療法の開発が期待される.
小腸に多発瘻孔を形成した小腸原発腸管症型T細胞リンパ腫の症例を経験した.膿瘍を呈する腫瘍そのものの形態は腸管内腔に自潰したGISTと類似しているが,複数か所の管腔臓器への瘻孔が証明されている場合は悪性リンパ腫の可能性が高いと考えられた.
本論文の要旨は第78回日本臨床外科学会総会(2016年11月,東京)で発表した.
利益相反:なし