Abstract
症例は50歳の女性で,統合失調症で通院加療中であった.右季肋部痛を主訴に近医受診し,腹部腫瘤を指摘され精査目的で当科紹介となった.血液検査では貧血と黄疸を認めた.CT,MRIでは,肝右葉に直径16 cm大の腫瘍を認め,多房性の囊胞成分と淡く造影される隔壁,充実成分と,一部に出血を認めた.また,腫瘍により,門脈本幹,総胆管,下大静脈の圧排を認めた.経過で貧血の進行があり,腫瘍内出血が疑われた.血管造影では,腫瘍内に3か所の血管外漏出像を認め,塞栓術を行った.内視鏡的経鼻胆道ドレナージ(endoscopic nasobiliary drainage;ENBD)を留置し減黄したうえで,右肝切除を施行した.病理組織学的検査所見から,肝未分化肉腫と診断された.術後17か月経過した現在,無再発生存中である.肝未分化肉腫は主に小児に発生する肝原発間葉系悪性腫瘍で,成人に発症する例は極めてまれである.予後不良な疾患であり,その改善には化学療法を含めた集学的治療法の確立が望まれる.
はじめに
肝未分化肉腫は原発性肝悪性腫瘍の中でもまれな間葉系由来の悪性腫瘍で,Stockerら1)によって提唱された.主に小児に発生し成人での発症は極めてまれとされており,本邦では自験例を含めて33例の報告があるのみである2)~31).特異的な症状や検査所見に乏しく,術前診断が困難なことが多い.病理組織像は特定の分化傾向を示さない未分化な肝原発間葉系悪性腫瘍であり,外科的切除が唯一の根治的治療法となる.今回,我々は成人女性に発症した肝未分化肉腫の1例を経験したので,文献的考察とともに報告する.
症例
症例:50歳,女性
主訴:右季肋部痛
既往歴:統合失調症,高血圧,脂質異常症
現病歴:当院受診の約1月前から右季肋部痛,3日前からの発熱を認め近医を受診したところ,CTで肝腫瘍を指摘され,精査加療目的に当院紹介入院となった.
入院時現症:身長155 cm,体重72.6 kg.右上腹部に圧痛を認め,右傍胸骨線上の肋弓下において約6 cm腫瘍を触知した.また,両下腿に浮腫を認めた.
入院時検査所見:血液生化学検査にてHb 7.7 g/dlと貧血,CRP 10 mg/dlと炎症反応の上昇を認めた.AST 153 IU/l,ALT 97 IU/l,ALP 2,465 IU/l,γ-GTP 530 IU/l,T-Bil 3.8 mg/dl,D-Bil 2.5 mg/dl と肝胆道系酵素上昇と黄疸を認めた.腫瘍マーカーは,PIVKA-II 49 mAU/ml,CA19-9 82 U/mlと軽度上昇を認めたが,AFP,CEAは正常値であり,肝炎ウィルスマーカーは全て陰性であった.ICG15分値 36.5%,Child-Pugh分類はC(11点),肝障害度はBであった(Table 1).
Table 1
Laboratory data on admission
| WBC |
4,670/mm3 |
AMY |
34 IU/l |
| RBC |
2.77×104/mm3 |
BUN |
9 mg/dl |
| Hb |
7.7 g/dl |
Cr |
0.57 mg/dl |
| Ht |
25.1% |
UA |
4.3 mg/dl |
| Plt |
873×104/mm3 |
Na |
141 mg/dl |
| CRP |
10.0 mg/dl |
K |
4.1 mg/dl |
| TP |
6.9 g/dl |
Cl |
104 mg/dl |
| Alb |
2.6 g/dl |
Ca |
8.6 mg/dl |
| T-Bil |
3.5 mg/dl |
PT |
65% |
| D-Bil |
2.3 mg/dl |
APTT |
32.4% |
| ALP |
2,418 IU/l |
ICG R15 |
36.5% |
| AST |
173 IU/l |
CEA |
1.1 ng/ml |
| ALT |
101 IU/l |
AFP |
4 ng/ml |
| γGTP |
533 IU/l |
PIVKA-2 |
49 mAU/ml |
| ChE |
169 IU/l |
HBs-Ag |
(−) |
| CPK |
72 IU/l |
HCV-Ab |
(−) |
腹部CT所見:肝右葉に16×14×10 cm大の境界明瞭な低吸収腫瘤を認めた.内部は不均一で造影されない囊胞成分と,漸増性に造影される隔壁,充実成分が混在する像を呈した.また,腫瘤により,門脈本幹,総胆管,下大静脈の圧排を認めたが,浸潤を疑う所見は認められなかった.また,周囲のリンパ節腫大は認めなかった(Fig. 1).
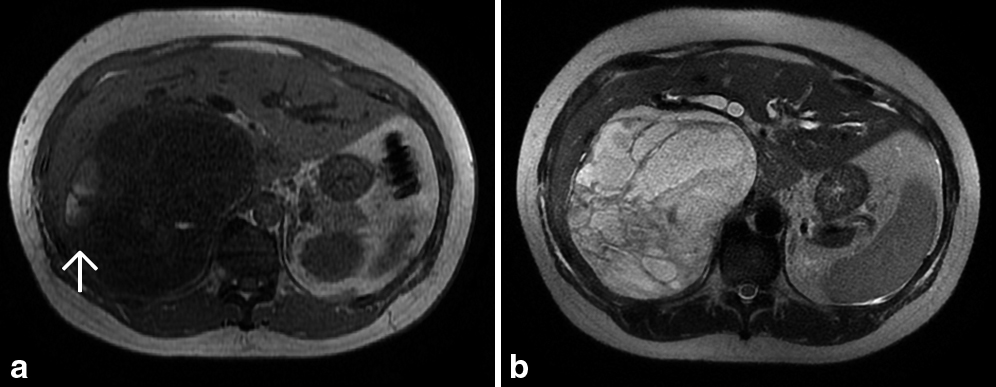
腹部MRI所見:肝右葉にCTと同様の境界明瞭な腫瘤像を認めた.腫瘍内部は囊胞成分と隔壁,充実成分が混在しており,T1強調像で低信号,T2強調像,拡散強調像で高信号を呈していた.また,囊胞成分には内部への出血を示唆する信号変化と液面形成を認めた.EOB造影では造影CTと同様に隔壁,充実成分に漸増性の造影効果を認め,肝細胞相では肝実質と比較して低信号であった(Fig. 2).
腹部血管造影所見:経過で貧血の進行を認め,腫瘍内出血が疑われた.
右肝動脈造影では,腫瘍内に血管外漏出像を認め,ゆっくりと静脈に還流された.同部位をエンボスフィア(100~300 μm)で塞栓した.右下横隔膜動脈造影では腫瘍内に2か所の血管外漏出像を認め,ヘパスフィア(100~150 μm)で塞栓した(Fig. 3).
ERCP所見:右肝動脈の高さで腫瘍により総肝管の圧排を認め,肝内胆管の拡張を認めた.減黄目的に左肝管に内視鏡的経鼻胆道ドレナージチューブ(endoscopic nasobiliary drainage;以下,ENBDと略記)を留置した(Fig. 4).
PET-CT所見:肝臓の腫瘍の充実部と隔壁に一致して,SUV max Early=4,Delay=4.3の集積を認めた.その他には異常集積は認めなかった.
以上の検査所見より,肝囊胞腺癌や肉腫変性した肝細胞癌,肝未分化肉腫などの腫瘍が疑われた.当科入院後,上述のごとく胆道ドレナージにて減黄も得られ,肝予備能の改善が認められ,術前のChild pugh分類はB(8点),肝障害度はBと改善を認めた.一方で,前医受診時から約3週間の待機期間で腫瘍径が15×13×10 cmから18×14.5×11 cmへと急速な増大傾向を認めており,破裂のリスクもあると考え手術を施行した.
手術所見:逆T字切開で開腹したところ,少量の漿液性の腹水を認めたが,細胞診の結果は陰性であった.腫瘍は肝右葉を占居するが肝表面への露出はなく,周囲臓器への浸潤は認めなかった.術中超音波検査にて中肝静脈は温存可能であることを確認し,右肝切除術を施行した.下大静脈は右腹側から強く圧排されており,特に下大静脈靭帯近傍に一部強固な癒着を認め,同部位の処理に難渋し,下大静脈周囲からの出血を認めた.腫瘍の遺残なく切除しえた.手術時間は9時間42分,出血量3,800 mlで,赤血球濃厚液14単位,新鮮凍結血漿12単位を使用した.
摘出標本肉眼所見:切除した腫瘍は19×14.5×11 cmで周囲肝実質との境界は明瞭であった.内部は白色充実部を認める一方,囊胞成分,出血,壊死,凝血塊および粘液様物質の充満する部位を認めた.
病理組織学的検査所見:結合性の乏しい紡錘形細胞が増殖しており,さまざまな程度の核異型を認めた.多核巨細胞や,細胞質内にPeriodic acid Schiff(以下,PASと略記)陽性顆粒状物質を有する細胞が散見された.免疫染色検査では,vimentinは腫瘍全体で陽性,α smooth muscle actin(以下,αSMAと略記),CD10,CD31,desmin,Glypican-3が一部の細胞で陽性であり,α1-antitrypsin,α1-antichymotrypsin,AE1/AE3,AFP,calponin,CAM5.2,CK7,CK19,CD34,EMA,S-100,Hepatocyte,HMB45,Melan-A,myogenin,myoglobinは陰性であった.以上より,肝未分化肉腫と診断した(Fig. 5).
術後経過:術後経過は良好で,術後下大静脈の圧迫が解除され下腿浮腫は改善した.CA19-9は正常化した.胆汁漏(Clavien-Dindo Grade IIIa)を認め,ENBDと術中に留置した肝切離面ドレーンの管理により軽快した.術後56日に自宅退院となった.精神疾患により忍容性が得られないため,本人および家族に説明のうえで術後補助化学療法は行わず経過観察中である.早期の残肝再発や腹膜播種再発を念頭に術後6か月までは2か月ごと,以後は3か月ごとにCTでフォローしているが,現在術後17か月無再発生存中である.今後の経過で再発を来した場合は,切除可能な病変であれば積極的に手術を検討し,切除不能であれば,多剤併用化学療法を含む集学的治療を考慮する.
考察
肝未分化肉腫はStockerら1)によって疾患の概念が提唱された肝原発間葉系悪性腫瘍で,6~10歳の小児に好発し.成人発症はまれと報告されている.医学中央雑誌にて1964年から2017年までの期間で「肝未分化肉腫」,「成人」をキーワードに,PubMedにて1950年から2017年までの期間で「undifferentiated sarcoma」,「liver」,「adult」をキーワードに検索したところ,本邦では本例をあわせて33例の報告を認めるのみであった(Table 2)2)~31).
Table 2
Reported cases of undifferentiated (embryonal) sarcoma of the liver in adults (in Japan)
| No. |
Author |
Year |
Age |
Sex |
Chief complaint |
Size (cm) |
Operation |
Postoperative therapy |
Recurrence (month) |
Recurrent site |
Treatment after recurrence |
Prognosis (month) |
| 1 |
Endo2) |
1983 |
65 |
F |
Abdominal discomfort |
15×12×8 |
Tumor resection |
CT (CPA) |
no |
— |
— |
21 alive |
| 2 |
Tsuru3) |
1986 |
73 |
M |
Abdominal bloating |
10×12 |
Inoperable |
HAI (MMC, 5-FU, ADM) |
— |
— |
— |
8 dead |
| 3 |
Kodama4) |
1986 |
30 |
F |
Abdominal pain and fever |
18×15×15 |
Inoperable |
HAI (MMC, 5-FU, ADM, CPA) |
— |
— |
— |
2 dead |
| 4 |
Murase5) |
1989 |
44 |
F |
Abdominal pain |
12×8 |
Inoperable |
CT (ADM, CDDP) |
— |
— |
|
3 dead |
| 5 |
Kanamaru6) |
1991 |
21 |
F |
Abdominal pain and bloating |
18×15×13 |
Left lateral segmentectomy |
CT (5-FU, DTIC, VDS, ADM, CDDP) |
no |
— |
— |
13 alive |
| 6 |
Okuyama7) |
1992 |
28 |
M |
Abdominal pain and fever |
Unknown |
Tumor resection |
no |
2 |
peritoneum |
no |
6 dead |
| 7 |
Ogasawara8) |
1996 |
73 |
M |
Abdominal pain |
17×15×8 |
Tumor resection |
HAI (CDDP) |
no |
— |
— |
11 alive |
| 8 |
Itoh9) |
2000 |
24 |
M |
Abdominal pain |
15×7 |
Right liver resection |
no |
no |
— |
— |
9 alive |
| 9 |
Tokunaga10) |
2000 |
27 |
M |
Abdominal pain |
9×9×8 |
S5/S6 resection |
CT (IFN, CDDP, ADM) |
no |
— |
|
14 alive |
| 10 |
Suzuki11) |
2003 |
53 |
F |
Abdominal pain |
13×11 |
Left liver resection |
no |
3 |
tumor embolus |
no |
3 dead |
| 11 |
Nisio12) |
2003 |
62 |
M |
Abdominal pain |
10×9×7 |
Left liver resection |
no |
no |
— |
— |
10 alive |
| 12 |
Nisio12) |
2003 |
49 |
F |
Abdominal pain and fatigue |
14×8×8 |
Right liver resection |
no |
18 |
upper arm, liver, bone |
CT (ADM, DTIC), operation, PEIT |
29 dead |
| 13 |
Maeda13) |
2005 |
50 |
F |
Abdominal pain |
6×6×5 |
Right liver resection |
no |
no |
— |
— |
6 alive |
| 14 |
Hirata14) |
2007 |
52 |
F |
Fatigue and dyspnea |
23×21×11 |
Right trisegmentectomy |
no |
no |
— |
— |
9 alive |
| 15 |
Fujibayashi15) |
2007 |
25 |
M |
Abdominal pain |
17×15×12 |
Extended right liver resection |
no |
14 |
liver, peritoneum |
CT (CDDP, ADM, CPA), operation, MCN |
56 dead |
| 16 |
Pachera16) |
2008 |
22 |
F |
Abdominal mass |
19×14×11 |
Right trisegmentectomy |
CT (VCR, ACT-D, CPA) |
no |
— |
— |
14 alive |
| 17 |
Asato17) |
2010 |
53 |
F |
Abdominal pain |
20×14 |
Extended right liver resection |
no |
2 |
liver |
TACE, operation |
5 alive |
| 18 |
Sunose18) |
2011 |
29 |
F |
Abdominal pain and bloating |
18 |
Tumor resection |
no |
3 |
liver, peritoneum |
CT (ADM, IFN) |
12 alive |
| 19 |
Mori19) |
2011 |
21 |
F |
Abdominal pain |
7×7 |
Right posterior segmentectomy |
no |
48 |
liver |
operation |
63 dead |
| 20 |
Ryu20) |
2012 |
73 |
F |
Abdominal pain and bloating |
15×15 |
Right liver resection |
no |
8 |
peritoneum |
operation, RT |
50 alive |
| 21 |
Tanaka21) |
2012 |
51 |
F |
Liver dysfunction |
12×11×7 |
Right anterior segmentectomy |
no |
24 |
liver, lung, thoracic, vertebra |
no |
36 dead |
| 22 |
Noguchi22) |
2012 |
27 |
F |
Abdominal pain and fever |
21×19×14 |
Right trisegmentectomy |
CT (CDDP, VCR, ADM, ACT-D, CPA), RT, PBSCT |
no |
— |
— |
60 alive |
| 23 |
Kitamura23) |
2013 |
60 |
F |
Abdominal pain and fever |
15×12×11 |
Right liver resection |
no |
no |
— |
— |
3 alive |
| 24 |
Hiraki24) |
2013 |
59 |
M |
Abdominal pain |
15×13×11 |
Right trisegmentectomy |
no |
2 |
peritoneum, local, tumor embolus |
CT (DTIC), RT |
7 dead |
| 25 |
Yamada25) |
2014 |
73 |
M |
Abdominal pain |
11×10 |
S3 resection partial gastrectomy |
no |
2 |
local, peritoneum |
no |
3 dead |
| 26 |
Hachiya26) |
2014 |
63 |
F |
Abdominal pain |
7×5.5 |
Extended left liver resection |
no |
no |
— |
— |
72 alive |
| 27 |
Ohta27) |
2015 |
39 |
M |
Abdominal pain |
6.5×6.5×5 |
Left liver resection |
no |
no |
— |
— |
18 alive |
| 28 |
Masuda28) |
2015 |
52 |
F |
Abdominal bloating, dyspnea, edema |
23×22×11 |
Right trisegmentectomy |
no |
19 |
liver |
TACE, operation, RFA |
62 dead |
| 29 |
Masuda28) |
2015 |
53 |
F |
Abdominal pain |
22×19×14 |
Extended left liver resection |
no |
3 |
liver |
TACE, operation, RFA |
65 alive |
| 30 |
Yasuda29) |
2016 |
42 |
F |
Abdominal pain |
10×6 |
Partial resection |
no |
2 |
liver, peritoneum |
CT (ADM, pazopanib) |
3 dead |
| 31 |
Mori30) |
2017 |
65 |
F |
Abdominal pain |
19×17×13 |
Right trisegmentectomy |
no |
19 |
liver |
operation |
26 alive |
| 32 |
Hosokawa31) |
2017 |
70 |
M |
Abdominal pain |
16×14.5×9 |
Right liver resection |
no |
6 |
Unknown |
Unknown |
8 dead |
| 33 |
Our case |
|
50 |
F |
Abdominal pain |
19×14.5×11 |
Right liver resection |
no |
no |
— |
— |
11 alive |
CT: chemotherapy, HAI: hepatic arterial infusion, PEIT: percutaneous ethanol injection therapy, MCN: microwave coagulo-necrotic therapy, TACE: transcatheter arterial chemoembolization, RT: radiation therapy, PBSCT: peripheral blood stem cell transplantation, RFA: radiofrequency ablation, CPA: cyclophosphamide, MMC: mitomycin, 5-FU: fluorouracil, ADM: doxorubicin, CDDP: cisplatin, DTIC: dacarbazine, VDS: vindesine, IFM: ifosfamide, VCR: vincristine, ACT-D: actinomycin D
成人発症肝未分化肉腫の報告例では,平均年齢は48歳(21~73歳),男女比は1:2,主訴は腫瘍の増大に伴うと考えられる腹痛が最も多く,27例(81.8%)に認められた.腫瘍最大径は平均約15 cm(6~23 cm)と大きく,腫瘍が増大してはじめて腹痛,腹部膨満感といった臨床症状を示すことが多いことが報告されている.
画像診断の特徴的な所見としては孤立性の境界明瞭な腫瘍であり,充実成分と囊胞成分を有することが多いとされる.充実成分はCTでは漸増性に濃染され,囊胞成分には出血や腫瘍の急速な増大を反映して,腫瘍壊死や凝血塊,粘液物質を含み,造影されない低吸収域を示す.MRIでは囊胞成分や,myxomatousな腫瘍間質を反映し,T1強調像で低信号,T2強調像で高信号を示すことが多いとされ32),本症例においてもCT,MRIともにこれらの特徴的な所見を示していた.
病理組織学的検査所見としては,①血管,横紋筋,平滑筋,脂肪,神経などの特異的な分化を示す細胞は認めず,未分化な間葉系腫瘍細胞の増殖を呈し,②未熟な小型の星状,紡錘状細胞が錯綜するように配列,③核異型が強く核分裂が目立ち,多角の巨細胞が混在,④ジアスターゼ抵抗性PAS陽性顆粒を有し,⑤腫瘍辺縁部に正常な肝細胞,胆管様構造物がみられ,腫瘍の発育の過程で周囲肝組織を巻き込んでいるentrapment theoryが示唆されることが挙げられている20).免疫染色検査では,vimentin,α1-antitripsinがびまん性に陽性で,cytokeratin,desmin,α-SMA,muscle-specific action,CD68,myoglobin,non-specific enolase,S100,CD34が部分的に陽性となることが多いとされ,これらの所見は未分化な腫瘍における局所的な分化を反映していると報告されている33).
治療は外科的切除が第一選択となる.5年生存率は根治切除実施例で50.7%,非根治的切除実施例で29.8%と報告されている19).報告例33例中の切除不能3例は動注化学療法や全身化学療法を施行されるも奏効せず,術後生存期間は平均4.3か月と,切除不能例の予後は極めて不良であった3)~5).根治切除ができた30症例中16例(53.3%)に再発を認めた.再発までの中央値は10.9か月であり,再発形式としては残肝再発(16例中9例),腹膜播種(16例中7例)が多い.16例中9例が術後6か月以内に再発しており術後早期からの画像検査が必須である.再発後は急速に進行し死亡する例がみられるが11)29)31),再切除,ラジオ波焼灼療法(radiofrequency ablation;RFA),放射線療法,化学療法などによる集学的治療集学的治療を行い長期生存が得られた症例も存在する20)23)26)28).
化学療法はVAC療法(vincristin,actinomycin,cyclophosphamide)などの多剤併用療法,またはcisplatinやadriamycin,ifosfamideなどを単独,あるいは組み合わせで試みられている.少ないながらも奏効例の報告は存在するが18),確立した治療はないのが現状である.Lenzeら34)は15歳以上の肝未分化肉腫における術後補助化学療法施行群と非施行群で再発率がそれぞれ23%(観察期間中央値28か月),42%(観察期間中央値8か月)であったと報告している.本邦報告例においても,術後に補助療法を施行した6例(化学療法5例,肝動注化学療法1例)は観察期間内において再発を認めておらず,有効性が示唆される2)6)8)10)16)23).
本症例の治療経過における特徴として,術前に腫瘍内出血に対して腫瘍動脈塞栓術を施行したことがあげられる.当科ではこれまでも,巨大な腫瘍に対し,術前に栄養動脈の塞栓術を行うことで,安全に手術を施行しえた経験を報告してきた35).術中の出血を抑制することを目的に塞栓術を行うのであれば,側副路の観点から手術直前に行うことが有効である.本疾患では破裂例が33例中3例報告されており,急速な発育速度や柔らかい腫瘍であることに加えて18),腫瘍内出血による内圧上昇も破裂の誘因となると考えられた.本症例においても腫瘍内出血と急速な増大傾向を認めており,破裂のリスクが高い状態と思われ,事前に塞栓術を行うことで十分な術前精査や減黄処置を行うことができ,安全に手術を行うことに有効であった.
成人発症の肝未分化肉腫は予後不良な疾患であり,積極的な術後補助療法の導入や,再発時の集学的治療により予後改善が見込まれる.今後さらなる症例の蓄積と治療の確立が望まれる.
利益相反:なし
文献
- 1) Stocker JT, Ishak KG. Undifferentiated (embryonal) sarcoma of the liver: report of 31 cases. Cancer. 1978 Jul;42(1):336–348.
- 2) 遠藤 秀彦, 奈良坂 重樹, 関口 淳一, 藤沢 秀仁, 八重樫 雄一, 折居 正之,ほか.肝未分化(胎芽性)肉腫の1例.日本臨床外科医学会雑誌.1983;44(11):1314–1318.
- 3) 津留 昭雄, 矢野 真, 松永 章, 篤永 荘司, 中村 秀三, 西田 博之,ほか.原発性肝未分化肉腫の1例.日本臨床外科医学会雑誌.1986;47(5):666–672.
- 4) 児玉 一成, 山下 裕一, 福永 淳治, 岡本 一廣, 林田 啓介, 納富 昌徳,ほか.肝未分化肉腫の1例.日本臨床外科医学会雑誌.1986;47(11):1509–1513.
- 5) 村瀬 邦彦, 梅根 良彦, 村田 育夫, 今西 建夫, 牧山 和也, 原 耕平,ほか.著名な白血球増多をともなった肝未分化肉腫の一例.長崎医学会雑誌.1989;64(1):46–50.
- 6) Kanamaru R, Wakui A, Kambe M, Ouchi K, Kobari M, Matsuno S, et al. Undifferentiated sarcoma of the liver in a 21-year-old woman: case report. Jpn J Clin Oncol. 1991 Jun;21(3):227–232.
- 7) 奥山 隆三, 豊國 伸哉, 岡田 茂, 中嶋 安彬, 山辺 博彦, 韓 秀炫,ほか.肝未分化肉腫の1例.日本臨床細胞学会雑誌.1992;31(1):89–90.
- 8) 小笠原 邦夫, 西井 博, 近藤 肇彦, 青木 克哲, 栗田 信浩, 熊谷 久治郎.成人肝未分化肉腫の1手術症例.臨床外科.1996;51(2):237–240.
- 9) 伊藤 博, 泉 良平, 廣澤 久史, 角谷 直孝, 福島 亘, 村岡 恵一,ほか.成人肝未分化肉腫の1例.日本消化器外科学会雑誌.2000;33(4):487–491.
- 10) Tokunaga Y, Ryo J, Hoppou T, Kitaoka A, Tokuka A, Osumi K, et al. Hepatic undifferentiated (embryonal) sarcoma in an adult: a case report and review of the literature. Eur J Gastroenterol Hepatol. 2000 Nov;12(11):1247–1251.
- 11) 鈴木 裕之, 諏訪 敏一, 山下 純男, 安田 典夫, 尾本 秀之, 石川 文彦,ほか.肺動脈腫瘍塞栓を起こした成人発症肝未分化肉腫の1例.日本臨床外科学会雑誌.2003;64(11):2841–2844.
- 12) Nishio J, Iwasaki H, Sakashita N, Haraoka S, Isayama T, Naito M, et al. Undifferentiated (embryonal) sarcoma of the liver in middle-aged adults: smooth muscle differentiation determined by immunohistochemistry and electron microscopy. Hum Pathol. 2003 Mar;34(3):246–252.
- 13) 前田 真一, 浜之上 雅博, 長山 周一, 迫田 雅彦, 小代 正隆, 栗脇 一三.成人肝未分化肉腫の1例.臨床外科.2005;60(7):921–925.
- 14) 平田 貴文, 別府 透, 石河 隆敏, 杉山 眞一, 高森 啓史, 金光 敬一郎,ほか.下大静脈,肝静脈鬱血を伴う巨大肝未分化肉腫の1切除例.日本消化器外科学会雑誌.2007;40(5):623–628.
- 15) 藤林 真理子, 相羽 元彦, 澤田 達男, 塩澤 俊一, 土屋 玲, 小川 健治.成人発症undifferentiated(embryonal)sarcomaの1例.東京女子医科大学雑誌.2007;77(7):350–357.
- 16) Pachera S, Nishio H, Takahashi Y, Yokoyama Y, Oda K, Ebata Y, et al. Undifferentiated embryonal sarcoma of the liver: case report and literature survey. J Hepatobiliary Pancreat Surg. 2008;15(5):536–544.
- 17) 安里 嗣晴, 本田 由美, 石原 園子, 増田 稔郎, 平島 浩太郎, 別府 透,ほか.成人で発症した肝未分化肉腫の1例.診断病理.2010;27(4):280–284.
- 18) 須納瀬 豊, 平井 圭太郎, 吉成 大介, 戸塚 統, 戸谷 裕之, 竹吉 泉.急性肝破裂に対して緊急肝切除により救命しえた肝未分化肉腫の1例.手術.2011;65(3):381–384.
- 19) 守 正浩, 小林 純, 豊田 康義, 吉田 行男, 伊藤 健治, 永井 雄一郎.若年成人に発症した肝原発未分化肉腫の1例.手術.2011;65(5):625–630.
- 20) 龍 知記, 高見 裕子, 立石 昌樹, 和田 幸之, 才津 秀樹, 桃崎 征也.術後4年以上生存中の成人肝未分化肉腫の1例.日本消化器外科学会雑誌.2012;45(3):273–281.
- 21) Tanaka S, Takasawa A, Fukasawa Y, Hasegawa T, Sawada N. An undifferentiated embryonal sarcoma of the liver containing adipophilin-positive vesicles in an adult with massive sinusoidal invasion. Int J Clin Exp Pathol. 2012;5(8):824–829.
- 22) Noguchi K, Yokoo H, Nakanishi K, Kakisaka T, Tsuruga Y, Kamachi H. A long-term survival case of adult undifferentiated embryonal sarcoma of liver. World J Surg Oncol. 2012 Apr;10:65.
- 23) 北村 祥貴, 黒川 勝, 丹羽 秀樹, 奥出 輝夫, 森山 秀樹, 小竹 優範,ほか.成人発症の肝未分化肉腫の1例.日本消化器外科学会雑誌.2013;46(12):907–914.
- 24) 平木 将之, 江口 英利, 森井 英一, 土岐 祐一郎, 森 正樹, 永野 浩昭.成人に発症した肝未分化肉腫の1例.外科.2013;75(13):1535–1539.
- 25) 山田 千寿, 新田 宙, 石川 文彦, 釜田 茂幸, 兼子 耕, 伊藤 博.成人に発症した肝原発未分化肉腫の1例.日本臨床外科学会雑誌.2014;75(4):1026–1030.
- 26) 蜂谷 裕之, 北 順二, 森 昭三, 加藤 正人, 下田 貢, 窪田 敬一.長期生存を得ている成人発症の肝未分化肉腫の1切除例.消化器外科.2014;37(12):1863–1867.
- 27) 太田 浩志, 福田 三郎, 田澤 宏文, 先本 秀人, 江藤 高陽, 西田 俊博.成人発症の肝未分化肉腫の1例.日本臨床外科学会雑誌.2015;76(8):183–189.
- 28) Masuda T, Beppu T, Doi K, Miyata T, Nakagawa S, Okabe H, et al. Repeated hepatic resections and radio-frequency ablations may improve the survival of adult undifferentiated embryonal sarcoma of the liver: report of two cases. Surg Case Rep. 2015;1:55.
- 29) 安田 顕, 野々山 敬介, 早川 俊輔, 渡部 かをり, 藤幡 士郎, 山本 稔,ほか.肝切除後短期間て再発し,その後急速に進行して死亡した成人発症の肝未分化肉腫の1例.日本消化器外科学会雑誌.2016;49(5):409–417.
- 30) Mori A, Fukase K, Masuda K, Sakata N, Mizuma M, Ohtsuka H, et al. A case of adult undifferentiated embryonal sarcoma of the liver successfully treated with right trisectionectomy. Surg Case Rep. 2017;3:19.
- 31) 細川 慎一, 上村 良, 米永 吉邦, 伊東 大輔, 山下 好人, 宇山 志朗.成人肝未分化肉腫の1例.日本臨床外科学会雑誌.2017;78(8):1882–1886.
- 32) Buetow PC, Buck JL, Pantongrag-Brown L, Marshall WH, Ros PR, Levine MS, et al. Undifferentiated (embryonal) sarcoma of the liver: pathologic basis of imaging findings in 28 cases. Radiology. 1997 Jun;203(3):779–783.
- 33) Li XW, Gong SJ, Song WH, Zhu JJ, Pan CH, Wu MC, et al. Undifferentiated liver embryonal sarcoma in adults: a report of four cases and literature review. World J Gastroenterol. 2010;16(37):4725–4732.
- 34) Lenze F, Birkfellner T, Lenz P, Hussein K, Langer F, Kreipe H, et al. Undifferentiated embryonal sarcoma of the liver in adults. Cancer. 2008;112(10):2274–2282.
- 35) Tajima H, Ohta T, Kitagawa H, Shinbashi H, Hirose A, Makino I, et al. Giant serous microcystic adenoma of the pancreas safely resected after preoperative arterial embolization. Oncol Lett. 2010;1:841–844.