2020 年 53 巻 11 号 p. 892-900
2020 年 53 巻 11 号 p. 892-900
近年,扁平上皮癌の診断にΔNp63(p40)の免疫染色検査が行われている.これまでに肺扁平上皮癌に対する有用性が多数報告されており,徐々にその他の癌腫における有用性も報告されている.今回,我々は膵腺扁平上皮癌の3切除例に対してΔNp63の免疫染色検査を行い,その有用性を検討した.症例1は71歳の男性で,膵体部癌の診断で膵体尾部切除を施行した.症例2は81歳の女性で,膵頭部癌の診断で幽門輪温存膵頭十二指腸切除を施行した.症例3は55歳の男性で,膵尾部癌の診断で膵体尾部切除を施行した.いずれの症例も病理組織学的診断は膵腺扁平上皮癌であった.全3例にΔNp63の免疫染色検査を追加し,3例とも扁平上皮癌成分が陽性となった.分化傾向が不明瞭で,HE染色では成分の判別が困難な部位でも扁平上皮癌成分の混在が認識できた.膵腺扁平上皮癌の診断においても,ΔNp63の免疫染色検査は有用と考えられた.
Recently, immunohistochemical staining for ΔNp63 (p40) has been widely used to diagnose squamous cell carcinoma. While there have been many reports that have evaluated the usefulness of ΔNp63 (p40) for diagnosing squamous cell carcinoma of the lung to date, the number of reports of the diagnostic usefulness of ΔNp63 (p40) for other carcinomas has increased. We report three cases of adenosquamous cell carcinoma of the pancreas and evaluate the usefulness of ΔNp63 (p40) in diagnosing them. Case 1: A 71-year-old man underwent distal pancreatectomy for carcinoma of the pancreatic body. Case 2: A 81-year-old woman underwent pylorus preserving pancreaticoduodenectomy for carcinoma of the pancreatic head. Case 3: A 55-year-old man underwent distal pancreatectomy for carcinoma of the pancreatic tail. All cases were histologically diagnosed as adenosquamous carcinoma of the pancreas. The squamous cell carcinoma components of these cases were positive for ΔNp63. ΔNp63 allowed us to easily recognize squamous cell carcinoma components in areas in which it was difficult to discriminate whether squamous carcinoma components were included due to unclear cell differentiation. It is conceivable that immunohistochemistry for ΔNp63 could be useful in diagnosing adenosquamous carcinoma of the pancreas.
膵腺扁平上皮癌は膵癌全体の約1%とまれな疾患で,「扁平上皮癌成分が腫瘍全体の30%以上あるもの」と定義されているように,診断には詳細な病理学的検討が必須である1).従来,扁平上皮癌の診断にはp63の免疫染色検査が広く用いられてきたが,肺扁平上皮癌の診断における特異度が60~82%との報告もあり,特異度の低さが問題であった2)~4).そのため,近年では,抗p40抗体を用いたΔNp63(p40)の免疫染色検査が行われるようになってきた.ΔNp63の免疫染色検査は,肺扁平上皮癌の診断においてp63よりも特異度が高いことが示されており2),徐々にその他の癌腫の診断における有用性も報告されている5)~7).また,膵組織においても扁平上皮の形質をもった細胞ではΔNp63が発現していることが報告されているが8),膵腺扁平上皮癌の診断におけるΔNp63の免疫染色検査の有用性はいまだ明らかではない.
今回,我々は膵腺扁平上皮癌の3切除例に対して,抗p40抗体を用いてΔNp63の免疫染色検査を行い,その診断における有用性を検討したので報告する.
全3症例のまとめを示す(Table 1).
| Case 1 | Case 2 | Case 3 | |
|---|---|---|---|
| Age | 71 | 81 | 55 |
| Sex | male | female | male |
| Location | pancreatic body | pancreatic head | pancreatic tail |
| Operation | DP | PPPD | DP |
| Pathologic stage | T3N1a | T3N1b | T3N1aM1 (HEP) |
| Adjuvant chemotherapy | S-1→S-1+GEM | S-1 | GEM+nab-PTX→CDDP+GEM |
| Recurrence pattern | invasion to stomach | multiple liver metastases | local recurrence, multiple liver metastases |
| Survival (days) | 318 | 84 | 307 |
DP; distal pancreatectomy, PPPD; pylorus preserving pancreatoduodectomy, GEM; gemcitabine, nab-PTX; nab-paclitaxel, CDDP; cisplatin
症例1:71歳,男性
主訴:高血糖
既往歴:特記事項なし.
現病歴:健診で高血糖を認め,精査目的で腹部造影CTを施行された.膵体部に腫瘤性病変を認め,当院に紹介となった.
初診時血液検査所見:血液像,生化学検査は異常所見なく,血清腫瘍マーカーはCEA 1.3 ng/dl,CA19-9 271 U/ml,DUPAN-2 47 U/mlとCA19-9の上昇を認めた.
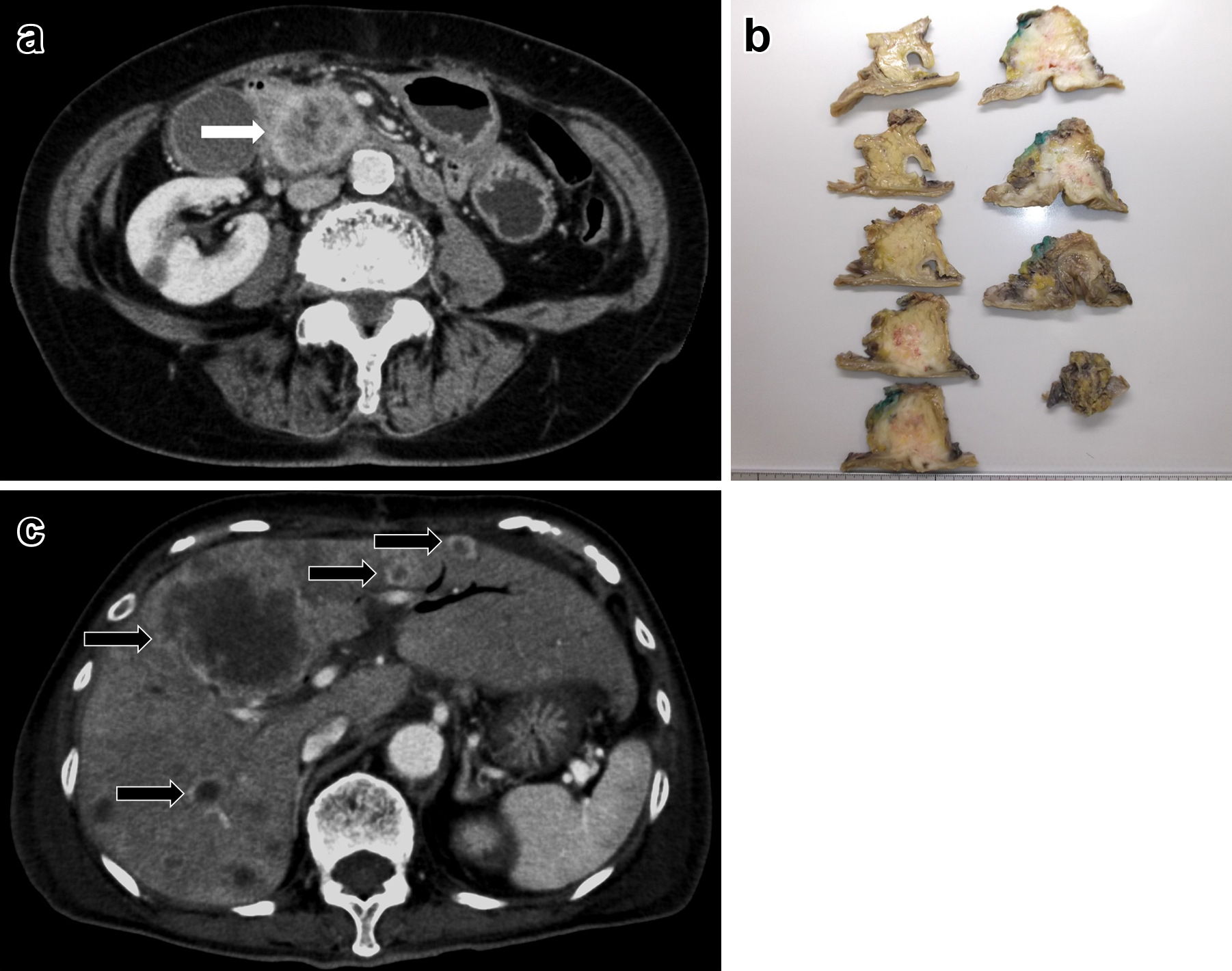
腹部造影CT所見:膵体部に25×16 mmの乏血性腫瘤を認めた.明らかな遠隔転移や周囲への浸潤は見られなかった(Fig. 1a).

a: Abdominal CT scan showed a low density mass 25 mm×16 mm in the body of the pancreas (white arrow). b: The tumor was solid, and it was 25 mm in diameter. c: Tumor induced stomach antrum penetration (white triangles).
術前診断:膵体部癌
手術所見:膵体尾部切除,脾合併切除
明らかな周囲浸潤や遠隔転移の所見は認めなかった.
切除標本所見:膵体部から膵尾部にかけて25 mmの白色充実性腫瘤を認めた(Fig. 1b).
最終診断:膵癌取扱い規約第7版に準じて,膵腺扁平上皮癌(Pbh,TS2,nodular;pT3,int,INFb,ly2,v2,ne2,mpd0,pCH0,pDU0,pS1,pRP1,pPV1(PVsp),pA0,pPL0,pOO0;pPCM0,pDPM0;pN1a,M0 Stage IIB)
経過:経過良好で術後30日目からS-1の内服を開始した.術後138日目に膵切除断端に局所再発を認め(Fig. 1c),S-1+gemcitabine(以下,GEMと略記)に変更したが,胃浸潤による出血のため,術後318日目に死亡した.
症例2:81歳,女性
主訴:黄疸
既往歴:特記事項なし.
現病歴:黄疸で近医を受診し,腹部エコー検査で総胆管拡張と膵頭部腫瘤を認め,当院に紹介となった.
初診時血液検査所見:血液像は異常所見なく,生化学検査はAST 213 U/l,ALT 270 U/l,ALP 3,539 U/l,T.Bil 23.3 mg/dl,γ-GTP 1,710 U/lと肝胆道系酵素上昇を認めた.血清腫瘍マーカーはCEA 4.3 ng/dl,CA19-9 8 U/ml,DUPAN-2 7,220 U/mlとDUPAN-2の上昇を認めた.
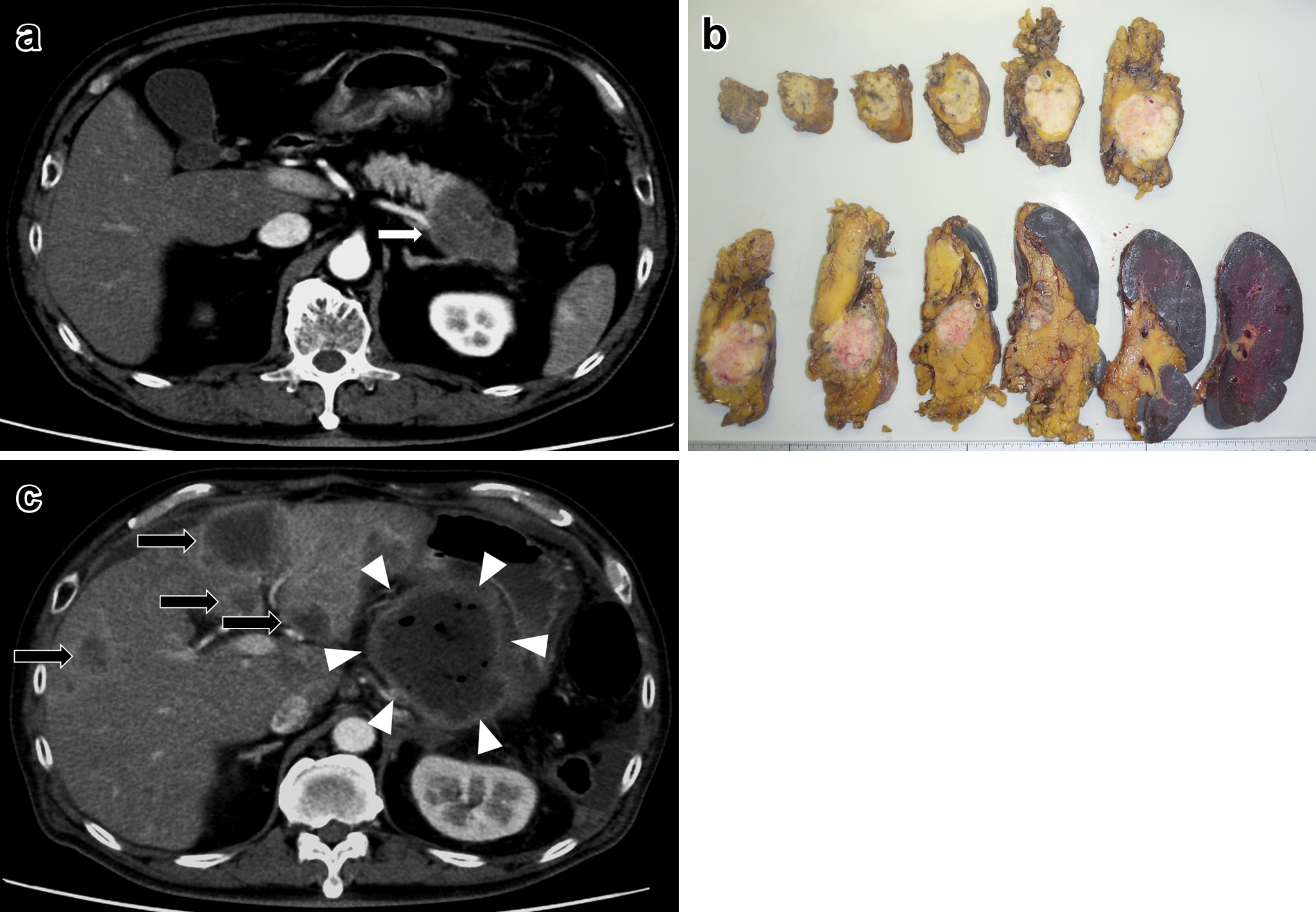
腹部造影CT所見:膵頭部に38×30 mmの乏血性腫瘤を認めた.上腸間膜静脈への浸潤が疑われた.肝臓に早期層で増強効果のある低吸収域を数か所認めた(Fig. 2a).
a: Abdominal CT scan showed a low density mass 38 mm×30 mm in the head of the pancreas (white arrow). b: The tumor was solid, and it was 40 mm in diameter. c: There were multiple liver metastases (black arrows).
術前診断:膵頭部癌,上腸間膜静脈浸潤
手術所見:幽門輪温存膵頭十二指腸切除,上腸間膜静脈合併切除
術中に肝S7表面に1 cmの白色結節を認めた.迅速病理組織学的検査は炎症性変化の所見であり,術前の腹部造影CTで認めた肝臓の低吸収域は胆管炎による末梢胆管のmicro abscessと考え,肝転移はないものと判断した.
切除標本所見:膵頭部に40 mmの白色充実性腫瘤を認めた(Fig. 2b).
最終診断:膵癌取扱い規約第7版に準じて,膵腺扁平上皮癌(Ph,TS3,nodular;pT3,int,INFb,ly2,v3,ne2,mpd1,pCH1,pDU0,pS1,pRP1,pPV0,pA0,pPL0,pOO0;pPCM1,pBCM0,pDPM0;pN1b Stage IIB)
経過:膵液瘻(ISGPF grade B)を合併したが,術後35日目に退院した.術後47日目に多発肝転移を認め(Fig. 2c),S-1内服を開始したが,徐々に全身状態が悪化し,術後84日目に死亡した.
症例3:55歳,男性
主訴:乳頭出血
既往歴:45歳 糖尿病,54歳 重症筋無力症
現病歴:健診の上部消化管内視鏡検査で乳頭出血を指摘され,精査目的で当院紹介となった.
初診時血液検査所見:血液像,生化学は異常所見を認めなかった.血清腫瘍マーカーはCEA 20.0 ng/dl,CA19-9 <2 U/ml,DUPAN-2 2,730 U/mlであり,CEAおよびDUPAN-2の上昇を認めた.
腹部造影CT所見:膵尾部に59×33 mmの乏血性腫瘤を認めた.明らかな遠隔転移や腫大リンパ節は認めなかった(Fig. 3a).
a: Abdominal CT scan showed a low density mass 59 mm×33 mm in the tail of the pancreas. b: The tumor was solid, and it was 40 mm in diameter. c: There were multiple liver metastases (black arrows) and local recurrence (white triangles).
術前診断:膵尾部癌,脾動静脈浸潤
手術所見:膵体尾部切除,脾合併切除,左副腎合併切除
肝下面に白色結節を認めたため切除して病理組織学的検査に提出した.左副腎浸潤が疑われたため,左副腎を合併切除した.
切除標本所見:膵体部から膵尾部にかけて40 mmの白色充実性腫瘤を認めた(Fig. 3b).
最終診断:膵癌取扱い規約第7版に準じて,膵腺扁平上皮癌(Pbt,TS4,infiltrative;pT3,sci,INFc,ly1,v1,ne1,mpd0,pCH0,pDUX,pS1,pRP1,pPVX,pA1(Asp),pPL1,pOO0;pPCM0,pBCMX,pDPM0;pN1a,M1(HEP)Stage IV)
肝結節からは腺癌成分と扁平上皮癌成分の混在を認めた.
経過:経過良好で,術後26日目からnab-paclitaxel+GEMを開始した.術後99日目に膵断端局所再発,多発肝転移を認め(Fig. 3c),cisplatin+GEMに変更したが,治療効果はprogressive diseaseであり,best supportive careの方針となって,術後307日目に死亡した.
病理組織学的検討
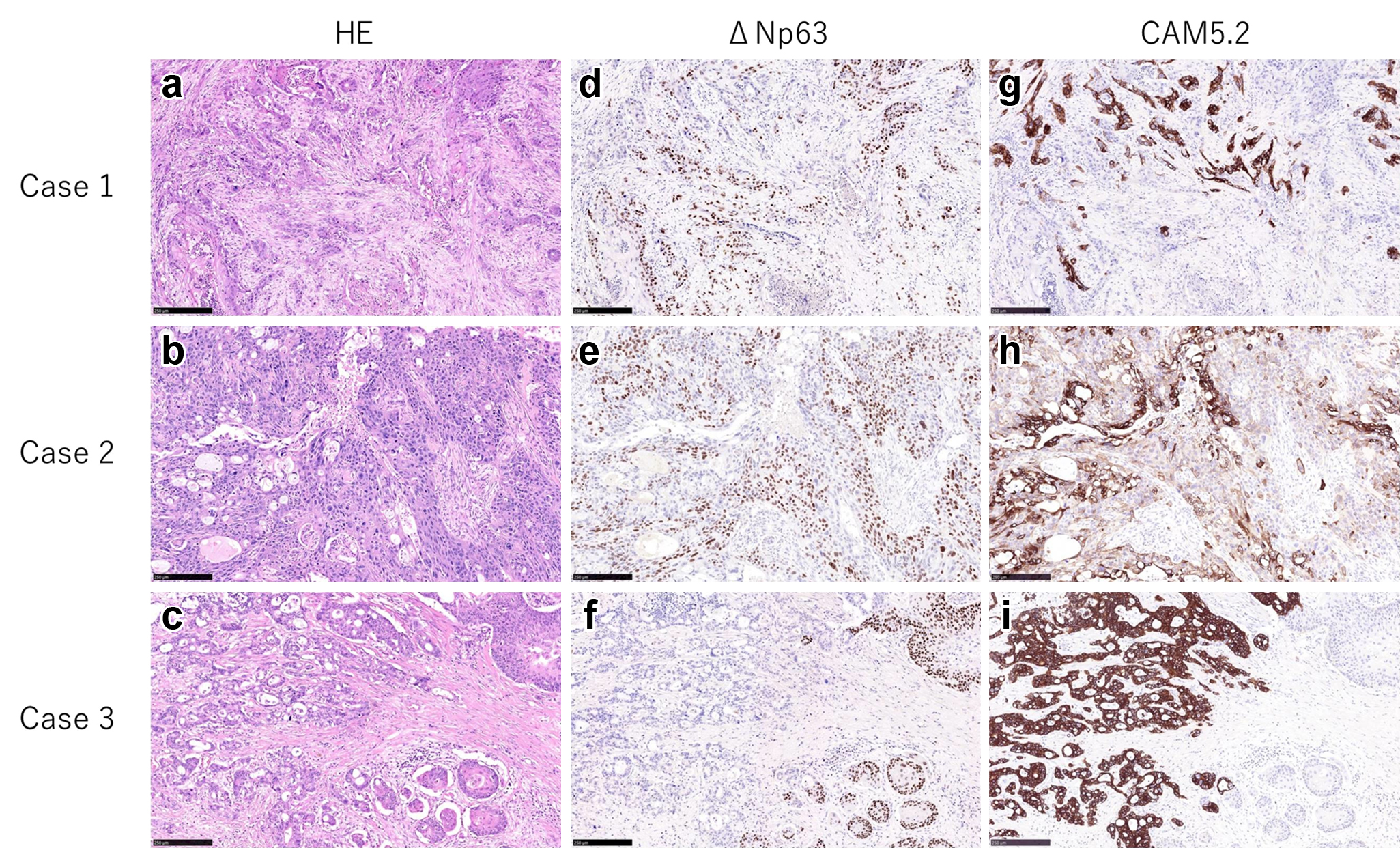
膵腺扁平上皮癌の3切除例について,抗p40抗体を用いてΔNp63の免疫染色検査を行い,膵腺扁平上皮癌の診断における有用性を検討した(Fig. 4).HE染色では腺腔形成を伴った腺癌成分,角化,細胞間橋を伴った扁平上皮癌成分の混在を認めた.全症例で扁平上皮癌成分がΔNp63陽性となり,CAM5.2染色との対比で,腺癌成分,扁平上皮癌成分が混在している様子が容易に判別できた.また,分化傾向が不明瞭でHE染色では成分の判別が困難な部位でも,ΔNp63が陽性となっており扁平上皮癌成分の混在を認識できた(Fig. 5).さらに,そのような分化傾向が不明瞭な部位では,部分的にΔNp63とvimentinがどちらも陽性となっていた.これらの所見は今回検討した3症例全てで認められた.

Glandular and squamous cell components were mixed (a, b, and c). Immunohistochemical detection for ΔNp63 (d, e, and f) and CAM5.2 (g, h, and i). The squamous cell component was positive for ΔNp63. The glandular component was positive for CAM5.2.

There were poorly differentiated cells that were difficult to discriminate between the squamous cell component or not (a). The specimen was positive for ΔNp63 (b) and vimentin (c).
膵腺扁平上皮癌は浸潤性膵管癌に分類され,通常型管状腺癌に比べて予後不良とされている9).発生機序として,①膵管上皮の扁平上皮化生した細胞の癌化10)~13),②扁平上皮癌と腺癌の衝突癌14),③多能性幹細胞から扁平上皮に分化して癌化10)12)15)などの説がある.
本疾患の臨床像として,Boydら16)は膵腺扁平上皮癌415例の検討で,膵腺扁平上皮癌は膵体尾部に好発し,膵腺癌と比較すると低分化で,リンパ節転移が多く,腫瘍径が大きかったと報告している.また,切除例の術後生存中央値は12か月で,膵腺癌の16か月と比較して有意に短かったと報告している.そのため,切除後の補助療法も重要であるが,術後補助化学療法に関して確立した治療法はない.Wildら17)はプラチナ製剤を用いたレジメンで生存期間中央値が有意に延長したことを報告している.また,Yamaueら18)は膵腺扁平上皮癌に対して術中照射,術後動注化学療法と体外照射の併用で40か月の長期生存例を得た1例を報告しており,放射線治療が有用である可能性が考えられる.
今回,我々が用いた抗p40抗体は,p63を構成するアイソフォームの一つであるΔNp63に特異的な抗体である.p63はp53遺伝子ファミリーに属する転写因子で,腫瘍発生や個体発生に重要な役割を果たしており,transactivation domainを持つTAp63と,それを欠いたΔNp63という二つのアイソフォームから構成されている19).それぞれのアイソフォームの腫瘍発生における役割は不明な点も多いが,一般的にはTAp63が腫瘍抑制因子,ΔNp63が発癌遺伝子として働くと考えられている20).また,ΔNp63は扁平上皮癌で特異的に発現するが,TAp63はびまん性大細胞型B細胞性リンパ腫や肺腺癌などの非扁平上皮系腫瘍においてもまれに発現することがわかっている2)~4).抗p40抗体はΔNp63のみを特異的に認識するポリクローナル抗体である.一方,抗p63抗体として通常用いられている4A4モノクローナル抗体はこれら二つのアイソフォームに共通するコアドメインを認識する抗体である.そのため,非扁平上皮系腫瘍でTAp63が発現した場合でも陽性となる2)21).したがって,ΔNp63に特異的な抗p40抗体と比べて扁平上皮癌の診断における特異度が低いと考えられている.
今回,ΔNp63の免疫染色検査を行い,各症例の扁平上皮癌成分の割合を調べたところ,症例1が約30%,症例2と症例3が約85%であった.HE染色で分化傾向が不明瞭な部位であっても扁平上皮癌成分の同定が容易であり,より客観的な成分割合の判定が可能であった.症例1のように扁平上皮癌成分が比較的少ない症例では,HE染色のみでは膵腺扁平上皮癌の診断が困難な場合があり,そういった症例では特にΔNp63の免疫染色検査が有用であると考えられた.
また,術前診断に対する有用性も期待される.医学中央雑誌で1964年から2019年8月の期間で「膵腺扁平上皮癌」,「術前診断」,PubMedで1950年から2019年8月の期間で「adenosquamous」,「pancreas」,「preoperative diagnosis」をキーワードとして検索したところ,膵腺扁平上皮癌の術前診断例の報告は1例のみであり22),術前診断は非常に困難であると考えられる.今回の3症例について,当院ではまだ超音波内視鏡が導入されていなかったため検討できていないが,今後は超音波内視鏡下穿刺吸引法による組織診などにおいてΔNp63の免疫染色検査を行うことで,扁平上皮癌成分の術前診断率が上昇する可能性がある.扁平上皮癌成分の混在を認めた場合に,術前補助療法として扁平上皮癌に有効とされているcisplatinや放射線治療を考慮すべきかどうかなどはいまだ明らかではなく,今後症例の蓄積が期待される.
近年,ΔNp63と腫瘍の悪性度との関連についても研究が進んでいる.興味深いことに,ΔNp63がWntシグナル伝達経路の活性制御に関与していることが報告されてきた23)24).Wntが受容体に結合するとβ-カテニン経路が活性化され,β-カテニンの細胞内レベルを調節することにより遺伝子発現を介して細胞増殖や分化を制御することがわかっている25)26).ΔNp63の発現低下によって,Wntシグナル伝達経路にかかわるWnt-4の発現低下およびWnt-5Aの過剰発現が起こり,これらは癌の転移や浸潤に関与するとされるepithelial mesenchymal transition(以下,EMTと略記)に関与していることもin vitroの研究で報告されている23)27).Kurayoshiら28)は胃癌237例の検討で,Wnt-5A陽性であった72例の5年生存率は陰性例に比べて有意に低かったと報告しており,臨床的にもWnt-5Aの過剰発現が予後不良因子となる例が示されている.一方,最近Hamdanら29)は,ΔNp63の発現が高い膵癌細胞株は扁平上皮形質を有しており,さらに,ΔNp63と他の転写因子との協調によって悪性度が上昇していることを示した.このようにΔNp63と腫瘍の悪性度との関連において相反する報告があり,いまだ明らかではない点も多い.しかしながら,今回報告した3症例は,早期に局所再発や遠隔転移を認めており,膵腺扁平上皮癌の高悪性度には扁平上皮成分の存在が関与していることが推測される.また,病理組織学的検討では,腫瘍辺縁の分化傾向が不明瞭な部位の一部で,ΔNp63とvimentinがどちらも陽性となっていた.ΔNp63とvimentinの関連性については明らかではないが,これまでにvimentinの発現がEMTと関連していることが報告されている30).今後,症例を重ねて詳細な検討を行う必要があるが,これらの所見は膵腺扁平上皮癌の悪性度とΔNp63の関連を解明する一助となるかもしれない.今回報告した3症例では再発腫瘍の組織学的な検討はできていないが,再発腫瘍ではΔNp63やvimentin陽性になる部位が増加しているなどの組織学的な変化が認められる可能性も考えられる.今後,ΔNp63の診断における有用性に加えて,腫瘍の悪性度との関連や治療への応用など,さらなる研究が期待される.
利益相反:なし