2020 年 53 巻 4 号 p. 313-320
2020 年 53 巻 4 号 p. 313-320
症例は70歳の男性で,上部消化管内視鏡にて胃角部小彎に0-IIa+IIc型早期胃癌を指摘され,当科を紹介受診した.腹腔鏡下幽門側胃切除を施行し病理結果は以下であった〔pT1bN2M0,pStage IIA,HER2(IHC2+,FISH陽性)〕.術後経過観察を行ったが,8か月後に肝外側区域に異時性肝転移が出現した.S-1+cisplatin+trastuzumab療法を3コース施行し,腫瘍縮小効果が得られた.新規病変の出現も認めなかったため腹腔鏡下肝部分切除を施行した.術後,S-1を1年間内服し約4年経過した現在も無再発生存中である.HER2陽性胃癌術後の単発肝転移に対して化学療法後に腹腔鏡下肝部分切除を施行した1例を経験したので報告する.
This case pertains to a 70-year-old man who was given a diagnosis of ulcerative lesions in the lesser curvature of the stomach on upper gastrointestinal endoscopy. Group 5 was diagnosed based on biopsy findings and the patient was referred to our department for surgery. Laparoscopic distal gastrectomy revealed the following: pT1bN2M0, pStage IIA, HER2 (IHC2+, FISH positive). The patient was followed up postoperatively; however, 8 months later, he developed hepatic metastasis in the lateral segment of the liver. Three courses of S-1+cisplatin+trastuzumab therapy were administered and shrinking of the tumor was observed. Since no new lesions were noted, laparoscopic partial hepatectomy was performed. Postoperatively, the patient was administered S-1 orally for 1 year. Currently, approximately 4 years since the hepatectomy, the patient is recurrence free. Here, we report our findings of a case in which laparoscopic partial hepatectomy was performed after chemotherapy for solitary liver metastasis noted after the surgery for HER2-positive gastric cancer.
胃癌ガイドライン(第5版)において,HER2陽性胃癌におけるtrastuzumabを含む化学療法が標準治療として位置づけられているが,胃癌の肝転移に関しては両葉に多発することが多いこと,肝外にも転移巣を有することが多いことなどから,肝切除の対象となりにくいとされ,外科的治療の意義は確立されてはいない1).今回,我々はHER2陽性胃癌術後の単発肝転移に対して化学療法後に腹腔鏡下肝部分切除を施行し,長期生存した1例を経験したので報告する.
症例:70歳,男性,PS0
主訴:特になし.
既往歴:前立腺肥大,大腸腺腫
現病歴:2013年11月上旬,検診で施行された上部消化管内視鏡検査で胃角部小彎に0-IIa+IIc病変を指摘された.生検結果は高~中分化腺癌であり手術目的に当科紹介となった.
血液生化学検査所見:正常範囲内であった.腫瘍マーカーもCEA 3.3 ng/ml,CA19-9 3 U/mlと正常範囲内であった.
上部消化管内視鏡検査所見:胃角部小彎に0-IIa+IIc病変を認めた(Fig. 1).

Upper gastrointestinal endoscopic findings show a type 0-IIa+IIc tumor located at the lesser curve of the gastric angle.
胸腹部造影CT所見:胃壁の肥厚は指摘できなかった.リンパ節の腫大,遠隔転移は認めなかった.
以上から,胃癌cT1bN0M0 cStage IA(胃癌取扱い規約第14版)と診断し手術を施行した.
手術術式:腹腔鏡下幽門側胃切除術(D1+リンパ節郭清),Billroth I法再建(新三角法2))(Fig. 2A).
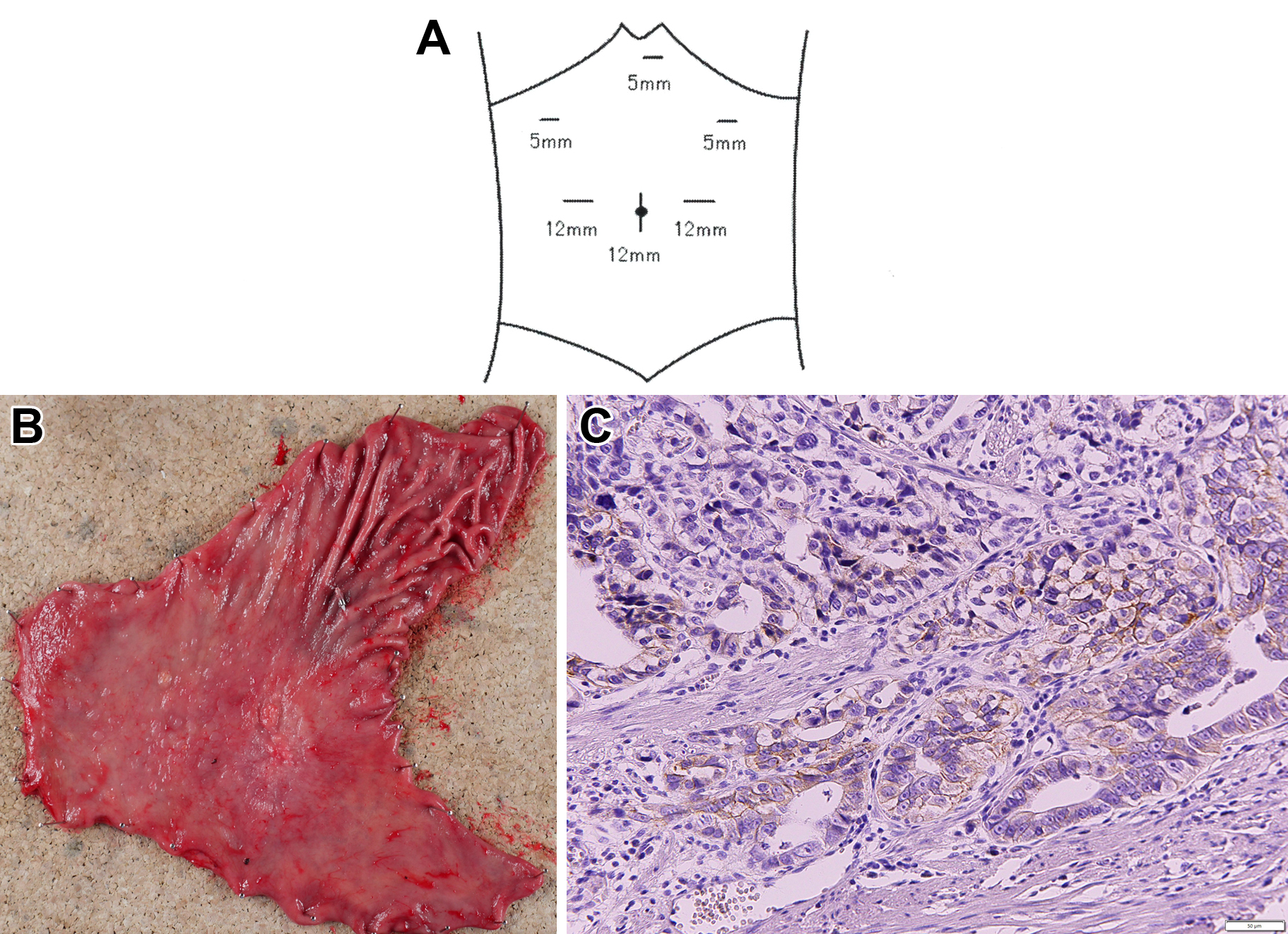
The port position in laparoscopic distal gastrectomy (A). Resected specimen of the stomach shows a type 0-IIa+IIc tumor measuring 30 mm located at the lesser curve of the gastric angle (B). HER2 status of the primary lesion was IHC2+ (C).
病理組織学的検査所見:M,Less,Type 0-IIa+IIc,30×25 mm,tub2>por,pT1b(SM2),INFb,Ly1b,V1b(VB),pPM0(20 mm),pDM0(70 mm),pN2(3/68),No3(3/22),pStage IIA.HER2蛋白陽性(IHC2+,FISH陽性)(胃癌取扱い規約第14版)であった(Fig. 2B, C).
臨床経過:術後,補助化学療法は行わず,定期経過観察を行っていたが,初回手術から約半年経過した2014年6月から腫瘍マーカーの上昇(CEA 67.1 ng/ml,CA19-9 6 U/ml)とCTにて肝外側区域に39 mm大の腫瘍性病変を認め,胃癌の異時性肝転移と診断した(Fig. 3A, B).MRIではそのほか明らかな肝転移巣は認めなかった.S-1+cisplatin+trastuzumab療法を3コース施行した.施行後のCTでは転移巣は15 mm大に縮小しそのほか新規病変の出現は認めなかった(Fig. 3C).MRIでも同様の所見であった.CEAは29.2 ng/mlと低下し,revised RECIST(version1.1)に準じて治療効果はPRと判断し,初回手術から約11か月経過した2014年12月に腹腔鏡下肝切除術を施行する方針となった.

Abdominal CT scan findings after laparoscopic distal gastrectomy showed no metastasis in the liver (A). Abdominal CT scan findings before chemotherapy showed metastasis in liver segment 3 (B). After 3 cycles of chemotherapy, liver metastasis was reduced in tumor size (C).
手術術式:腹腔鏡下肝S3部分切除術
術中所見:図のごとく5ポートで手術を開始した(Fig. 4A).腹壁と大網の癒着は軽度であったが,残胃と十二指腸の吻合部と肝下面に強固な癒着を認めた.癒着を剥離し術中エコーで腫瘍の局在を確認した後に腫瘍を摘出した(Fig. 4B, C).
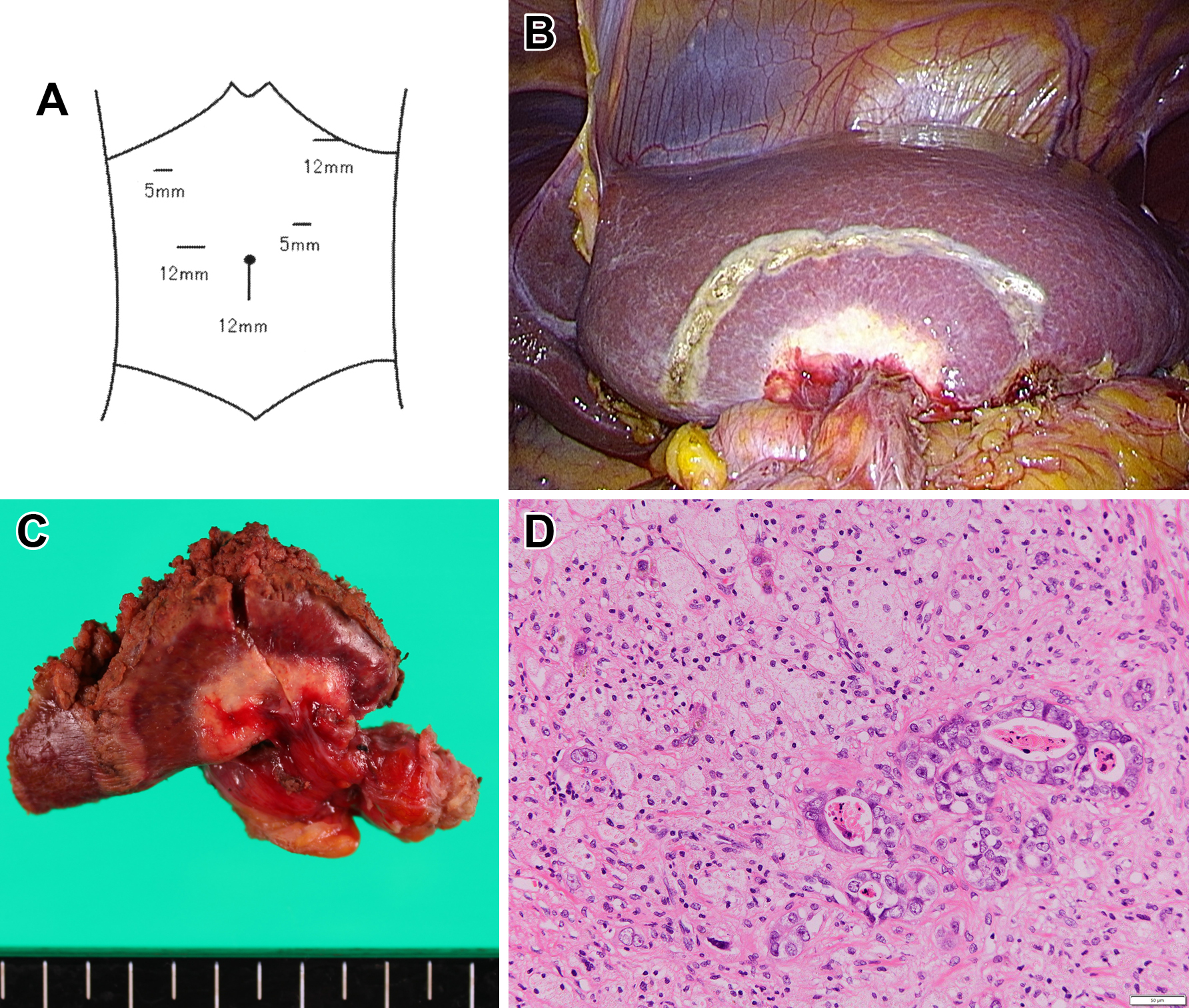
The port position in laparoscopic partial hepatectomy (A). The operative findings show white nodules in the left lateral segment (B). Resected specimen of the liver shows white nodules (C). Histopathological examination of the resected liver specimen shows degradation of the cancer cells and disappearance of viable cancer cells (D). Pathological response of the primary tumor was grade 2.
病理組織学的検査所見:Metastatic adenocarcinoma of the liver.組織学的治療効果判定はGrade 2であった(Fig. 4D).
術後臨床経過:術後4日目より経口摂取開始し,途中食事のつかえ感を訴えられたが,自然軽快し,その後は経過良好であった.自宅退院も可能であったが,患者希望により術後14日目にリハビリ目的に近医に転院となった.術後,S-1内服加療を1年間行い,現在外来フォロー中である.肝切除より約4年経過した2019年1月現在,無再発生存中である.
胃癌は国立がんセンターがん情報サービスによると,2017年本邦で罹患率が第2位(男性では第1位),死亡率が第3位と頻度の高い悪性腫瘍である.胃癌に対する化学療法は手術と並ぶ重要な位置を占め,Stage II/IIIの根治切除例に対する術後補助化学療法からStage IV症例に対する緩和的化学療法まで適応される.
胃癌の術後補助化学療法においてはACTS-GC試験によりS-1の有効性が示され,胃癌治療ガイドライン(第5版)においても術後S-1補助化学療法が推奨されている3)4).しかし,ACTS-GC試験での対象症例は胃癌取扱い規約第13版によるpStage II,IIIA,IIIB症例(ただしT1症例とT3N0症例を除く)であり,自験例(pT1bN2 pStage IIA)では適応とはならないため,初回手術後は定期経過観察の方針となった.Teradaら5)の報告によると,手術のみで治療されたpT3N0/pT1N2~3の胃癌患者の検討を行ったところ,多変量予後解析では病理学的静脈侵襲を有する患者の生存率は,これを有さない患者よりも優位に不良(5年無再発生存率75% vs 90%,5年全生存率78% vs 91%)であったとされている.自験例の病理組織検査結果でもV1bと中等度の静脈侵襲を認めており,術後約6か月で異時性肝転移を認めたことから,術後補助化学療法の検討が必要であった可能性はある.
一方,胃癌肝転移の頻度は4~14%とされ,診断時に他の非治癒因子の合併や肝両葉に多発することが多く予後不良であり,その標準治療は確立されていない6).しかし,近年,胃癌肝転移に対する肝切除について,いくつかの報告がなされており,慎重な適応を選べば長期生存が得られる可能性が示唆されている.Yoshidaら7)はStage IVの胃癌において,5 cm以下で単発の肝転移をpotentially resectable metastasis,複数もしくは5 cmより大きい肝転移をmarginally resectable metastasisに分類し,このうち化学療法が有効であった症例に対しては根治手術を行うことで予後の改善が期待できるとしている.
胃癌の異時性肝転移に対する肝切除前の化学療法に関しては確立された治療指針はない.大腸癌の異時性肝転移に関しては,術前・術後化学療法群のPFS延長を示したランダム化比較試験であるEORTC40983試験が報告されているものの,本試験ではOS(5年生存割合)では有意差を示せていない8)9).異時性肝転移に対する術前化学療法の利点としては,肝切除後は全身状態が悪化している可能性もあり術前に施行する方がコンプライアンスがよいこと,転移巣の縮小により切除が容易になることが挙げられる.ただし,化学療法による肝障害や,効果が得られなかった場合,切除不能になる可能性もあり術前化学療法は十分なインフォームドコンセントとコースごとの適切な効果判定が重要であると考える.自験例では,潜在する肝転移の可能性や,肝転移巣を制御できるかどうかを見極める目的で術前化学療法を行う方針とした.
また,レジメンにおいてはToGA試験の結果,HER2陽性の切除不能進行再発胃癌に対しては trastuzumabを併用した化学療法が治療の第一選択となっている10).HERBIS-1試験でも,SP療法にtrastuzumabを追加投与することにより,67.9%という高い奏効率が認められている11).自験例においても胃切除後早期であり5-FU系薬剤についてはOD錠であるS-1を選択し,S-1+cisplatin+trastuzumab療法を3コース施行したところ,肝転移巣の縮小を認め,組織学的治療効果判定でもGrade 2であったことから,同レジメンはHER2陽性胃癌肝転移症例に対する肝切除前の化学療法として有効な可能性がある.
医学中央雑誌で1964年4月から2018年4月までの期間で「胃癌」,「HER2」,「肝切除」をキーワードとして検索したところ,本邦においてHER2陽性胃癌の肝転移に対してtrastuzumabを含む化学療法後に肝切除術を施行した症例は自験例を含めて,計9例であった(Table 1)12)~19).男女比は6:3であり,5例が同時性転移,4例が異時性転移であった.全ての症例で肝切除前に化学療法がなされており,8例でSD以上の経過を得られていた.肝切除に関して,腹腔鏡下に手術を施行した症例は自験例のみであった.腹腔鏡下肝切除は低侵襲で整容性に優れた術式であり,2010年に肝部分切除術と肝外側区域切除術が,さらに2016年には血行再建や胆道再建を伴わない全ての肝切除術が保険収載されて以降,手術患者数も増加しつつある20).胃癌の肝転移症例に対する腹腔鏡下肝切除は症例数が少なく,またconversion therapyを行うタイミングに対して確立された指針はないため慎重な症例の選択が必要である.自験例では肝転移巣の局在に加え,術前化学療法による抗腫瘍効果により安全に腹腔鏡下肝切除を施行できたと考えられる.
| No. | Author/Year | Age/Sex | Histopathological type of the gastric cancer | Synchronous/Metachronous | TNM before chemotherapy | Solitary/Multiple liver metastases (location) | Chemotherapy before hepatectomy | Response to chemotherapy (RECIST ver 1.1) | Method of hepatectomy | Residual tumor | Pathological response | Chemotherapy after hepatectomy | Prognosis (mo) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Kawaguchi12) /2013 |
75/F | tub2-por HER2 (IHC2+ FISH+) |
Metachronous | Recurrence | Solitary (S7) | PTX+Tmab | PD | Posterior segmentectomy | R0 | Grade 0 | CPT-11+ cisplatin | Alive (8) |
| 2 | Choda13) /2014 |
77/F | tub1-2 HER2 (IHC3+) |
Synchronous | cT4aN0M1 (PER, HEP) | Multiple (S4, S6) | HXP | PR | Partial resection | R0 | Grade 1a | capecitabine+ Tmab | Alive (24) |
| 3 | Moon14) /2014 |
77/F | tub1 HER2 (IHC2+ FISH+) |
Synchronous | cT3N+M1 (HEP) | Multiple (S3, S4, S5–6) |
HXP | PR | Partial resection | R0 | Grade 2 | capecitabine | Alive (8) |
| 4 | Hokonohara15) /2014 |
73/M | tub2-por HER2 (IHC2+ FISH+) |
Synchronous | cT3N0M1 (HEP) | Multiple (S5, S8) | HXP | SD | S5 extended subsegmentectomy | R0 | Grade 0 | None | Alive (6) |
| 5 | Kim16) /2015 |
62/M | unknown HER2 (IHC2+) |
Metachronous | Recurrence | Multiple (S7, S7–8) | HSP | PR | Unknown | R0 | Grade 2 | None | Alive (27) |
| 6 | Matsumoto17) /2017 |
75/M | por HER2 (IHC3+) |
Metachronous | Recurrence | Multiple (S3, S5) | HXP | PR | Partial resection | R0 | Grade 3 | capecitabine+ Tmab | Alive (18) |
| 7 | Nagase18) /2017 |
70s/M | tub-por HER2 (IHC3+) |
Synchronous | cT4bN2M1 (LYM, HEP) | Multiple (unknown) | SOX+Tmab | PR | Partial resection+ radiofrequency ablation | R0 | Unknown | SOX+Tmab | Alive (unknown) |
| 8 | Nomura19) /2017 |
77/M | tub1 HER2 (IHC3+) |
Synchronous | cT4aN2M1 (HEP) | Solitary (S7) | HXP | PR | Unknown | R0 | Grade 2 | S-1 | Alive (24) |
| 9 | Our case | 70/M | tub1-2 HER2 (IHC2+ FISH+) |
Metachronous | Recurrence | Solitary (S3) | HSP | PR | Laparoscopic Partial resection |
R0 | Grade 2 | S-1 | Alive (50) |
TNM: TNM classification 8th edition, PTX: paclitaxel, HXP: trastuzumab+capecitabine+cisplatin, HSP: trastuzumab+S-1+cisplatin, Tmab: trastuzumab, SOX: S-1+oxaliplatin
Stage IV胃癌のR0切除後症例に対しての術後補助化学療法の有効性は確立されていないが,胃癌治療ガイドライン(第5版)によると,現時点ではS-1単独療法1年間,あるいはcapecitabine+oxaliplatinなどのオキサリプラチン併用療法6か月間が推奨されている.本症例においても全身の微小転移残存の可能性を考え,患者に説明のうえ,錠剤の大きさや副作用を考慮しS-1単独療法1年間を行い,肝切除より約4年経過した2019年1月現在,無再発生存中である.
今後,症例の蓄積により,胃癌の肝転移症例における治療戦略の確立と予後の改善が望まれる.
利益相反:なし