2020 年 53 巻 4 号 p. 360-370
2020 年 53 巻 4 号 p. 360-370
Hypoganglionosis(以下,HGと略記)は腸管内神経節細胞が減少し,ヒルシュスプルング病類縁疾患に分類されている.成人の報告例は少数であり,結腸癌に対する手術症例の報告はない.今回無症候性HGに合併した上行結腸癌切除例を経験したので報告する.症例は54歳の男性で,便潜血陽性を指摘され,全大腸内視鏡で上行結腸に2型腫瘍を認めた.CT,上部消化管内視鏡で十二指腸が拡張しており,注腸造影で結腸が拡張し,ヒダが消失していた.上行結腸癌に対して腹腔鏡下結腸右半切除術を施行したところ,術中所見で腸管の拡張と弛緩を認めた.術後に吻合部で腸閉塞を繰り返し,腹腔鏡補助下回腸横行結腸バイパス術を施行した.術後病理結果から上行結腸癌pT3N0M0,pStage II,およびHGと診断した.術後腸閉塞の再燃は認めず,HG症例の結腸切除症例では吻合径を十分に確保することが肝要であると考えられた.
Hypoganglionosis (HG) is characterized by the decrease in the number of intestinal glia cells and categorized as allied Hirschsprung’s disease. Usually it is recognized as a pediatric disease. Adult cases are extremely rare and to the best of our knowledge, there have been no reported surgical cases for colon cancer with HG. Here, we describe a case of right hemicolectomy for ascending colon cancer with HG. The patient was a 54-year-old man who had positive fecal blood test results from a medical checkup. The colonoscopy revealed a type 2 tumor in the ascending colon. CT and esophagogastroduodenoscopy indicated an abnormally dilated duodenum, and barium enema showed the dilated colon without folds. A laparoscopic right hemicolectomy was performed for ascending colon cancer. The laparoscopic view indicated the dilated and relaxed intestine. In the postoperative course, he had recurrence of obstruction at the anastomotic site. Laparoscopic assisted ileo-transverse bypass improved the obstruction. The histopathological diagnosis was ascending colon cancer pT3N0M0 pStage II and HG. There was no recurrent obstruction after the second surgery therefore, we believe securing an adequate diameter of the anastomosis is significant.
Hypoganglionosis(以下,HGと略記)は腸管内神経節細胞の減少を特徴とし,ヒルシュスプルング病類縁疾患に分類される疾患である1).多くは新生児期から幼児期に腸管蠕動運動異常により腸管拡張が起こり,便秘,腸閉塞症状で発症する2)3).一方で成人でも腸閉塞症状や慢性便秘症を契機に診断される症例が少数ながら存在する4).しかし,その自然史や重症度を規定する因子はいまだに明らかになっていない.今回,我々は無症候性のHGを背景とする上行結腸癌に対し,根治切除目的に腹腔鏡下結腸右半切除術を施行したが,術後に腸閉塞を繰り返し,腹腔鏡補助下回腸横行結腸バイパス術による口側腸管の減圧が有用であった非常にまれな症例を経験したので文献的考察を加えて報告する.
患者:54歳,男性
主訴:なし.
既往歴:特記すべき事項なし.
検診歴:30歳頃に上部消化管内視鏡検査で十二指腸拡張を指摘されるも原因は特定されず経過観察となった.
家族歴:父親に大腸癌,肝癌に対する治療歴あり.
内服薬:なし.
現病歴:検診で便潜血陽性指摘され,近医で全大腸内視鏡を施行したところ,上行結腸に半周性の2型腫瘍を認めた.上行結腸癌の診断で手術加療目的に当科紹介となった.
来院時現症:身長165.7 cm,体重62.7 kg,BMI 22.7 kg/m2.腹部は平坦,軟であり,圧痛は認めなかった.
血液生化学検査所見:Hb 9.5 g/dlの貧血を認め,MCVは83.4 flだった.TP 6.4 g/dl,Alb 3.8g/dl,TC 88 mg/dlと軽度の栄養障害を認めた.腫瘍マーカーはCEA 4.1 ng/ml,CA19-9 13.3 U/ml,CA125 9.3 U/mlと上昇を認めなかった.
上部消化管内視鏡検査所見:十二指腸は著明に拡張していた(Fig. 1a).
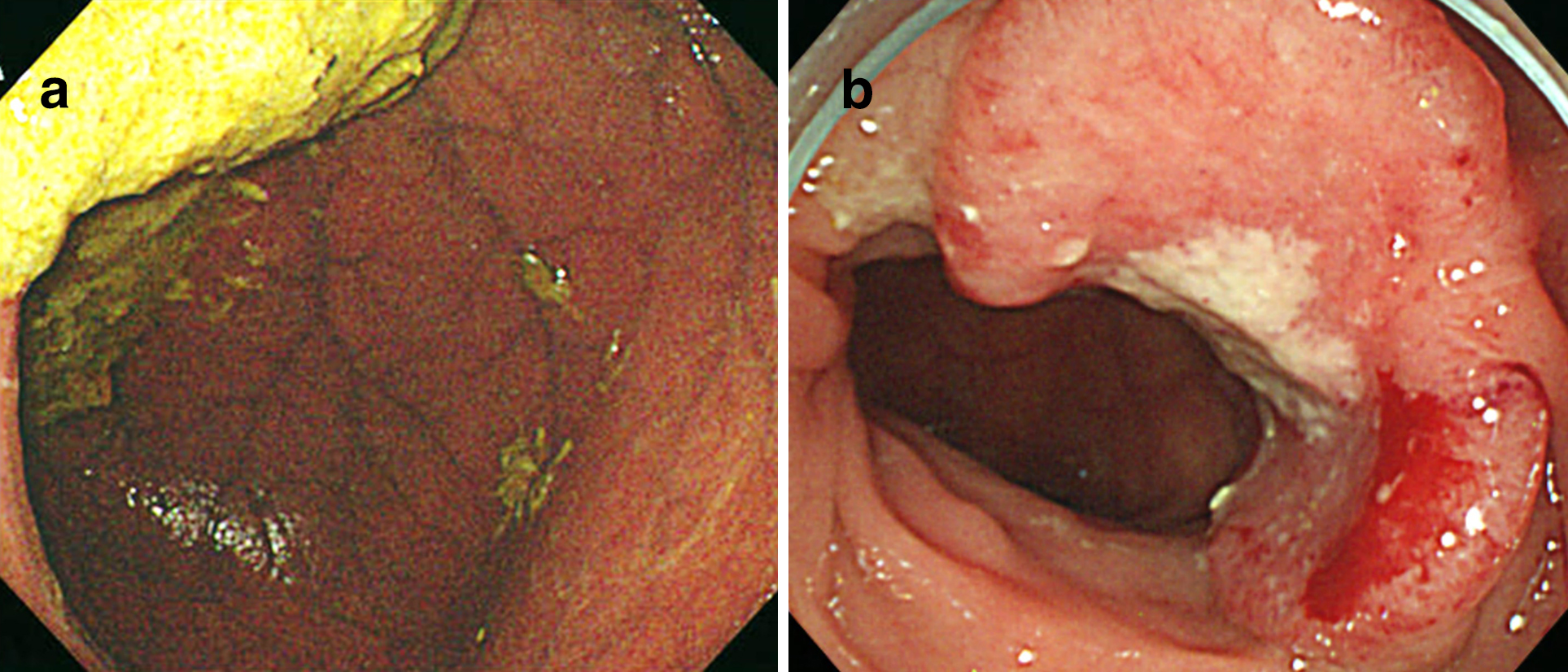
Endoscopic findings before the first surgery. (a) Esophagogastroduodenoscopy showed the dilated duodenum. (b) Colonoscopy revealed type 2 tumor at the ascending colon occupying half the circumference of the lumen.
下部消化管内視鏡検査所見:上行結腸に半周性の2型腫瘍があり,生検でAdenocarcinoma group 5,tub 1の診断であった(Fig. 1b).
腹部造影CT所見:十二指腸に拡張を認めるも明らかな狭窄部は指摘できず,空腸,回腸の拡張は認めなかった(Fig. 2a).上行結腸に壁肥厚を認めたが,周囲脂肪織濃度上昇やリンパ節腫大,遠隔転移は指摘できなかった(Fig. 2b).
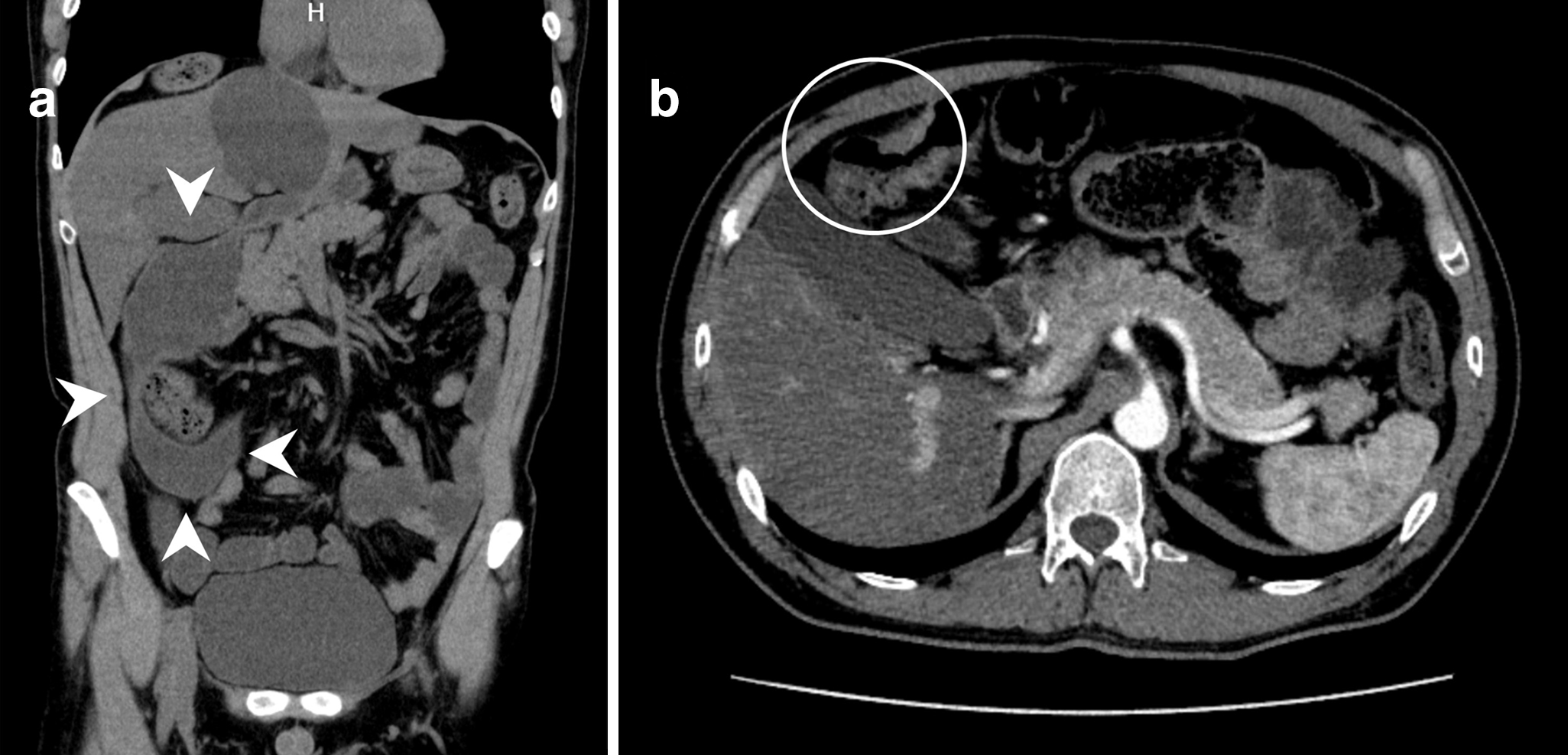
CT scan findings before the first surgery. (a) The dilated duodenum (arrowheads) was identified, but there was no obvious point of obstruction. (b) The ascending colon had wall thickness, but there was no evidence of distant metastasis or lymph node swelling.
注腸造影検査所見:上行結腸に25 mmの隆起性病変を認めた.結腸は体位変換により容易に拡張し,ヒダの消失を認めた(Fig. 3).
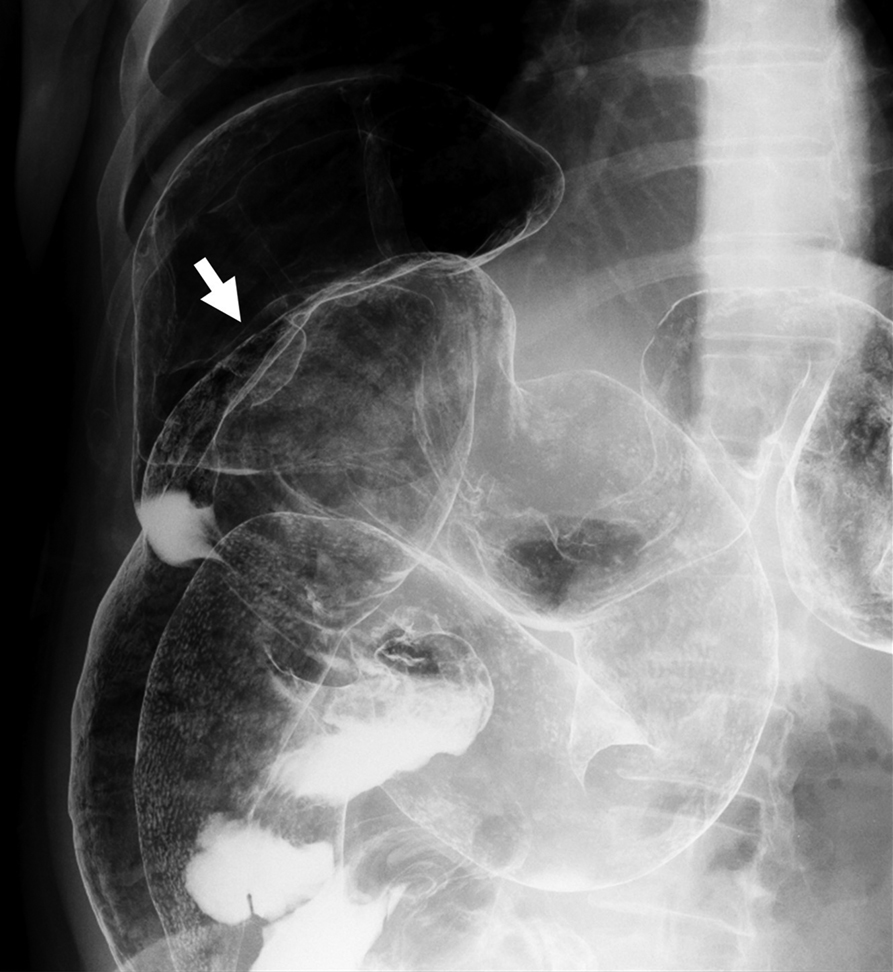
The findings of barium enema. The elevated lesion was pointed out at the ascending colon (arrow). The colon was dilated without obvious point of obstruction and haustra disappeared.
初回手術所見:上行結腸癌cT2N0M0,cStage I(大腸癌取扱い規約第8版)に対して腹腔鏡下結腸右半切除術を施行した.郭清はD3で,再建は60 mmのリニアステープラーによる機能的端々吻合を行った.十二指腸からS状結腸まで腸管は拡張および弛緩していた(Fig. 4, Fig. 4-video).手術時間は3時間50分,出血は10 mlだった.

Operative findings from the first operation. (a) Three 60 mm linear staplers were required to dissect the terminal ileum due to dilation. (b) The duodenum had severe dilation. TI; terminal ileum, S; staple line, D; duodenum, L; liver, GO; greater omentum.
病理組織学的検査所見:上行結腸に2型腫瘍を認め,病理組織学的に上行結腸癌pT3N0M0,pStage II(大腸癌取扱い規約第8版)の診断だった.また,回腸末端から横行結腸の壁は菲薄化していた(Fig. 5).
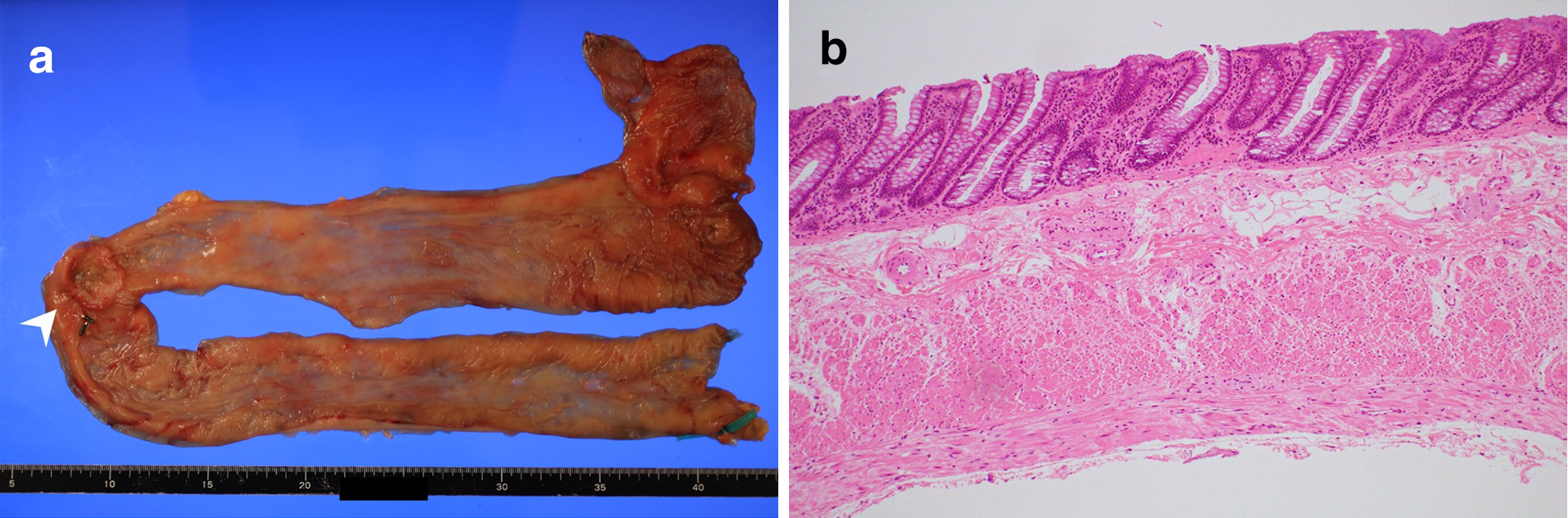
Pathological findings of the resected specimen of the first operation. (a) A type 2 tumor at the ascending colon (arrowhead). The wall of the ileum to the transverse colon was thin and dilated without folds. (b) Microscopically, thinning of circular muscle and atrophy of muscle fiber were observed. There was fibrosis in the submucosal layer and around muscle fibers. The number of ganglion cells decreased.
術後経過:術後3日目より経口摂取を開始,7日目に退院となった.しかし,術後13日目より腹部膨満感,軽度下腹部痛を自覚し,術後19日目に当院救急外来を受診した.CTで吻合部が原因と思われる腸閉塞の診断で入院加療となった.
再診時現症:腹部膨満,軟,上腹部に軽度圧痛を認めた.
血液生化学検査所見:CRP 3.03 mg/dlの上昇を認めるも,その他に明らかな異常は認めなかった.
腹部造影CT所見:吻合部に閉塞点を認め,口側小腸は著明に拡張していた.明らかな虚血を疑う所見は認めなかった(Fig. 6a).
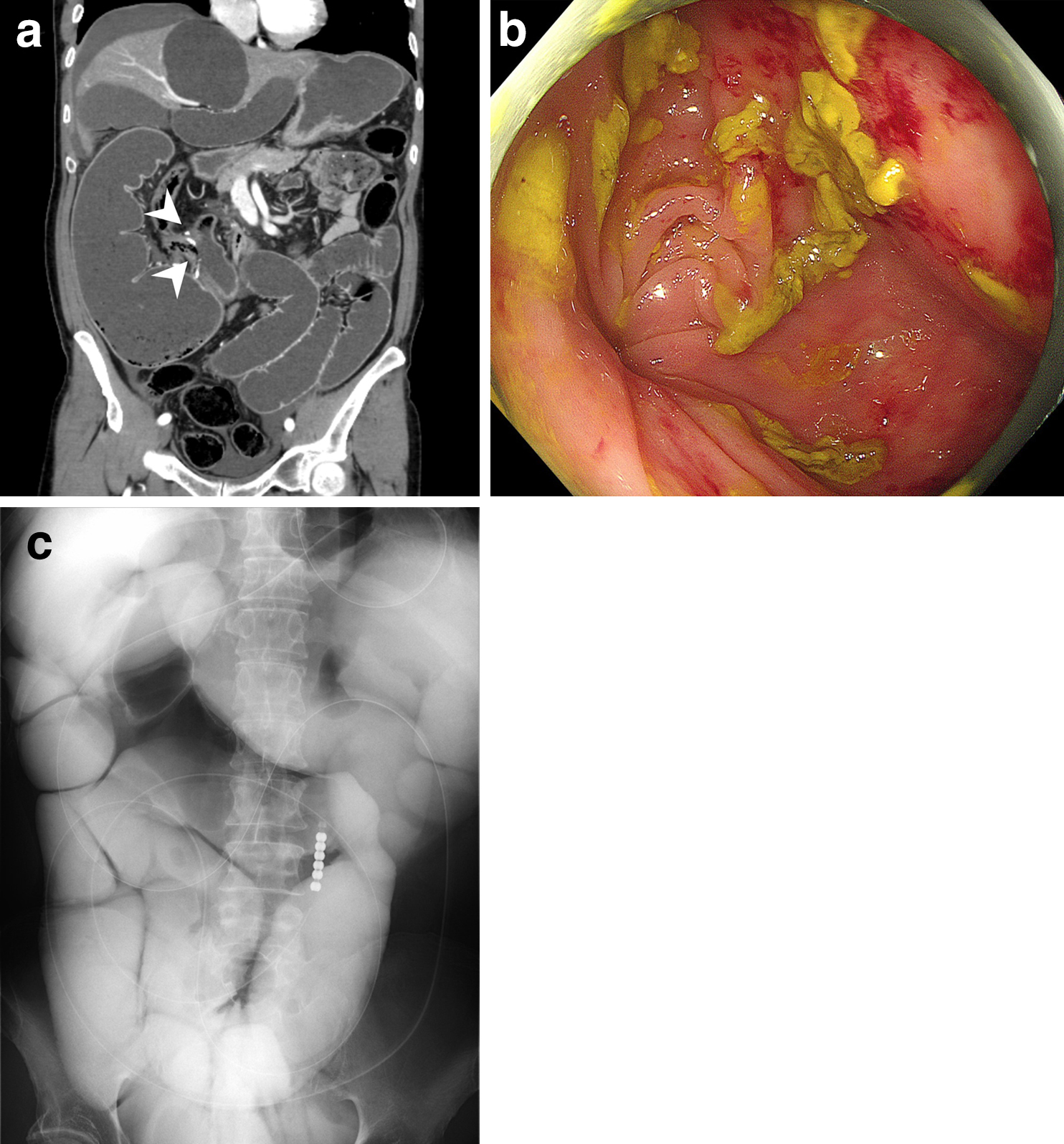
Preoperative images before the second surgery. (a) The CT scan indicated that the obstruction at the anastomotic site (arrowheads) caused the dilation of the small intestine. (b) The colonoscopy showed the point of obstruction at the anastomotic site with corkscrew-like findings. (c) The small intestinal series showed that the enhancement material administrated from the long intestinal tube did not reach the anastomotic site but the dilated small intestine was enhanced.
入院後経過:経鼻イレウス管を挿入し,小腸内の減圧を行うと排便を認め,入院後8日目にイレウス管を抜去した.10日目に経口摂取を再開するも17日目に腸閉塞の再燃を認めた.再度イレウス管を挿入し,減圧を行い,イレウス管造影検査で閉塞部がないことを確認したのちに抜去した.経口摂取を再開するも,再々度腸閉塞症状を認めた.さらにイレウス管を挿入し,減圧を行った.繰り返す腸閉塞の原因は吻合部である可能性が高く,吻合部の精査目的に下部消化管内視鏡検査,イレウス管造影検査を施行した.
下部消化管内視鏡検査所見:吻合部はコークスクリュー様に捻じれており,口側小腸へのファイバーは通過できなかった(Fig. 6b).
イレウス管造影検査所見:イレウス管の先端は回腸末端に存在し,造影剤は吻合部口側まで流入したが,肛門側結腸は造影されなかった.小腸全体は著明に拡張していた(Fig. 6c).
以上より,吻合部の捻じれが腸閉塞の原因と診断し外科的治療の方針となった.
手術所見:腹腔鏡で腹腔内を観察すると吻合部は十二指腸腹側に癒着していた(Fig. 7a).前回の手術所見同様に十二指腸から回腸末端までの小腸は弛緩,拡張していた.今回の狭窄の原因は内容物の流出遅延により腸管が拡張し,その重みと十二指腸への癒着による腸管の捻転と考えられた(Fig. 7-video).口側腸管の減圧目的に回腸横行結腸バイパスを作成することとし,吻合部口側の回腸と肛門側の横行結腸間でAlbert-Lembert吻合による逆行性の側々吻合を行い,手術を終了した(Fig. 7b, c).

Operative findings from the second operation. (a) Adhesion between the functional end-to-end anastomotic site and the duodenum was not detached. (b) The bypass between the ileum and the transverse colon with side-to-side anastomosis. (c) The relationship with previous anastomosis is illustrated. TI; terminal ileum, D; duodenum, S; staple line, A; anastomotic site, GO; greater omentum, TC; transverse colon, FEEA; functional end to end anastomosis, SSA; side to side anastomosis, ALA; Albert-Lembert anastomosis.
病理組織学的検査所見:術中に拡張した回腸の一部を生検目的に全層切除した.また,前回手術時の結腸,回腸末端も再検したところ,粘膜下層の菲薄化,繊維化を認め,Auerbach神経叢の神経節細胞が15個/腸管4.5 cm,4個/神経叢1.1 mmだった.一方でシナプトフィジン染色では粘膜内や粘膜下層内に神経線維を認めた(Fig. 8).また,初回手術の上行結腸からも同様の所見を得た.以上のことから,HGと診断した.

The microscopical findings of dilated terminal ileum. (a) HE stain showed thinning of the submucosal layer. (b) and (c) The number of ganglion cells decreased in Auerbach plexus with 15 per cm of intestine. (b) indicated no ganglion cells in the ganglion but (c) proved the existence of scattered ganglion cells (arrowheads) in the ganglion with calretinin stain. (d) Synaptophysin stain showed the neuron fiber in the mucus.
術後経過:術後3日目より食事を開始し,腸閉塞症状の再燃なく,術後13日目に退院となった.術後にHGの原因検索目的に施行した血液検査において抗核抗体は40倍未満であった.初回手術より1年経過するも腸閉塞症状や癌の再発所見を認めていない.
今回の症例で特異的であったことは3点挙げられる.まず十二指腸からS状結腸にかけて腸管拡張を認め,病理組織学的検査所見でHGと診断されるも無症候性であった点,次に無症候性HGに対して腹腔鏡下結腸右半切除術を施行した点,最後に吻合部での捻転による腸閉塞が疑われた際にバイパス術を選択した点である.
HGはヒルシュスプルング病類縁疾患に属している.ヒルシュスプルング類縁疾患は,直腸に神経細胞が存在するにもかかわらず腸閉塞症状,腸管拡張,慢性便秘などのヒルシュスプルング病と類似した症状や所見を示す疾患群であると定義され,検査所見,腸管神経の病理組織学的検査所見よりTable 1にまとめた7疾患に分類される1)5)6).これらの疾患は神経節細胞に異常を認める疾患と正常である疾患に分けられ,HGは神経節細胞に異常を認める疾患に分類され,神経節細胞の減少により診断される.HGは先天性と後天性に分類され,先天性は新生児期,幼児期に機能的腸閉塞症状を来す予後不良の疾患である7).先天性の場合,治療は空腸瘻や回腸瘻を造設し,その後も長期間の中心静脈栄養管理が必要であり,腸閉塞症状が持続する場合はpolysurgeryとなることが多い3).10年間の調査では22.22%の死亡率で,その原因としては中心静脈栄養管理による肝不全や敗血症であった3)8).一方で後天性は小児から成人で急性または慢性的な機能的腸閉塞症状を認め,2001年から2010年の全国調査で9例が登録されたのみであるが,予後は良好であり死亡例の報告はない9)10).しかし,これまでの後天性HGの症例報告は腸閉塞症状に対する手術症例4),あるいは腸閉塞に起因する死亡例の剖検例のみであり11)12),無症候性の報告はない.検査所見では血液生化学検査で有用な所見はなく,画像検査において拡張した一部または全腸管を認めるが,本疾患に特異的な所見はない13).本症例は術後病理検査結果よりHGと診断し,病歴より後天性HGと診断した.病理組織学的にHGはMeisner神経叢の神経節細胞は正常であるが,Auerbach神経叢の神経節細胞数の減少を特徴としている14).診断基準は全層で切除された腸管を用いてヒルシュスプルング病の否定と,神経節細胞の減少とされ,健常者では腸管1 cmあたり40個程度の神経節細胞が20個以下に減少していることが診断に有用とされている5).また,報告されている小児HG症例では神経節細胞が正常腸管と比較し12~24%に低下していた12)13).本症例では腸管4.5 cmに15個であったころから,腸管1 cmあたり3.3個となり,健常者と比較し8.3%に低下していた.以上のことから,無症候性のHGと診断した.後天性HGの明確な原因は明らかになっていないが,感染症,虚血,膠原病,薬剤が原因で炎症細胞が腸管壁に浸潤し,神経節細胞を破壊,神経節細胞の数が減少することでHGの病理像を呈することが示唆されている7)15)~17).本症例において原因を特定できるような病歴や薬剤摂取はなく,膠原病の有無に関して抗核抗体を用いて精査したが,明らかな原因は特定できなかった.また,症例報告から症状や病悩期間,予後はさまざまであり,これらを規定する要因は明らかになっていない.
| Isolated hypoganglionosis | Immaturity of ganglia | Intestinal neuronal dysplasia | Megacystis-microcolon-intestinal hypoperistalsis syndrome | Segmental dilatation of intestine | Internal anal sphincter achalasia | Chronic idiopathic intestinal pseudo-obstruction | |
|---|---|---|---|---|---|---|---|
| Abnormal findings in the ganglion cells | yes | yes | yes | no | no | no | no |
| The number of the ganglion | decrease | normal | increase | normal | normal | normal | normal |
| The size of the ganglion | small | normal | large | normal | normal | normal | normal |
| The number of the ganglion cells | decrease | normal | increase | normal | normal | normal | normal |
| The size of the ganglion | normal | small | normal | normal | normal | normal | normal |
| Other findings | Myenteric plexus is affected | Microcolon Small colon |
Ectopic ganglia Dysplasia of parasympathetic nerve system of the intestine |
Microcolon Megacystis |
Segmental dilatation of any intestine | Absence of rectosphincteric reflex | No mechanical obstraction |
| Treatment | Enterostomy Resection of the affected intestine |
Creation of enterostomy | Medication Internal sphincter myectomy |
Gastrostomy Enterostomy Vesicostomy |
Resection of the affected intestine | Medication Internal sphincter myectomy |
Medicaiton Enterostomy Resection of the affected intestine |
| Survival rate in 10 years (%) | congenital; 78 acquired; 100 |
100 | 100 | 53 | 100 | 100 | 89 |
| Prognosis | congenital; bad acquired; good |
good | good | bad | good | good | bad |
後天性HGは腸管の一部が影響を受けるsegmental HGと全腸管が影響を受けるdiffuse HGに分類できる.Segmental HGでは神経節胞数が低下している部位と正常な部位の間で口径差を認め,同部位が狭窄点となる13)18)19).本症例では術前検査,術中所見から十二指腸からS状結腸にかけて腸管の拡張および弛緩を認めたが,明らかな狭窄点は認めておらず,diffuse HGと思われた.今後腸閉塞症状の出現,腸管拡張の増悪に関して厳重に観察する必要がある.
HGに結腸癌を合併した症例はPubMedで「hypoganglionosis colon cancer」をキーワードとして1950年から2019年3月での期間で,また医学中央雑誌で「hypoganglionosis結腸癌」「腸管神経節細胞僅少症 結腸癌」をキーワードとして1964年から2019年3月まで検索したかぎり報告例はなく,今回の症例は極めてまれな症例であった.本症例では初回手術で通常通りの腸管切除を行い,機能的端々吻合で吻合した.しかし,術後に吻合部は十二指腸に癒着,固定され,吻合部の口側腸管の内容物の重さにより腸管が捻じれ腸閉塞を発症したと考えられる.今回,2回目の手術では吻合部の菲薄化した十二指腸への癒着を認め,十二指腸を損傷する可能性が高いと判断し,癒着剥離,および再吻合は行わずにバイパス吻合術を行った.バイパス吻合は流出径を拡大し,口側腸管の減圧を図ることができ,吻合部の捻じれが解消されたと考えられる.術後食事制限なく経口摂取が可能となったことから,有効な術式であると判断される.初回手術時に捻じれによる腸閉塞の予防策として吻合径を十分に確保し,口側腸管に内容物の貯留を避けることが挙げられる.吻合の工夫としては機能的端々吻合では複数の60 mmステープラーを用いて拡張腸管と同等の吻合径を確保することや,径が同等の拡張した腸管同士を手縫いで端々吻合すること,本症例のようにバイパス吻合を置くことが考えられる.今までに報告されている後天性HG症例では拡張腸管を切除し,正常径同士の腸管吻合や,Hartmann手術,pull-through法による拡張腸管の切除,または結腸亜全摘術および回腸直腸吻合,回腸瘻造設を行った症例が多い4)10)18)20)~22).本症例のように術後に腸管の捻じれに起因する腸閉塞を発症した報告はなく,適切な吻合方法や吻合径の考察はなされていなかった.初回手術で腸管の捻じれを予防する方法としては腸管の後腹膜あるいは腹壁への固定術が挙げられる.しかし,拡張腸管を固定した場合に固定された点で腸管の重みによって本症例のように捻じれが生じる可能性がある点を考慮する必要がある.また,腸回転異常症では腸管の固定術による腸捻転の予防の有効性は明確ではないことから23),捻じれの予防を目的とした腸管固定術は必須ではないと考えられる.一方で機能的腸閉塞症状が改善しない場合,polysurgeryとなる症例や,人工肛門からの離脱できない症例も存在した10).十分な吻合径を確保しても腸閉塞症状を繰り返す場合は減圧目的に腸瘻の造設を考慮する必要があるが,本症例のように全小腸が拡張および弛緩している場合はpolysurgeryとなる可能性や中心静脈栄養に依存する可能性も考慮する必要がある.
閉塞機転を伴わない原因不明の腸管拡張を認める症例は成人であってもHGを念頭に置く必要があり,拡張した腸管同士を切除および吻合する場合は通常よりも大きな流出路を確保することが肝要であると考えられた.後天性HGは症例が少数ではあるが,本症例のように無症候性に経過する症例もあり,今後の症例の蓄積,および検討が必要である.
利益相反:なし