2020 年 53 巻 7 号 p. 598-604
2020 年 53 巻 7 号 p. 598-604
症例は35歳の女性で,輸血依存の重症再生不良性貧血(aplastic anemia;以下,AAと略記)経過中に腹痛を自覚し,CTにて大腸癌術後の穿通性吻合部潰瘍による腹壁膿瘍と診断した.合併症対策として,術前に血小板輸血(platelet concentrate;以下,PCと略記)の反応性および,G-CSF投与による骨髄不全の程度を評価した.PC輸血により血小板は増加したが,G-CSF投与による白血球増加は認められず,術前に血小板・赤血球輸血を行ってから開腹にて吻合部切除術を施行した.術後は,創感染と膿瘍腔ドレーン先端に腹腔内感染を認めたが,ドレナージと抗生剤加療,血小板・赤血球輸血による周術期管理を行い,術後55病日に軽快し退院となった.重症AA患者における消化器外科手術の周術期管理は確立されていないが,骨髄不全の程度や輸血反応性を把握し,合併症発症時の対策を立て,適切な輸血療法を基盤に周術期管理を行うことが重要であると考えられた.
A 35-year-old woman noticed abdominal pain during a course of transfusion-dependent severe aplastic anemia. She was given a diagnosis of abdominal wall abscess due to a penetrating anastomotic ulcer after colorectal cancer surgery. We evaluated the reactivity of platelet transfusions and the degree of bone marrow failure by G-CSF administration before surgery to prevent perioperative complications. The platelet count increased after the platelet transfusion, but the leukocyte count did not increase after the G-CSF administration. After transfusions of platelets and red blood cells, the anastomotic resection was performed by laparotomy. Although the wound infection and intraperitoneal infection at the abscess cavity were observed postoperatively, perioperative management including drainage, antibiotic treatment, and platelet and red blood cell transfusions was performed, and the patient was discharged 55 days after surgery. Optimal perioperative management of patients with severe aplastic anemia undergoing gastroenterological surgery has not been established. We consider that it is essential to evaluate the severity of bone marrow failure and transfusion responsiveness before surgery, and to be prepared according to the appropriate transfusion therapy.
再生不良性貧血(aplastic anemia;以下,AAと略記)は,汎血球減少と骨髄低形成を特徴とする症候群である1).周術期には貧血・出血傾向・易感染性の全てが問題となるが,手術症例の管理方法についての報告は少なく,いまだ確立されていない.今回,我々は輸血依存の重症AA経過中に発症した大腸癌術後の穿通性吻合部潰瘍に対して,吻合部を切除し,輸血を主体とした周術期管理により良好な結果をえた1例を経験したので報告する.
患者:35歳,女性
主訴:腹痛
既往歴:17歳でAA(輸血依存状態)と診断された.20歳頃シクロスポリン内服にて輸血非依存状態となった.25歳時に下行結腸癌腹壁穿通にて開腹結腸左半切除術を施行した.32歳に出産後,再度輸血依存状態となりeltrombopag olamine(レボレード®),danazol(ボンゾール®)内服中であった.
家族歴:特記事項なし.
現病歴:2008年10月(25歳時)に,前医で閉塞性大腸癌に対して開腹結腸左半切除術(左結腸動脈と中結腸動脈左枝を処理してD2郭清,右側横行結腸とS状結腸をリニアステープラーで機能的端々吻合し断端埋没)を施行し,最終診断はT3N0M0 Stage II(大腸癌取扱い規約第7版)であった2).同年12月にフォローアップ目的で施行した下部消化管内視鏡検査(colonoscopy;以下,CSと略記)にて,吻合部潰瘍を認めたが保存加療にて改善した.その後の定期的なCSでは吻合部潰瘍の再燃はなかった.2017年2月(34歳時)に左上腹部痛を自覚し,前医で施行されたCSにて前回の吻合部潰瘍とほぼ同部位に潰瘍が再燃した(Fig. 1).難治性潰瘍の診断で手術予定となったが,4月頃より腹痛が軽快したため,良好とはいえないAA(WBC 1,500/μl程度)の治療を優先することとなり,導入予定であったレボレード®の効果を確認するまで手術は延期となった.しかし,同年7月から腹痛の増悪と吻合部潰瘍からの出血(計4回の内視鏡的止血術を施行)が続いたため,本人の手術希望も強く手術目的に当科紹介受診となった.

Colonoscopy: Stomal ulcer was detected.
入院時現症:身長160 cm,体重54.3 kg,体温36.5°C,眼球結膜に貧血があった.腹部は平坦,軟で上腹部に正中切開痕があり,左上腹部に硬結を触れ,圧痛を認めたが,明らかな腹膜刺激徴候はなかった.
入院時検査所見:WBC 1,100/μl,Neu 517/μl,Hb 4.6 g/dl,Plt 0.5×104/μlと汎血球減少を認めた.
腹部造影CT所見:結腸吻合部周囲に脂肪織濃度上昇があり,左上腹部腹壁に接して境界は不明瞭であった.腹壁内には液体貯留を認めた(Fig. 2).
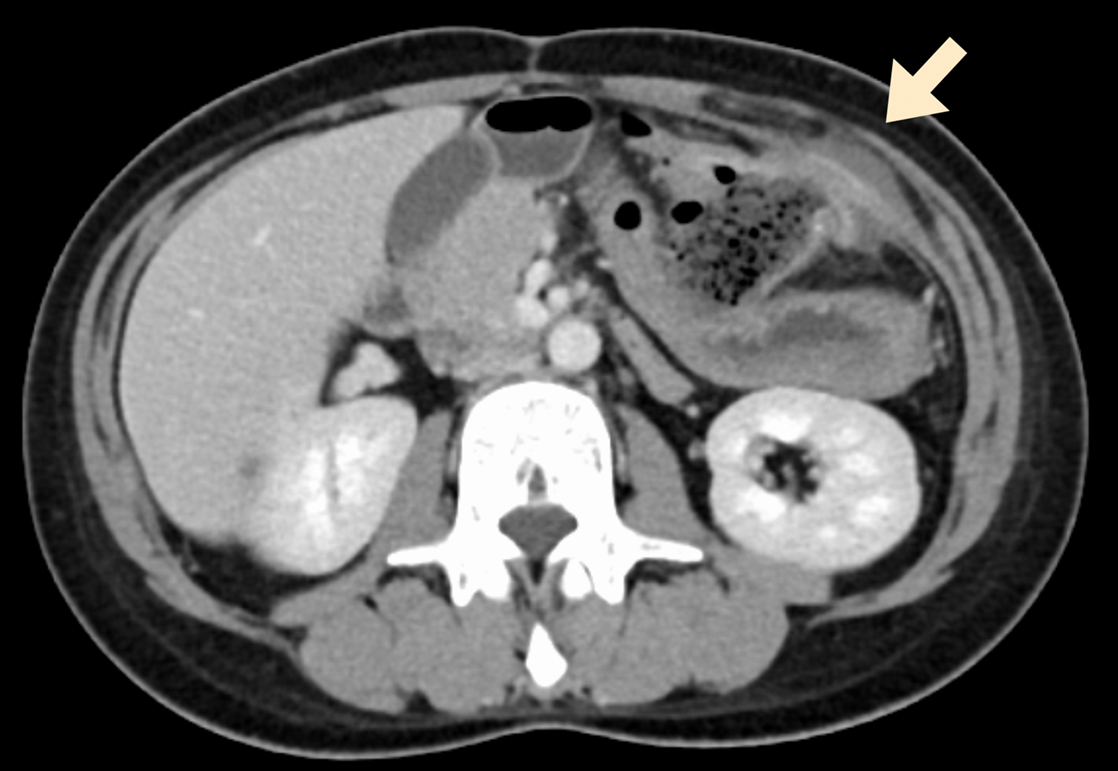
Contrast-enhanced CT: Fat density increased around the colocolostomy. Fluid collection was observed in the left abdominal wall (arrow). Free air and ascites were not detected.
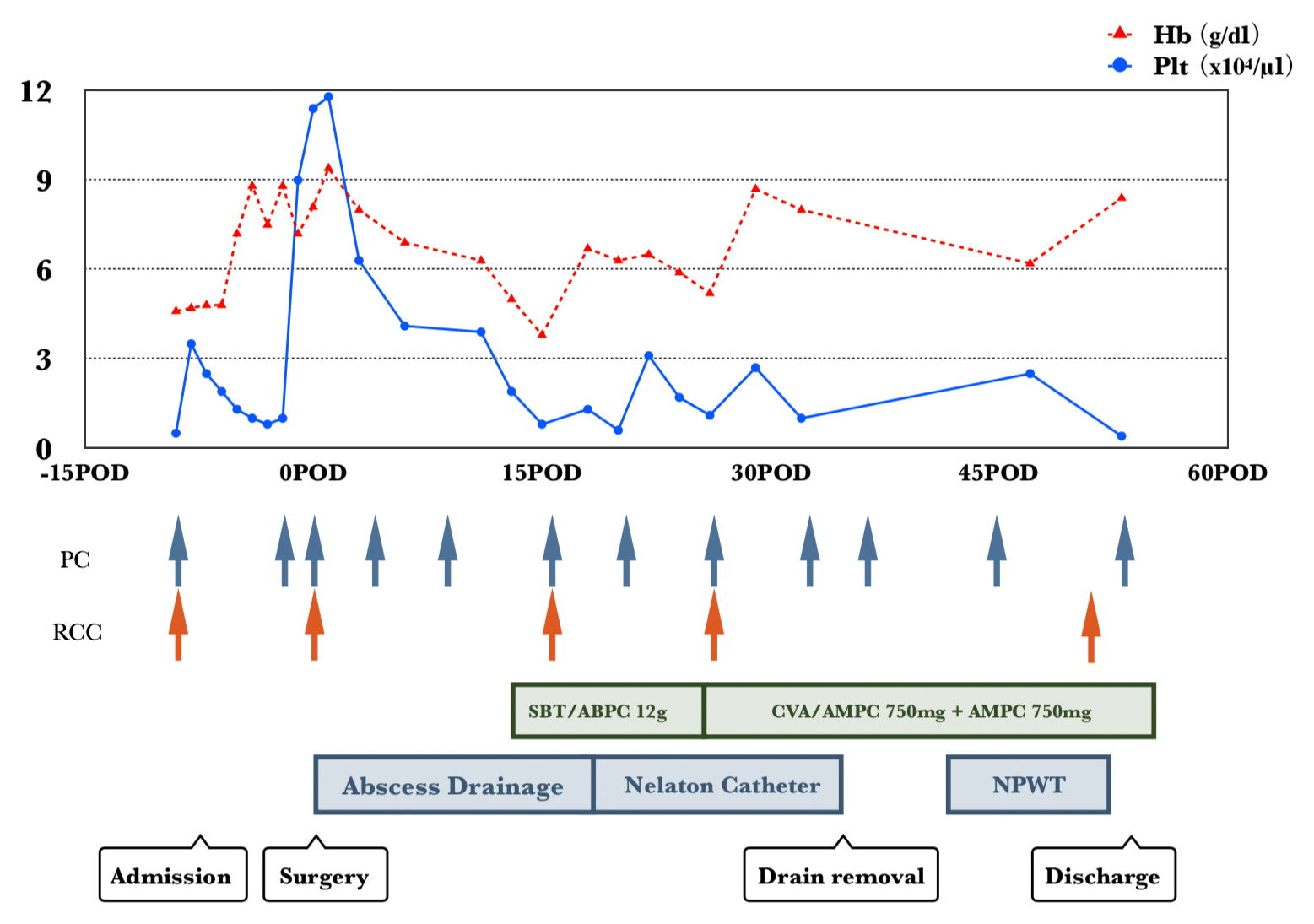
以上より,吻合部潰瘍の穿通による腹壁膿瘍と診断し,開腹にて吻合部切除術の方針とした.汎血球減少による周術期のリスク対策のため,血液内科と術前検討を行った.まず血小板減少による出血傾向に対しては,術前に血小板輸血(platelet concentrate;以下,PCと略記)の反応性を評価し,0.5×104/μl→4.2×104/μl(輸血1時間後)と良好な反応を確認した3)4).また,G-CSF投与により骨髄不全の程度も評価したが,好中球517/μl→663/μlと反応は不良で,G-CSF投与は無効と判断した.手術までにPCを計50単位,赤血球輸血(red cell concentrate;以下,RCCと略記)を計8単位施行し,術前日にはPlt 9.0×104/μl,Hb 7.2 g/dlと補正されていた(Fig. 3)4).好中球は術前日が583/μl,術直後が 553/μlと術前後で大きな変動はなく,その後の経過でも著明な増減はなかった.周術期の予防的抗生剤は,通常の消化器外科手術と同様にセフメタゾールを執刀時と執刀3時間後に使用し,術翌日で終了した.
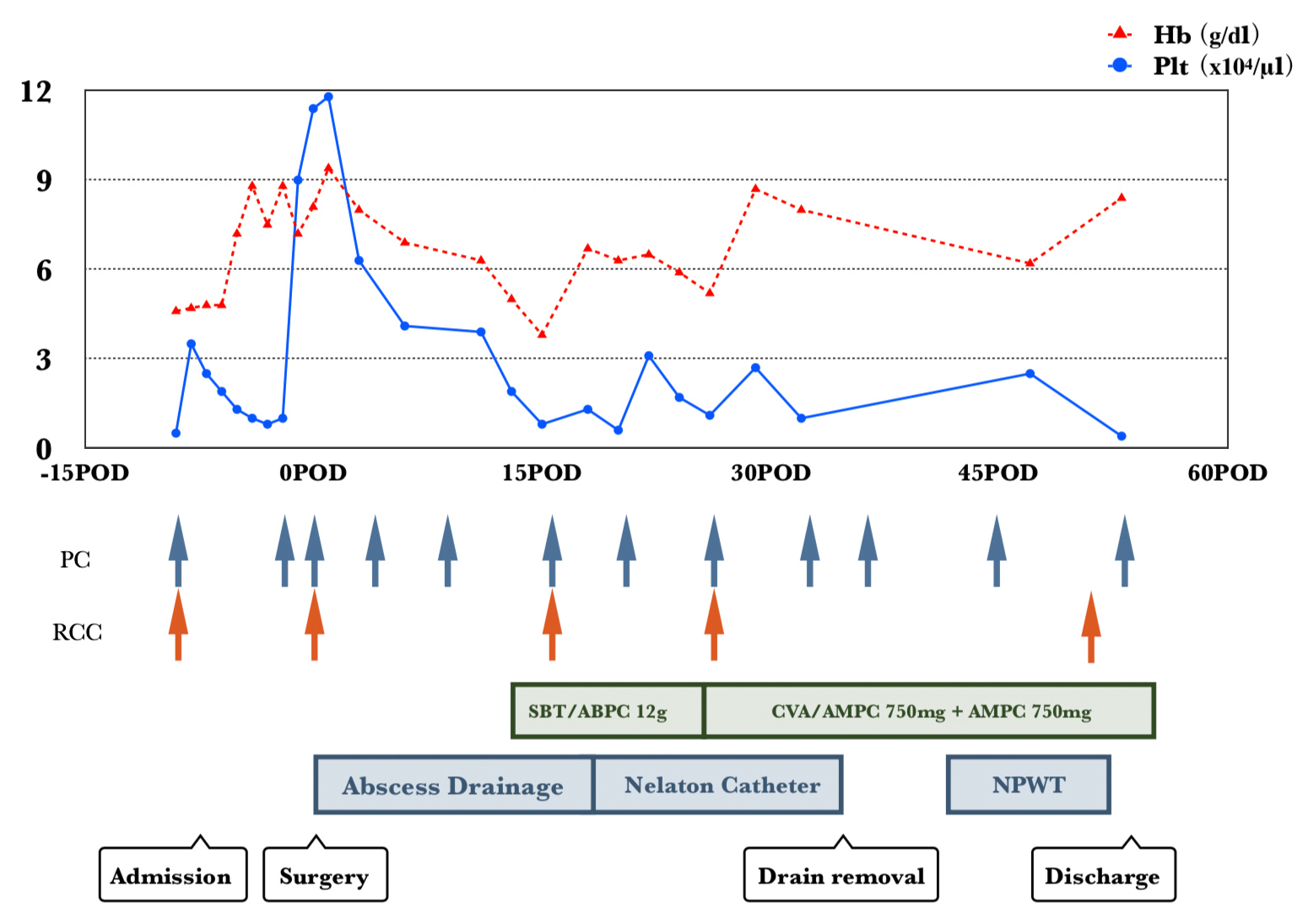
Schema of perioperative clinical course.
手術所見:前回手術の上腹部正中切開痕を利用し,上下腹部正中切開にて手術を開始した.左上腹部腹壁に吻合部が強固に癒着しており,潰瘍穿通と診断した.外側アプローチにて左側結腸を授動し(①),吻合部周囲まで十分に剥離を進めた(②).腹壁に膿瘍形成を伴っており,腹膜・筋膜下組織を一部合併切除し,残存粘膜を有する可能性がある部位は十分に焼灼した(③).吻合部口側肛門側の切離ラインは血流温存を意識して設定し,各々リニアステープラーにて切離して検体を摘出した(A/B).右側結腸を授動し(④),中結腸動脈右枝を結紮切離した(⑤).結腸や腸間膜が捻じれない自然な配置となるように,右側結腸を反時計回りに廻して横行結腸断端を骨盤底に移動させ(⑥),右側横行結腸とS状結腸を機能的端々吻合にて再建した(⑦).腹腔内を温生食10 lで十分に洗浄し,骨盤底と膿瘍腔にドレーンを留置して手術終了した(Fig. 4).手術時間は4時間19分,出血量は50 mlであった.吻合部の血流低下を予防するために,術中にRCCを2単位輸血した.

Schema of operative findings.
病理組織学的検査所見:標本は下行結腸吻合部切除検体であった.吻合部肛門側寄りに長径4 cmの穿孔と周囲に潰瘍形成を認めた.組織学的には穿孔部周囲に結腸壁構造はなく,肉芽組織と線維化組織に置換されていた.上皮に腫瘍を疑わせる異型性は認めなかった.
術後経過:当科の定期結腸手術と同日程で,術後2日目(postoperative day;以下,PODと略記)の飲水開始とともにレボレード®とボンゾール®の内服を再開した.正中創の滲出液増加に対し,一部皮膚縫合を開放してドレナージを行った.膿瘍腔ドレーンの排液が混濁したため,13PODに腹部造影CTを施行したところ,ドレーン先端が位置する筋膜下(術前腹壁膿瘍の切除部と同部位)に幅6 cmに及ぶ液体貯留を認め,drain排液の細菌培養からはE. Coliが検出された(Fig. 5).術後腹腔内膿瘍の診断で,感染症内科と相談し,SBT/ABPC 12 g/dayにて治療開始となり,CVA/AMPCの内服抗生剤に移行して計6週間抗生剤加療を継続した.また,ドレーン留置にもかかわらず膿瘍形成を来したため,ドレナージ不十分と判断し洗浄可能なネラトンカテーテルに入れ替え,34PODに抜去した.正中創はシャワー洗浄と白糖・ポビドンヨード配合軟膏(イソジン®シュガーパスタ軟膏)塗布にて治療し,感染が落ち着いた40PODから閉鎖陰圧療法(negative pressure wound therapy;NPWT)にて創傷治癒促進した5).もともと輸血依存状態の再生不良性貧血患者であり,輸血不応となる可能性を考慮し,術後はPlt <1.0×104/μlでPCを10単位,Hb <6.0 g/dlでRCCを4単位輸血することとした(Fig. 3)4).自宅管理が可能な状態となり,55PODに退院した.

(a) Postoperative CT images: Fluid collection was observed below the fascia of the transversus abdominis muscle where the drain tip was located (arrow).
AAは,汎血球減少と骨髄低形成を特徴とする症候群である1).2004年から2012年の9年間のAAの罹患数は約9,500人といわれており,罹患率は年間で100万人あたり8.2人程度とされている.AAは先天性と後天性に分けられ,AAのほとんどが後天性である.しかし,後天性AA患者の手術症例は極めて少なく,周術期管理について述べた報告はほとんどない.AA患者の周術期には,貧血・出血傾向・易感染性の全てが問題となるため,慎重な管理が必要となる.管理方法が確立していないため,現状では汎血球減少に対する一般的な周術期管理を参考にして対応している.
医学中央雑誌で1990年から2018年の期間で「再生不良性貧血」,「大腸癌」,「手術」,「穿孔」をキーワードとして検索した結果,AAを合併した消化管手術は5例であった6)~10).その内大腸癌手術は2例,穿孔症例は1例のみであった6)~8).
また,AAに対する手術症例報告は極めて少数であり,厚生労働省医薬・生活衛生局による「血液製剤の使用指針」では,AA患者における慢性貧血に対してはHb 6.0~7.0 g/dl,一般的な周術期貧血の場合はHb 7.0~8.0 g/dlをトリガーポイントとしてRCC輸血を考慮することが推奨されている.また,術前の血小板数は,5.0×104/μlを維持することが推奨されている.慢性経過の血小板減少で出血傾向を来さず安定している場合は,Plt 0.5~1.0×104/μl程度であっても重篤な出血を来すことはまれといわれている4).PC輸血により同種抗体が産生され,輸血不応状態となる恐れがあるため,安易なPC輸血は避けるべきである11).三代ら7)は,術後に抗HLA抗体が出現しPC輸血不応状態となったため,HLA適合PC輸血を行ったと報告している.本症例では,PC輸血への反応が良好であることを確認したうえで,術前日までにPlt 9.0×104/μl,Hb 7.2 g/dlと耐術可能な数値に是正し,術後はPlt <1.0×104/μl,Hb <6.0 g/dlをトリガーポイントとしてPC,RCCを輸血した.
好中球数に関しては,500/μl未満で日和見感染を来しやすくなるといわれている.好中球減少症に対してはG-CSFの有効性が認められ,臨床応用が広く行われている.AAでも感染症併発時やハイリスク症例においては,G-CSF使用にて好中球数を増加させることが有用であると報告されており,術前評価で反応性を確認し,適切に使用することが推奨される12).本症例ではG-CSFの反応は不良であったため,特別な感染対策を行うことはできなかった.術中所見で膿瘍を完全に切除できたと判断したため,通常手術と同様の抗生剤投与方法を選択したが,結果的に術後腹腔内膿瘍を来してしまった.本症例では,周術期抗生剤としてより広域に,より長期間使用していれば,術後感染防止に繋がった可能性があることは否定できない.また,前回手術では吻合にリニアステープラーが使用され,結果的に反復する吻合部潰瘍を来すこととなった.本症例のように免疫抑制剤の持続的使用や,貧血による血流不全により,想定以上に組織脆弱となる可能性がある患者に対しては,手縫い吻合を選択することも検討すべきだったと考える.
本症例ではPC,RCC輸血を基盤にして,AAで問題となる貧血・出血傾向・易感染性に慎重に対応したことで,消化管穿孔を伴う周術期であったが大きな合併症を引き起こすことなく良好な結果を得た.AAにおける周術期には,術前より十分な評価のうえ,適切な輸血療法を軸に管理することが重要であると考える.
利益相反:なし