2022 年 55 巻 8 号 p. 483-490
2022 年 55 巻 8 号 p. 483-490
免疫チェックポイント阻害薬(immune checkpoint inhibitor;以下,ICIと略記)は免疫機序を介すると考えられている免疫関連有害事象(immune-related adverse events;以下,irAEと略記)の発生が問題となっている.今回,切除不能進行食道癌に対して3rd lineでニボルマブを使用したところ,4コース施行後にICI関連結核を発症した.6か月の休薬期間を経て結核治療と並行しニボルマブを再開すると,再投与3週間後にirAEである肝障害・腎障害に加えて,免疫性血小板減少性紫斑病を発症した.入院でのステロイド治療が開始となり,治療開始から2週間で血小板は正常まで回復し,肝障害や腎障害も改善した.治療開始後1か月で軽快退院となった.現在,ニボルマブの最終投与から約3か月経過しているが,腫瘍の進行を認めていない.
Immune checkpoint inhibitors (ICIs) may cause immune-related adverse events (irAEs) mediated by immune mechanisms. Here, we report a case of unresectable advanced esophageal cancer in which severe irAEs developed due to an ICI. The patient was a 79-year-old male who was diagnosed with unresectable advanced esophageal cancer and underwent immunotherapy as third-line treatment. After four courses of immunotherapy, the patient developed ICI-related tuberculosis (TB). Immunotherapy was discontinued and TB treatment was given priority. Six months later, nivolumab was resumed in parallel with TB treatment, but three weeks after resumption of immunotherapy, immune thrombocytopenic purpura developed, in addition to immune-related liver and renal damage. Steroid treatment for irAEs led to normalization of platelet counts and improvement of liver and renal damage after two weeks. The patient was discharged from hospital after one month of this treatment. After discharge, there was no evidence of tumor progression for three months after the last administration of nivolumab.
免疫チェックポイント阻害薬(immune checkpoint inhibitor;以下,ICIと略記)であるニボルマブはT細胞活性化を介して抗腫瘍効果を呈するモノクローナル抗体であり,癌免疫療法として広く使用されている.悪性黒色腫,非小細胞肺癌,腎細胞癌,胃癌,食道癌などさまざまな癌腫においてその有効性が示されている一方で,免疫機序を介すると考えられている免疫関連有害事象(immune-related adverse events;以下,irAEと略記)の発生が問題となっている1).irAEでは,従来の薬剤ではまれな有害事象の報告を認めており,時に重篤化するため,適切なマネジメントが重要となる.今回,irAEである肝障害・腎障害のみならず,活動性肺結核・免疫性血小板減少性紫斑病といったまれな有害事象を発症した食道癌症例を経験したので,文献的考察を加えて報告する.
症例:79歳,男性
主訴:腰痛
現病歴:腰痛で前医整形外科受診しMRIで第一腰椎に病的骨折が疑われたために当院紹介となった.CTにて偶発的に胸部中部食道癌が疑われた.上部消化管内視鏡検査で切歯より29~34 cmの範囲に亜全周性の腫瘍性病変を認め(Fig. 1),生検結果は低分化型扁平上皮癌であった.CTでは多発リンパ節転移や多発骨転移も認めた(Fig. 2).上記より,根治切除不能進行食道癌(cT3N4M1(骨),cStage IVB)と診断し化学療法の方針とした.

Upper gastrointestinal endoscopy showed a sub-circumferential tumor 29–34 cm from the incisor (A), although it was possible to pass through the scope (B). A biopsy indicated poorly differentiated squamous cell carcinoma.
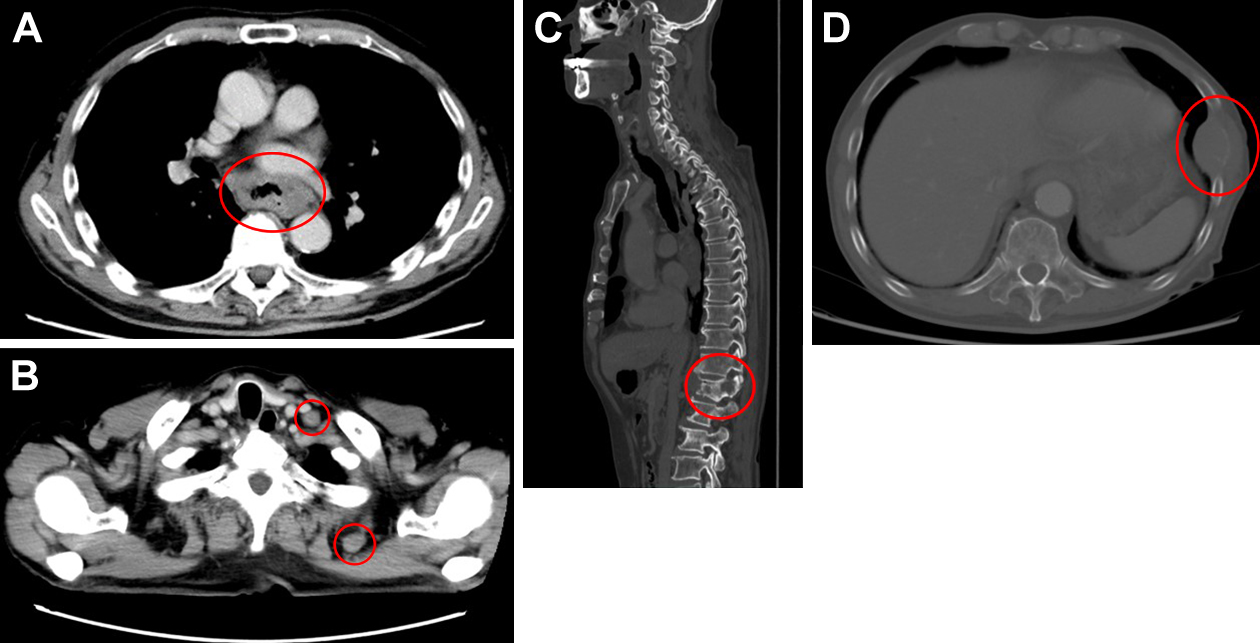
CT showed esophageal cancer (A), multiple lymph node metastases (B), and multiple bone metastases (C, D).
既往歴:高血圧症
家族歴:母が結核で死亡
BCG接種歴:あり.
喫煙:30本/日(20~60歳)
飲酒:ビール1本,日本酒1合を毎日
現症:身長168 cm,体重54 kg,BMI 19.1 kg/m2,PS=0
血液検査所見(ニボルマブ治療開始前):WBC:10,470/μl,Hb:8.6 g/dl,Plt:28.1×104 μl,AST:26 U/l,ALT:17 U/l,T.Bil:0.45 mg/dl,BUN:30.0 mg/dl,Cr:1.51 mg/dl,HBS-Ag(–),HBV-DNA(–),HCV-Ab(–),HIV-Ag.Ab(–),HTLV-1Ab(+),CEA:89.1 ng/ml,CYFRA:71.7 ng/ml,SCC:2.6 ng/mlであった.
治療経過:診断同月に化学療法(フルオロウラシル800 mg/m2+シスプラチン50 mg/m2療法)を開始し3コース施行した.化学療法開始3か月後にCTで骨転移の増悪を認めたため,二次化学療法として,パクリタキセル(100 mg/m2)に変更した.3コース施行後(二次治療開始5か月後),CTで原発巣と骨転移は縮小傾向にあったものの,CEAが上昇傾向で,手足のしびれやふらつきによるADLの低下を認めたため,三次療法としてニボルマブ(240 mg/14日毎)を開始した.ニボルマブを4コース施行するも骨転移の増大を認めたため,治療効果PDと判断し治療を終了した.ニボルマブ終了1か月後(三次治療開始3か月後),しびれやADLは改善した.腫瘍マーカーも4コース施行前と比較して低下を認めた(CEA:治療前:171.5,治療後:16.8(ng/ml)).CT上,食道癌原発巣は著変認めなかったが,骨転移巣は一部で縮小を認めた.一方,右肺S6に結節影の集簇を認め,肺結核が疑われた(Fig. 3).喀痰検査を施行したところ,肺結核の診断となったため(喀痰抗酸菌検査:陽性(ガフキー1号),TB-PCR:陽性),同日より結核治療が開始となった.
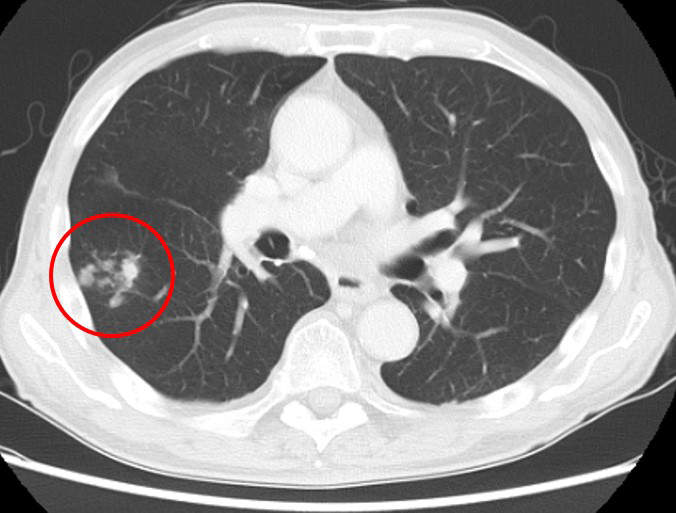
Pulmonary nodules were found in S6 of the right lung and tuberculosis was suspected.
ニボルマブ最終投与から6か月後,CTで食道癌原発巣や骨転移巣に大きな変化を認めず,腫瘍マーカーも大きな変化を認めなかったため(CEA:24.5 ng/ml,CYFRA:7.3 ng/ml,SCC:5.0 ng/ml),ニボルマブによる遅発性の効果が発現しているものと判断した.腫瘍マーカーの推移については,ニボルマブ4コース施行後から低下傾向にあり,約半年の休薬期間中も腫瘍マーカーの上昇を認めなかった.また,ニボルマブ最終投与から3か月経過後も腫瘍マーカーの上昇を認めていない(Fig. 4).このため結核治療と並行してニボルマブを再開した.しかし,ニボルマブ再投与3週間後,口腔粘膜出血や四肢の多数の皮下出血とgrade 4の血小板減少(2,000/μl)を認めたため,irAEによる免疫性血小板減少性紫斑病と診断した.また,grade 4の肝障害(AST:1,545 U/l,ALT:745 U/l,T-Bil:8.42 mg/dl)とgrade 2の腎障害(Cr:2.77 mg/dl)も併発していたため,入院でステロイド治療を行った.ステロイド治療(1週目:メチルプレドニゾロン:125 mg/日,2週目:100 mg/日)は奏効し,治療開始2週間で血小板は正常値となった.肝障害はgrade 2,腎障害はgrade 1とともに改善を認めた(Fig. 5).その後,ステロイドの減量(3週目:80 mg/日,4週目:60 mg/日)を経て,治療開始後1か月で軽快退院となった.以降もプレドニゾロンを減量している.現在,ニボルマブの最終投与から約3か月経過しているが,腫瘍の進行を認めていない.結核治療は継続しており,ニボルマブの再開予定はない.
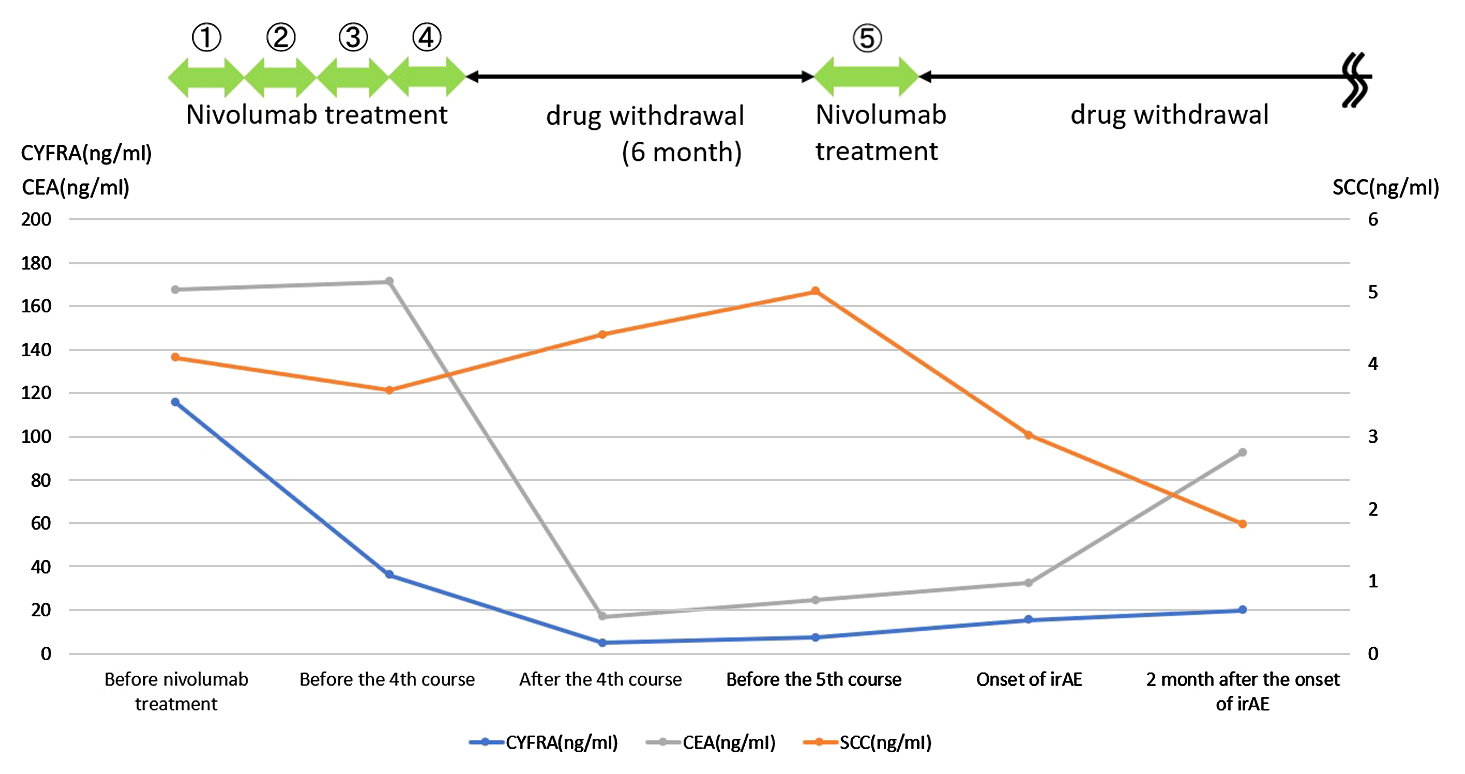
Tumor marker transitions. Tumor marker levels decreased after the 4th course of nivolumab. Nivolumab treatment was then discontinued for half a year, but tumor marker levels did not increase. There was also no increase in tumor marker levels for 3 months after the final administration of nivolumab.

Laboratory data. After 2 weeks of steroid treatment, platelet counts normalized and liver damage improved to grade 2 and renal damage to grade 1.
ニボルマブはICIの一つであり,広くがん免疫治療に使用されている.食道癌においては,第III相試験ATTRACTION-3の結果を経て2),2次以降の標準治療となった.ICIは免疫抑制系を阻害することで抗腫瘍効果を示す一方,さまざまな臓器でirAEを来すことが知られている.irAEは,ICIによりじゃっ起された免疫寛容に働く細胞を抑制する可能性が指摘されており,それによって過剰な免疫応答を起こし,さまざまな自己免疫疾患様の反応を引き起こすと考えられている1).こうしたICIによるirAEは,従来の殺細胞性抗癌剤や分子標的薬とは大きく異なり,皮膚や消化器,呼吸器,甲状腺,下垂体などさまざまな臓器に及び,時に重篤化するために治療の中断を余儀なくされる例も少なくなく,適切にマネジメントすることが重要である.我々は根治切除不能進行食道癌に対して,ニボルマブを使用した結果,異時性に結核と免疫性血小板減少性紫斑病の併発を認めた.医学中央雑誌で1964年から2021年10月の期間で「免疫チェックポイント阻害薬,食道癌,結核」,「免疫チェックポイント阻害薬,食道癌,免疫性血小板減少性紫斑病」をキーワードに検索したところ,報告はなかった.また,MEDLINEでも同様に調べた結果,報告はなかった.一方,他癌腫では,結核については,非小細胞肺癌(7例),悪性黒色腫(3例),頭頸部癌(3例),ホジキンリンパ腫(1例),メルケル細胞癌(1例),組織型不明肺癌(1例)3),血小板減少性紫斑病については,悪性黒色腫(4例),非小細胞肺癌(1例),ホジキンリンパ腫(1例)4)~8)と報告を認めたものの,いずれも少数にとどまった.
ICI関連結核について,発症機序は現段階で不明な部分が多いが,PD-1/PD-L1経路が結核の病態に関与している可能性がある9).PD-1/PD-L1経路を阻害することによる腫瘍関連マクロファージや抑制性Tリンパ球の脱抑制による機序10),免疫再構築症候群様の機序が示唆されている11).発症時の一般的な対応は,ICIの中止と抗結核薬投与となるが,免疫再構築症候群の観点からステロイド投与が効果的であった報告もある12).しかしながら,ステロイド投与はまだ確立した治療ではなく,結核発症後のICI治療再開の安全性についても報告はなく,今後の検討が必要である.本症例ではICIの投与時期を考慮すると,初回のICI投与が結核の発症に関与した可能性が高い.他癌腫での過去の報告によると,ICI開始してから結核発症までは1か月から24か月(中央値:6.3か月)であった3).結核診断後,速やかにICIを中止し,抗結核薬治療により良好な治療経過が得られた.現在に至るまで結核の再燃は認めていない.ICI中止後も1年以上にわたり,結核再燃や腫瘍増悪を認めていないという報告もあり13),抗結核薬とICIを併用することで安全かつ効果的に治療することができる可能性がある14).ICI関連結核の発症リスクはいまだ解明されていないが,担癌状態であることに加えて,結核既往や免疫低下となりうる糖尿病や腎不全,免疫抑制剤の使用といった一般的な結核発症のリスクがある患者に起こりやすいと推測する.本症例では結核の既往はなかったものの,結核で死亡した家族がいたことから,結核を保菌していた可能性は十分にある.結核発症のリスクが高い症例では,ICI投与前にinterferon-gamma release assays(以下,IGRAと略記)検査が推奨されている.IGRA陽性の場合,発症予防の薬物療法を勧めるまでのエビデンスには乏しい.しかし,本症例のように明らかな結核既往のない症例での判断は難しいが,IGRAがICIによる結核再燃を予測する判断材料の一つとなるかもしれない.
免疫性血小板減少性紫斑病について,ICIは一般的に細胞障害性抗癌剤のように直接骨髄抑制を来すことで血球減少を生じることは少なく,CD8(+)細胞によるIFN-γなどを介した機序がある15).また,T細胞のみならず,B細胞にも影響を及ぼす可能性が示唆されている6).しかし,まだ不明な点が多いのが現状でありさらなる研究が必要である.
また,重度の血球減少は基礎疾患にリンパ腫を持つ患者にみられやすく16),本症例でもHTLV-1抗体が陽性であった.
半年間の休薬期間を経てICIを再開し,その3週間後に血小板減少や紫斑が出現した.同時にgrade 4の肝障害とgrade 2の腎障害を併発した.これらgrade 3以上のirAEの治療は,以下の通りAmerican Society of Clinical Oncology Clinical Practice Guideline17)に基づいて行うことが一般的である.ICIを中止のうえ高用量コルチコステロイドによっても症状の改善が認められない場合は,免疫グロブリンやインフリキシマブなどの免疫抑制剤の投与が必要となる6)7).さらに,これらにも治療抵抗性のある症例で,トロンボポエチン受容体作動薬投与で改善したという報告がある8).本症例では,高用量の副腎皮質ステロイドで改善を認めた.また,本症例のように消化管腫瘍の場合,肝障害による凝固障害や血小板減少を併発した場合には消化管出血に至るリスクが高まるため,消化管出血に対する注意も必要となる.
ICIの治療効果発現について,irAEを発症した症例では非発症群と比較してICIの抗腫瘍効果やそれに伴う無増悪生存期間や全生存率が良好であることが報告されている18)~20).また,irAEが多臓器にわたる場合は,腫瘍抑制効果が高く,全生存期間が延長するとの報告もある21).さらに,ICIは投与中止しても治療効果は一部残存する可能性も報告されている22)23).本症例のように,irAEを発症したため,ステロイド投与が必要となった場合には,ICIの効果との相関性が問題となるが,Skribekら24)は,irAEによるステロイド投与はICIの有効性を妨げず,未投与群との比較でも全生存期間に影響を及ぼさないことが報告されている.本症例では,治療効果発現時期とirAE発症時期が異なり評価が難しいが,irAEの発症と長期の抗腫瘍効果が確認できた.また,irAEの治療としてICIの投与中止とステロイド治療の開始に至ったものの,その後も腫瘍抑制効果を維持することができた.このことからも,ICIに対するステロイド治療の影響は限定的であったと考える.
ICI投与により,免疫性血小板減少性紫斑病と活動性肺結核を発症した食道癌の1症例を経験した.ICI治療を行う際には,治療効果発現が遅発性に現れる可能性があること,および複数のirAEが異時性に生じえる可能性があることを念頭に,それぞれのirAEに対して適切な対応が必要である.
利益相反:なし