2020 年 27 巻 1 号 p. 32-38
2020 年 27 巻 1 号 p. 32-38
【目的】痛みの評価はVASなど主観的方法が汎用されている.客観的評価ツールであるPainVision(PV)が痛みの測定に有用であるか,外用NSAIDsの薬効をPVとVASで評価した.【方法】被検者は成人ボランティア33名とした.試験薬剤はインドメタシン・ケトプロフェン・ジクロフェナク・フェルビナクを主成分とする外用NSAIDs 19剤を用いた.鎮痛効果はPVとVASを用いて検討した.【結果】PVとVASはr=0.681(p<0.01)と相関を示した.クリーム剤のミカメタン,テイコク,ユートクはインテバンに比べ有意差をもって強い鎮痛効果を示した(p<0.05).ゲル剤のエパテック,ナボールはイドメシンに比べ有意差をもって強い鎮痛効果を示した(p<0.05).【結論】PVが痛みの評価に有用なツールである可能性を示した.外用NSAIDsは主成分や剤型により鎮痛効果が異なるため,医師や薬剤師が薬剤を選択する際には,鎮痛強度の違いを考慮すべきである.
臨床において痛みはvisual analogue scale(VAS)やnumerical rating scale(NRS)など簡便なツールが汎用されている.しかし,これらは主観的であるため,個々の患者の痛みの推移を捉えることはできても,患者間の比較や治療効果の定量的な分析は困難である1).VASは測定時の雰囲気や患者の身体的状態に影響を受け評価が大きく異なる可能性があり,測定誤差が±20%生じる2).また,患者によっては治療開始後もVASやNRSに変化がなく治療の評価を困難にすることがある.これらの状況に対処するため,客観的な痛みのツールが必要とされている.
客観的に痛みを評価する目的で知覚痛覚分析装置PainVisionTMPS-2100 system[PV(NiproCo, Osaka, Japan)]が開発され,帯状疱疹や術後疼痛評価など臨床的有用性について報告されている3,4).われわれもPVが痛みの評価に有用であることを示した5,6).PVは被験者が感じる最小の電気刺激量を電流知覚閾値(current perception threshold:CPT)と,患者が感じている痛みに対応した電流量を痛み対応電流量(pain compatible current:PCC)と定義し,痛み度(pain degree:PD)として評価する.
NSAIDsはステロイド作用を持たない抗炎症薬の総称で,臨床で汎用されている7).外用NSAIDsは経口NSAIDsに比べ消化管出血,腎障害,心血管障害などの副作用が少なく安全に使用できるため,各種ガイドライン(GL)で推奨されている8,9).外用NSAIDsはGLにおいて成分や剤形によらず一括してTopical NSAIDsと記載されているため,薬剤選択を煩雑にしていると考えられる.
今回,外用NSAIDsの薬効をPVとVASで評価し相関関係を求めたのちに,外用NSAIDsを基剤ごとに分類し鎮痛効果を評価した.
被検者は,同意を得た健常成人ボランティアで,製剤ごとにケトプロフェン9名,インドメタシン10名,フェルビナク9名,ジクロフェナク5名の計33名を対象とした.全ての被験者に対して事前に書面でインフォームドコンセントを取得し,署名を得た.被験者の適格基準として下記条件を満たすものとした.①年齢が18歳以上65歳未満であること.②急性または慢性疼痛の治療中でないこと.③基礎疾患として精神疾患,認知障害,神経障害,喘息がないこと.④鎮痛薬,中枢神経系用薬を服用中でないこと.⑤インフォームドコンセントを本人から得られること.⑥NSAIDsによる副作用歴がないこと.⑦テープ剤でかぶれないこと.⑧皮膚疾患がなく皮膚の状態が安定していること.
本研究は帝京大学倫理委員会の承認を得て行われた(帝倫12–096号).
2. 試験薬剤2011年に国内で薬価収載されていたインドメタシン・ケトプロフェン・ジクロフェナク・フェルビナクを主成分とするクリーム,ゲル,軟膏の19剤を使用した(表1).
| 基剤 | 成分 | 対象薬剤 | |
|---|---|---|---|
| 先発医薬品 | 後発医薬品 | ||
| クリーム | インドメタシン | イドメシンコーワクリーム1% TM (イドメシン) |
ミカメタン®クリーム1% (ミカメタン) |
| インテバン®クリーム1% (インテバン) |
インナミットクリーム1% TM (インナミット) |
||
| ジクロフェナク | エパテック®クリーム (エパテック) |
ジクロフェナクNaクリーム1%「テイコク」 TM (テイコク) |
|
| ジクロフェナクNaクリーム1%「ユートク」 TM (ユートク) |
|||
| フェルビナク | ナパゲルン®クリーム3% (ナパ) |
||
| ゲル | インドメタシン | イドメシンコーワゲル1% TM (イドメシン) |
|
| ケトプロフェン | セクター®ゲル (セクター) |
||
| エパテック®ゲル (エパ) |
|||
| ジクロフェナク | ボルタレン®ゲル1% (ボルゲル) |
アデフロニック®ゲル1% (アデフロ) |
|
| ナボール®ゲル1% (ナボール) |
ジクロフェナクNaゲル1%「ラクール」 TM (ラクール) |
||
| ジクロフェナクNaゲル1%「日本臓器」 TM (ゾーキ) |
|||
| ベギータ®ゲル1% (ベギータ) |
|||
| 軟膏 | インドメタシン | インテバン®軟膏1% (インテバン) |
|
| フェルビナク | ナパゲルン®軟膏3% (ナパ) |
||
被験者は利き手にPVの電気刺激を感じたことを知らせるハンドスイッチを持ち,前腕肘部内側に電極を貼付した(図1).PVは痛みを伴わない刺激電流(50 Hz,パルス幅0.3 ms)を0 µAから発生させ,漸増するよう設定された.刺激電流を開始し患者が刺激を感じたときにハンドスイッチを押し,その時の電流の大きさをCPTとした.次に,感じている痛みと同等の刺激電流を感じたときにハンドスイッチを押し,その時の電流の大きさをPCCとした.PDは3回測定したCPTとPCCから以下の式で自動計算された.

PainVisionの測定方法
利き手にハンドスイッチを持ち,電極パッドを貼付した.反対側の腕に痛みを発生させた.
PD=(PCC−CPT)/CPT
4. 痛みの評価方法ハンドスイッチを持たない前腕肘部内側に,300 gの重りを負荷した直径3 mm,長さ34.8 cm,先端が1.5 mmに削られているアルミ製のロッドを用いて痛みを発生させた.0.4 gの試験薬剤を腕の内側に塗り,その上をTegadermTM[6 cm×7 cm(粘着性透明創傷被覆保護剤)]で覆った.痛みの測定時はTegadermTMを剥がし,ロッドによる痛みを負荷した後に評価した(図1).痛みの評価は客観的なツールとしてPV,主観的なツールとしてVASを用いた.痛みは薬剤塗布直前(0分)から薬剤塗布後30分,60分,90分後にVASで評価した後にPVを各3回測定した.試験薬剤を変更する場合は交互作用を避けるためジクロフェナク軟膏の半減期4.8時間10),薬効消失は半減期の5倍が目安になる11)ことを参考に1日以上の休薬期間を設けた.
5. 統計解析全ての統計解析はEZRを使用した12).EZRはRおよびRコマンダーの機能を拡張した統計ソフトであり,自治医科大学附属さいたま医療センターのホームページで無償配布されている.PDとVASの相関はSpearmanの順位相関係数により評価した.
痛みの経時データに関しては0分を1とし,各時点の値は比を用いた.解析には最大反応を示した30分と60分の平均値を用いた13,14).クリーム剤の薬効はインテバン®クリーム1%を対照としたKruskal-Wallis検定のpost-hoc検定steelの多重比較により評価した.ゲル剤の薬効はイドメシンコーワゲル1%を対照としたKruskal-Wallis検定のpost-hoc検定steelの多重比較により評価した.軟膏の薬効はt検定により評価した.また,統計学的有意水準はp<0.05とした.
PDとVASの測定値はSpearmanの順位相関係数r=0.681(p<0.01)と強い相関が認められた(図2).

痛み度とpain degreeの相関関係
Spearmanの順位相関係数r=0.681(p<0.01).
クリーム剤のミカメタン(インドメタシン)0.545(p=0.03),テイコク(ジクロフェナク)0.557(p=0.03),ユートク(ジクロフェナク)0.484(p=0.009)はインテバン(インドメタシン)0.795に比べ有意差をもって強い鎮痛効果を示した(図3a).
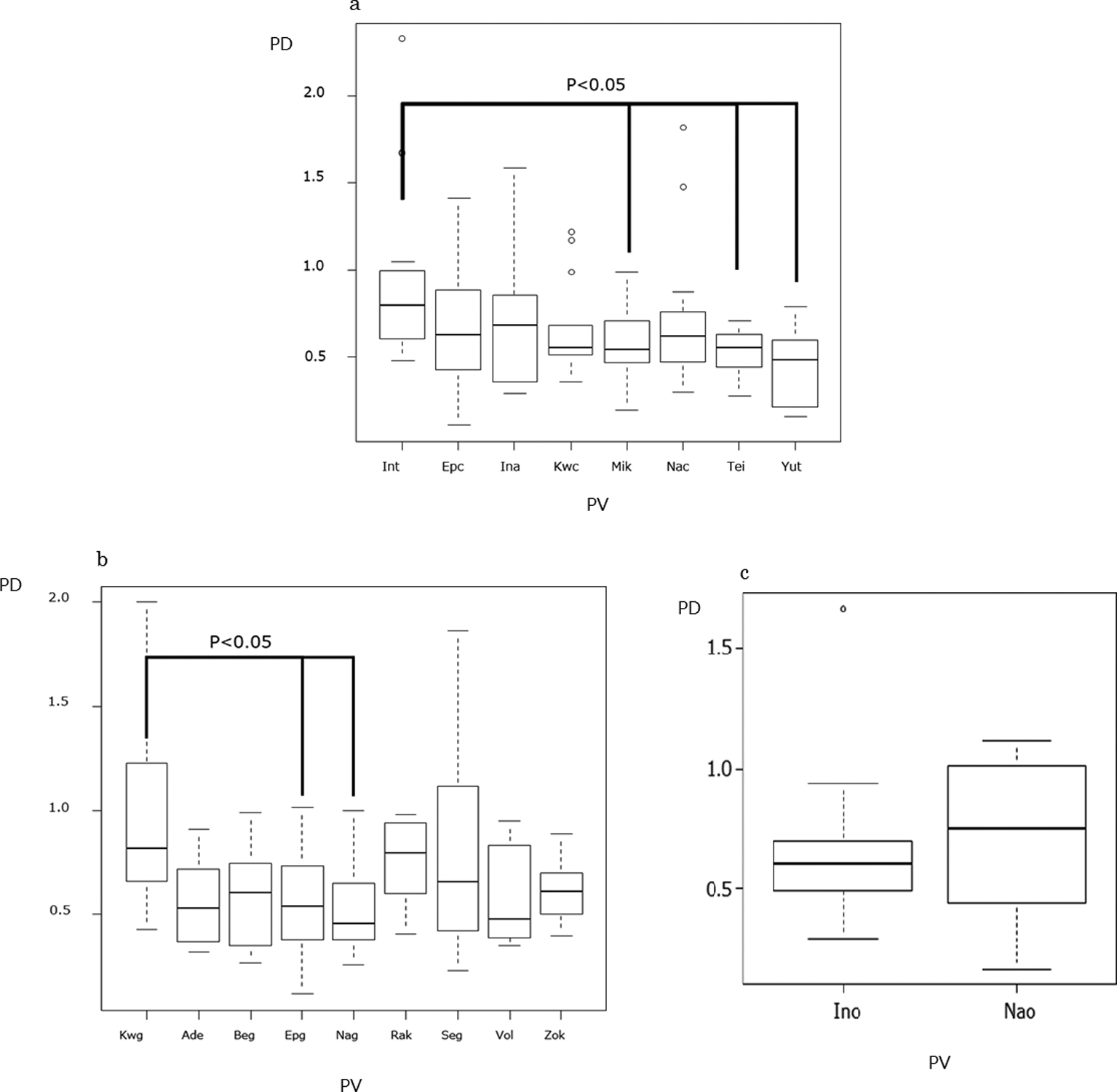
剤型別 鎮痛効果の比較
(a:クリーム剤)Int:インドメタシン,Epc:エパテック,Ina:インナミット,Kwc:インドメシンコーワクリーム,Mik:ミカメタミン,Nac:ナボール,Tei:ジクロフェナククリームテイコク,Yut:ジクロフェナククリームユートク
(b:ゲル剤)Kwg:インドメタシンコーワ,Ade:アデフロニック,Beg:ベギータ,Epg:エパテック,Nag:ナボール,Rak:ジクロフェナクNaゲルラクール,Seg:セクター,Vol:ボルタレン,Zok:ジクロフェナクNaゲルゾーキ
(c:軟膏剤)Ino:インテバン,Nao:ナボール
ゲル剤のエパテック(ケトプロフェン)0.540(p=0.048),ナボール(ジクロフェナク)0.455(p=0.031)はイドメシン(インドメタシン)0.820に比べ有意差をもって強い鎮痛効果を示した(図3b).
軟膏剤のナパ(フェルビナク)とインテバン(インドメタシン)は鎮痛効果に違いを示さなかった(p=0.631)(図3c).
PDとVASは有意な相関を認め,痛みの評価方法としてPVが有用な痛みの評価ツールであることを示した.井関ら3)は慢性疼痛患者32例を調査し,PDとVASの相関係数はr=0.692であったと報告している.また,三舩ら4)は55例を2群に分け手術後のPDとVASはr=0.59(p=0.006),r=0.62(p=0.003)と報告している.本研究においても先行研究と同様の結果が得られた.本研究の強みは,被験者33名で1名あたり4回痛みを測定しているため,先行研究と比較しデータ数が多いことが挙げられる.
VASは痛みの評価に汎用されているが,主観的なことが問題とされることがある.また,VASは痛みの微細な変化を評価できないとの報告もあり15),患者の状態に影響されない客観的評価ツールが必要とされてきた.PVはパルス電流という絶対的基準を用いることにより客観性を担保し,電気刺激を認知する個体差,測定条件によるバラツキをCPT(漸増するパルス電流に対する敏感さ)で補正することで客観性を高めている16).PVは手術後疼痛の評価に有用なツールである可能性が報告されており4,17),鎮痛薬の薬効評価においても有用であることが期待できる.PVを用いて多様な薬剤の鎮痛効果を評価することで薬剤ごとの鎮痛効果をPDとして定量化でき,薬物選択に貢献することが期待できる.
さらに,一部の薬剤において鎮痛効果に有意差を認めた.クリーム剤は,インテバン(インドメタシン)とミカメタン(インドメタシン),テイコク(ジクロフェナク),ユートク(ジクロフェナク)の比較において鎮痛効果に有意差を認めた.ゲル剤はイドメシン(インドメタシン),エパテック(ケトプロフェン),ナボール(ジクロフェナク)の比較において鎮痛効果に違いを認めた.Derryら18)のメタアナリシスによるとケトプロフェンゲルのNNTは2.5,ジクロフェナク(剤形不明)は7,インドメタシンは8.3と報告されており,本研究でもインドメタシンに比べジクロフェナク,ケトプロフェンは有意に強い鎮痛効果を認めた.ネットワークアナリシスによるとジクロフェナクゲルのstandardised mean differenceは−0.30,ケトプロフェン−0.09,インドメタシン0.01と報告されており19),本研究のゲル剤においても同様の結果を認めた.
局所皮膚適用製剤の後発医薬品のための生物学的同等性試験ガイドライン(生GL)において同等性の許容域を,正規分布を示し作用が強い医薬品以外は±0.30と設定されている20).本研究ではインドメタシンにおいて先発医薬品(〈先〉)インテバン®クリーム0.795と後発医薬品(〈後〉)ミカメタン0.545は許容域以上の薬効差を認めた.ジクロフェナク製剤では,〈後〉ラクール0.795と〈先〉ナボール0.455,〈先〉ボルゲル0.480,〈後〉アデフロ0.530は許容域以上の薬効差を認めた.インドメタシン製剤は〈先〉と〈後〉において,ジクロフェナク製剤は〈先〉と〈後〉,〈後〉同士で許容域以上の薬効差を認めた.これら薬効差を認めた原因として,生GL発行以前に薬価収載されているため生GL適用外であること,採用された生物学的同等性試験が異なることが,ヒトを対象にした本研究と異なる結果を認めた可能性がある.
わが国でNSAIDsはすでに50種類以上処方薬として使われているが,全て同じ薬物群として考えて良いのだろうか7).NSAIDsの主な作用機序はCOX阻害作用とされているが,薬剤によりIKK-βの活性化を阻害することによるNF-κB活性化阻害作用,転写因子であるPPAR-γを活性化することによるサイトカインなどの炎症起因分子の発現抑制作用,NO-cGMP-K+チャネル阻害やTRPイオンチャネル阻害といったCOX阻害以外の機序が認められている7,21).マウスにおける侵害熱刺激の感知は皮膚に分布しているTRPM3,TRPV1およびTRPA1に依存していることが示されており21),ジクロフェナクがTRPM3依存性の痛覚抑制に寄与する可能性が報告されている22).また,本研究と似た報告として,NSAIDsゲルは健常人ボランティアに機械刺激を負荷した状態で鎮痛効果を示した14).本研究においても,外用NSAIDsの局所投与部位における鎮痛作用にCOX以外の作用機序が関与しうることを示唆する.
腰痛を有する患者は非常に多く厚生労働省の国民生活基礎調査によると有訴者率,受診率ともに例年上位を占めている23).腰痛の定義は曖昧で疼痛部位,有症期間,原因別による分類により定義される23)が炎症の有無に関する記載はない.ナパゲルンクリーム・ローション・軟膏やスミルスチック3%TMは必ずしも炎症を伴わない筋・筋膜性腰痛症に対して適応を持っている.コクランレビューにおいて外用NSAIDsは慢性の骨格筋疼痛,背部痛の患者に対し有効性が示されている18).これらのことからも外用NSAIDsは炎症の有無にかかわらず処方され有効性を示している可能性がある.
海外の変形性関節症のガイドラインでは痛みの治療に副作用予防のため外用NSAIDsが第一選択薬として推奨されている8,9).外用NSAIDsは米国のガイドライン2014年度版では推奨薬の一つだったが24),2019年度版は日常診療により即するため,併存疾患を考慮した患者中心の内容に改定され,第一選択薬として強く推奨すると記載されている9).日本の外用NSAIDsは247剤も保険適応されているが25),本研究や先行研究26)において同成分でも薬効差が認められていることから選別が必要であると考える.海外に比べ日本は外用NSAIDsの処方量が多いため27),日本発の質の高いエビデンスを発信する条件は整っている.
基剤が鎮痛効果に及ぼす影響として,人工膜またはヒト表皮を用いた研究によると,クリーム剤は一般にゲルまたはスプレーより効果が低く,マイクロエマルジョンなどの新しい剤型はより強い鎮痛効果を示す可能性がある18).ラットを用いた研究においてケトプロフェンテープ剤9剤の抗炎症効果を比較したところ製剤間で差を示し,添加物等が異なることが原因だと考察している26).本研究で使用した試験薬剤は添加物や薬効を示すl–メントール28)の有無など組成が異なるため,浸透性などに影響を及ぼすことで鎮痛効果に差を認めた可能性がある.
鎮痛効果の解析に最大反応を示した30分と60分の平均値を用いた13).健常ボランティアに痛みを負荷し外用NSAIDsの薬効を評価した研究によると,60分後に最大効果が得られた14)と報告されていることからもデータ選択は妥当であった.
本研究にはlimitationがある.第1に,観察期間が90分と短かった.急性の筋・骨格痛患者への外用剤NSAIDsの有効性を評価したシステマティックレビューでは採用基準の一つに観察期間を少なくとも3日と設定している29)ことからも,本研究の観察期間を長く設定すべきであった.第2に,プラセボを使用していないため被検薬の薬理作用以外のすべての潜在的な影響をコントロールできなかった.プラセボは20~57%の範囲で鎮痛効果を示すことからも,プラセボと比較する必要性が報告されている18).本研究にプラセボを用いることで真の薬効を評価できたと考える.第3に,本研究では信頼性の高い解析をするには母集団の数が少なかった.
本研究ではPVが痛みや鎮痛薬の薬効評価に有用なツールとなる可能性を示した.また,外用NSAIDsは主成分や剤型により鎮痛効果が異なるため,医師や薬剤師が薬剤を選択する際には,鎮痛強度の違いを考慮すべきである.
本論文の要旨は,日本ペインクリニック学会第51回大会(2017年7月,岐阜)で発表した.