2020 年 31 巻 1 号 p. 61-65
2020 年 31 巻 1 号 p. 61-65
難治性造血器疾患に対する根治療法である同種造血幹細胞移植には,様々な合併症が併発することが知られる.そのうち,血栓性微小血管症(thrombotic microangiopathy: TMA)は一旦発症すると高い確率で多臓器不全に進行しうる,極めて重要な合併症である.その診断においては,血小板減少,溶血性貧血,微小循環障害を含んだ複数の基準が提唱されているが,いずれかの徴候が現われた際には,早いタイミングでの暫定診断が重要となる.治療としては,免疫抑制剤の適切なコントロールを含む厳重な全身管理が重要となるが,病態生理に則った根治的な治療法は確立されていない.種々の支持療法技術の向上により,同種移植適応が拡大される中,TMAの診断と治療に関しても,早急に最適化を目指すことが重要な課題である.
血栓性微小血管症(thrombotic microangiopathy: TMA)とは,血小板減少,溶血性貧血,および微小循環不全による臓器障害(急性腎不全,意識障害など)を伴う病態に対して提唱された用語である.その病理学的な所見から,微小血管での血管内皮細胞傷害と血栓形成によって引き起こされる病態と理解されている1).TMAの代表的なものとして,血栓性血小板減少性紫斑病(thrombotic thrombocytopenic purpura: TTP)と溶血性尿毒症症候群(hemolytic uremic syndrome: HUS)がよく知られる.このうち,TTPはvon Willebrand因子(VWF)を切断するプロテアーゼであるa disintegrin and metalloprotease with thrombospondin domain(ADAMTS)13の活性低下と,それに伴う超高分子量VWF重合体(unusually large VWF multimer: UL-VWFM)の残存が原因となる2).一方で,HUSは腸管出血性病原性大腸菌が産生するベロ毒素が主な原因となり,一連の症状を引き起こす3).これらに加えて,妊娠,自己免疫疾患や悪性腫瘍,あるいはそれに対する化学療法や同種造血幹細胞移植が引き金となってTMAを合併する可能性が報告されている.
同種造血幹細胞移植は,造血器悪性腫瘍(急性白血病,悪性リンパ腫など),骨髄不全疾患(再生不良性貧血など),および先天性免疫不全症・代謝疾患(重症複合免疫不全や副腎白質ジストロフィーなど)に対して,根治が期待できる治療法である.一方,移植後の重篤な合併症として,高度な免疫不全に伴う重症感染症や移植片対宿主病(graft-versus-host disease: GVHD)に伴う臓器障害などが知られ,治療関連死亡の主な原因である.さらに,造血幹細胞移植後TMA(hematopoietic stem cell transplantation-associated TMA: TA-TMA)も一旦発症すると高い確率で多臓器不全に進行するため,極めて重要な合併症である.
本稿では,TA-TMAの病態生理や予防,治療法について,最近の新たな知見に基づき概説する.
TA-TMAの発症率は,同種移植全体の10~25%とされるが4),報告によりばらつきがある.典型的なTA-TMAの臨床所見として,急速な貧血進行や破砕赤血球の出現,血小板回復の遅延・輸血不応性,血清LDHの上昇,急性腎不全が知られ,白血球の生着後,移植100日目までに発症することが多い5).約半数で中枢神経症状を認め,頭痛,意識障害,痙攣など多岐に亘る.
TA-TMAの診断に関しては,ヨーロッパ6)および米国7)のグループによって診断基準や重症度基準が提唱され(表1),いずれも血小板減少,溶血性貧血,微小循環障害を反映している.但し,診断に当たっては,類似する異常を呈する他疾患(播種性血管内凝固異常症(disseminated intravascular coagulopathy: DIC),TTP,免疫性溶血性貧血や血小板減少症)の除外が必須であり,凝固機能やADAMTS13活性,抗赤血球・血小板抗体の確認も必要である.また,ごく初期のTA-TMAでは,これらの診断基準に満たない症例も多いため,いずれかの徴候が現われた際には,早いタイミングでの暫定診断と,それに伴う治療介入が重要である可能性もある.
| 1)European Group of Blood and Marrow Transplantation(EBMT)とEuropean Leukemia Net(ELN)の合同ワーキンググループによるTA-TMA診断基準6) |
| ・末梢血中に破砕赤血球の存在(>4%) |
| ・血小板減少(<50,000/μL以下)の進行,遷延 |
| ・血清LDH上昇 |
| ・貧血の進行,赤血球輸血必要量の増加 |
| ・血清ハプトグロビン低下 |
| 2)Blood and Marrow Transplant Clinical Trial Network(BMT-CTN)毒性評価委員会によるTA-TMAの診断基準7) |
| ・末梢血塗抹標本で破砕赤血球の存在(2個以上/強拡大1視野) |
| ・血清LDH値上昇 |
| ・他の原因によらない腎障害または中枢神経障害 |
| ・直接および間接クームス試験陰性 |
| 3)BMT-CTN毒性評価委員会によるTA-TMAの重症度基準7) |
| Grade 1 破砕赤血球(+) |
| Grade 2 破砕赤血球(+),腎障害(Cr<3×ULN) |
| Grade 3 破砕赤血球(+),腎障害(Cr>3×ULN) |
| Grade 4 破砕赤血球(+),透析を要する腎機能障害または脳症 |
ULN: upper limit of normal.
このような状況で,松本らは,治療効果を期待するために,早期診断を考慮した診断基準案として,1)クームス陰性でハプトグロビンが著減(10 mg/dL未満),2)進行性の血小板減少,もしくは血小板輸血翌朝の補正血小板増加数(corrected count increment: CCI)が2,500/μL未満,3)DICを否定,の三項目をあげており,これを満たした状態をPre-TMAとして提唱している8).
TA-TMAの病態生理はまだ完全には解明されていない.発症の原因が明確に同定されているTTPやHUSとは違い,様々な病因が想定されているが,いずれも最終的には血管内皮細胞傷害が腎臓をはじめとした多臓器で発生することが共通の経路と想定されている1).血管内皮細胞傷害の原因としては,前処置における強力化学療法や全身放射線照射,GVHD予防としてのカルシニューリン阻害剤投与や重症GVHDの合併,移植後の重症感染症や抗菌薬の投与,炎症性サイトカイン(インターロイキン1,腫瘍壊死因子αなど)の分泌などが知られている9).
造血幹細胞移植の臨床経過におけるTA-TMA発症のリスク因子について複数の解析がなされているが,代表的な因子としては,移植後の急性GVHDや感染症の合併,非血縁者あるいはヒト白血球抗原不一致ドナーからの移植,女性患者,カルシニューリン阻害剤(calcineurin inhibitor: CNI)やシロリムスの使用などが知られ1, 4),これらの要因を持つ患者群では,TA-TMAの合併率が有意に高く,死亡率も高い.
TTPやHUS発症の病態において,好中球も重要な役割を果たすことが,近年になって報告された10).好中球は,傷害された血管内皮細胞から放出される炎症性サイトカイン刺激などにより活性化され,好中球細胞外トラップ(neutrophil extracellular traps: NETs)とよばれる構造物を細胞外に放出する.NETsは,自己の二重鎖DNAにヒストンや抗菌ペプチド(ミエロペルオキシダーゼやエラスターゼ)が巻き付いた構造物で,当初は,好中球の細胞外殺菌を担う機構として発見されたが11),細胞傷害性が強いため,TTPやHUSの病態において,NETs形成によってさらに血管内皮細胞傷害を増悪させるという負の連鎖を引き起こすことが証明された10).TA-TMAにおいても,腎糸球体血管の血栓閉塞部位にNETsの沈着が認められることや,TA-TMA発症群では同種移植後1ヶ月時点で測定した血中NETs量が非発症群に比べて多いことから,血管内皮細胞傷害・好中球活性化・NETs放出を含んだ負の連鎖が病態に重要である可能性が示された(図1)12).
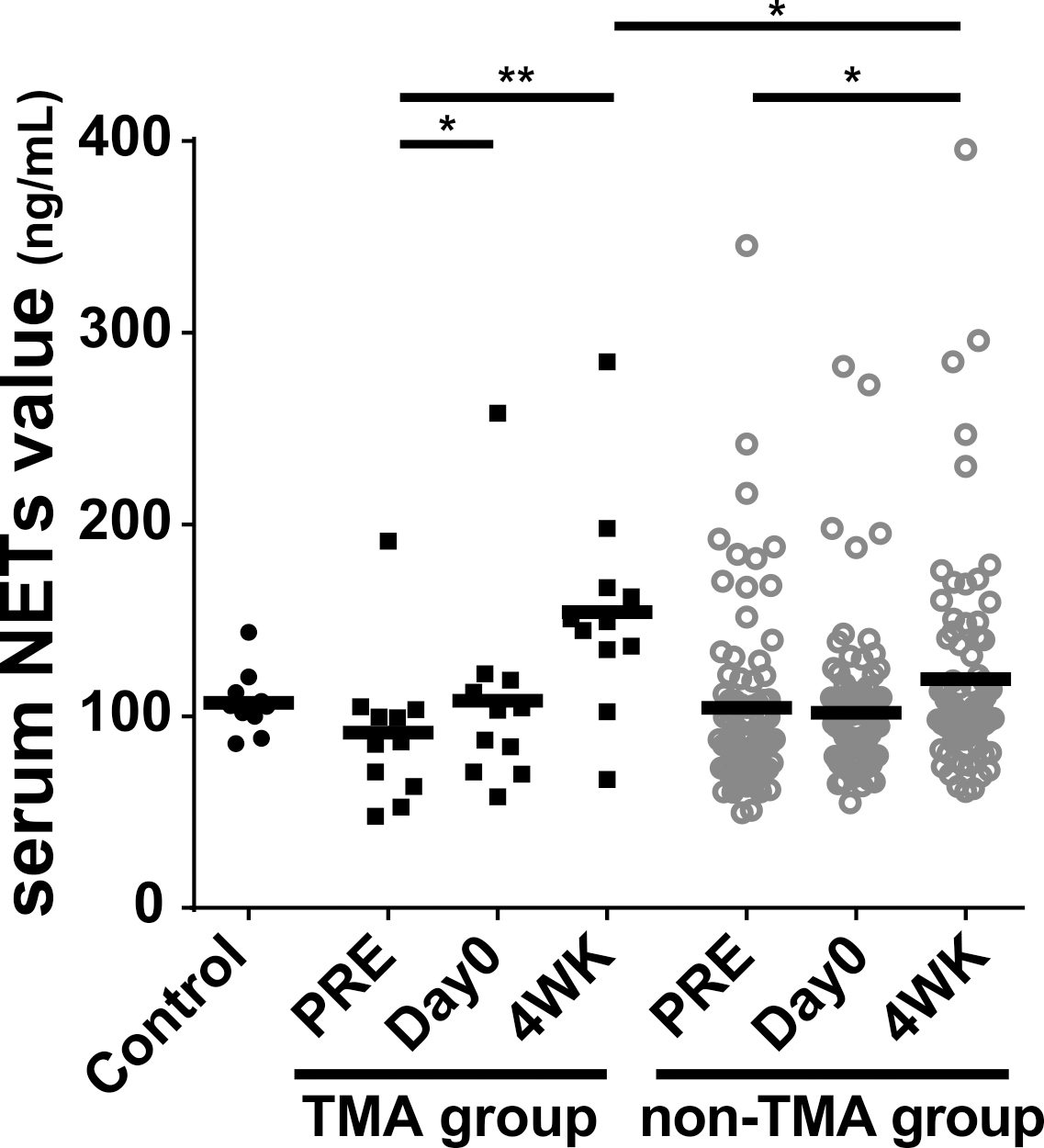
血清NETs値とTA-TMAの関連
TA-TMA発症群(TMA group)と,非発症群(non-TMA group)に分けて,血清NETsを示す.移植後,全ての症例でNETs値の上昇を認めるが,TA-TMA発症群でより大きく上昇していることが分かる.
特発性TTPに対しては,抗ADAMTS13抗体およびUL-VWFM除去と,正常なADAMTS13およびVWFの補充を目的とした血漿交換療法が第一選択であるが,病態が異なるTA-TMAに対しては血漿交換の効果は限定的であり,推奨されない9).そのため,TA-TMAに対しては,厳重な全身管理を行いながら,TA-TMAの原因となりうる因子を可能な限り取り除くことが主眼となるが,有効な標準治療は確立されていない.
我々のグループでは,2019年にTA-TMAの診断と治療に関する後方視的多施設共同研究を施行した.合計2,430症例を対象とした解析で,臨床的にTA-TMAと診断されたのは123人で,100日時点での累積発症率は5.0%(発症日中央値:移植後36日)であった.TA-TMAを発症した症例は,そうでない症例に比べて,有意に予後不良であった(ハザード比4.92,P<0.01)(図2).これらの症例に対して行われた治療とその経過を詳細に解析したところ,CNIの中止群(ステロイドなどへの変更)に比して,CNIを減量・継続した群において,TA-TMAからの離脱率が有意に高かった(27.3%vs. 62.7%)(論文投稿中).古典的な対応の一つであるCNI中止・他薬剤に置き換え13)は,GVHDのコントロール不良に繋がり,TA-TMAの治療として,第一選択にはならない可能性が示唆された.

TA-TMAと予後の関連
TA-TMA発症群(TMA group)と,非発症群(non-TMA group)に分けて,移植後の生存率を示す.移植後,TA-TMA発症群で有意に予後不良であることが分かる.
しかしながら,このような保存的治療のみでは,TA-TMAを合併した症例のうち,60~75%が3ヶ月以内に死亡すると報告され1, 7),極めて予後不良である.我々のデータでも,6ヶ月時点での生存率は10%程度であった(図2).そのため,積極的な薬物治療の有効性が探索されてきた.CD20に対するモノクローナル抗体であるリツキシマブは,自己抗体が関与するTTPに対して有効であるが,TA-TMAにおいても有効例を認めており14),TA-TMAにおけるB細胞の関与が予想される.また遺伝子組換えトロンボモジュリン(recombinant human thrombomodulin: rTM)は,抗血栓・抗炎症作用などが報告され,補体調節因子としての働きもあることから,TA-TMAの治療における効果報告もあるが15),今回の我々の解析では,その有効性は示されなかった.さらには,肝中心静脈閉塞症(veno-occlusive disease: VOD)の治療薬であるデフィブロタイド16)や,補体活性阻害剤であるエクリズマブ17)の有効性が一部で示されていることから,今後の検討が待たれる18).
また,移植後早期からTA-TMA発症予防を積極的に行う試みも検討されている.VODの予防として,移植後よりヘパリンが持続投与されるが,ヘパリンはアンチトロンビンの活性化作用のみならず,NETs産生を抑制することが近年報告されており19),TA-TMAに対する予防効果も期待できる.加えて,血栓形成の高リスク移植患者を対象に,移植前から新鮮凍結血漿(fresh frozen plasma: FFP)を定期的に投与することでVODの発症を予防できるという報告20)もあることから,VODと同様に移植後の血管内皮障害に起因する微小血栓症であるTA-TMAにおいても,FFP投与が発症予防効果を持つ可能性が示唆される.
TMAは様々な原因で発生することが知られるが,本稿では,その中でも特に致命的な経過を辿ることが多いTA-TMAについて概説した.同種造血幹細胞移植は,医療技術の向上とともに適応が広がりつつある一方で,合併症併発による治療関連死亡率はまだ高い.わずかな検査値異常のみである初期症状の段階から,TA-TMAを鑑別疾患として念頭に置き,早期の対応をすることが重要であるとともに,様々な薬剤の治療効果を評価していくことが,今後重要な課題となる.
本論文発表内容に関連して開示すべき企業等との利益相反なし