2020 年 31 巻 5 号 p. 485-490
2020 年 31 巻 5 号 p. 485-490
血小板は止血機構や血栓形成だけでなく,炎症や免疫応答においても重要な役割を果たしている.血小板は骨髄巨核球から産生され,寿命を終えた血小板や活性化を受けた血小板は脾臓や肝臓で処理される.我々は抗GPIbα抗体による血小板減少マウスモデルを用いて,血小板処理機構や肝でのTPO産生に及ぼす影響等の解析を行ってきた.また同様のマウスモデルを用いて,幹細胞のマーカーであるSca-1と単球系のマーカーであるF4/80を発現するユニークな巨核球が誘導されることを見いだした.このようなマーカーを持つ巨核球はCMP→MEPを介する従来の分化機序をバイパスし,巨核球を直接産生する造血幹細胞(MK-biased HSC)によるものと考えられた.またその後の研究で,同様の機序がウィルス感染など様々な炎症性ストレスでも誘導されることが分かった.この総説では,ストレス下における造血幹細胞からの血小板産生機構に関する最近の知見及び我々の研究結果を紹介するとともに,今後期待される研究の展望について述べたい.
骨髄の造血幹細胞は細胞分裂を行い,赤血球,血小板,白血球へと分化する.一方で造血幹細胞は,自らと同じ造血幹細胞を複製する自己複製能を持っており,骨髄の中では常に造血幹細胞が再生される.このように,造血幹細胞は「分化」と「自己複製」という2つの巧みに調節された機序により造血が行われている.マウス造血幹細胞は一般的には分化抗原(Lin)陰性,Sca-1陽性,c-Kit陽性のいわゆるLSK分画に含まれるとされてきた.さらに長期に自己再生可能で全血液細胞に分化が可能な長期骨髄再構築幹細胞(LT-HSC)はその中でもSLAMレセプターファミリーであるCD150陽性,CD48陰性で, 幹細胞のマーカーであるCD34陰性分画に存在するとされた1).2013年にSanjuan-Pla等はVon Willebrand factor(Vwf)遺伝子Exon2にEGFP遺伝子を挿入した大腸菌人工染色体(bacterial artificial chromosome: BAC)トランスジェニックマウスを用いてこのLT-HSC(Lin– Sca-1+ c-Kit+ CD150+ CD48– CD34–)の60%にVWF/EGFPが発現していることを見いだした2).さらにこのVWF/GFP+ LT-HSCにはVWFをはじめ,Selp等の血小板関連遺伝子が高発現していることよりplatelet-biased HSCと名付けられた.また移植実験によってこれらの細胞は血小板系や骨髄系の細胞を長期に再構築できるが,リンパ球系の再構築能は低いことが示された.その後VWF/GFP+LT-HSCの骨髄での局在が解析され,細動脈ニッチではなく,ポドプラニン陽性の骨髄洞ニッチに巨核球に近接して存在すること,巨核球に高発現するPF4によって幹細胞は静止期に保たれていることが報告された3, 4).同年Yamamoto等は白血球だけでなく血小板および赤血球にも蛍光タンパク質Kusabira Orangeを安定して発現することができるトランスジェニックマウスを作成し,単一細胞移植実験によってLT-HSCはCD150+ CD34– CD41– KSLに存在すること,造血幹細胞は非対称性の自己複製によって造血幹細胞と自己複製能を持ち骨髄球系に限定した分化能を持つ骨髄球性前駆細胞に分裂し得ることを証明した5).この研究中でCD150+ CD34– CD41+ KSL分画の中には巨核球/血小板だけを産生する単分化能性巨核球前駆細胞(megakaryocyte progenitor: MKP),骨髄球系共通前駆細胞(common myeloid progenitor: CMP),巨核球/赤芽球系共通前駆細胞(megakaryocyte/erythroid progenitor: MEP)が存在することが示された5).同じ2013年にGekas等もCD41+ HSCは長期にわたる造血を再構築できるが,骨髄球系に偏向した幹細胞のマーカーであり,加齢とともにこの幹細胞が増加することを報告した 6).さらに巨核球/血小板だけを産生するMKPに関する詳細な表面マーカーの解析がなされ,2015年にNishikii等はマウスではCD34+ CD41+ CD42b+ Lin–細胞は,MKPでありCD41+ KSLではGPIbα(CD42b)は蛋白レベルでは確認できないが,mRNAが高頻度に検出されることを示した7).2017年にMiyawaki等はヒト骨髄細胞を用いてCD34+ CD38+ IL-3Rαdim CD45RA–のいわゆるCMPのCD41陽性分画の中にMKPが存在することを示した.興味深いことにCD34陽性細胞におけるMKPの割合は本態性血小板増多症の患者では増加していた8).これらのことからマウス骨髄ではLT-HSCに近い段階から巨核球遺伝子の発現が準備されていること,CD41は巨核球,血小板に特異的に発現しているだけでなく,骨髄球系への分化傾向を持つ造血前駆細胞のマーカーでもあること,このCD41陽性細胞の中には巨核球のみに分化できる前駆細胞が存在すること,のコンセンサスが得られるようになった.
造血幹細胞は細胞自身の転写発現とエピジェネティックな発現調節に加えて骨髄ニッチからのシグナルを介して休眠状態に保たれているが,IFNやTNFをはじめとするサイトカインやTLRのリガンド刺激等の炎症性シグナルに応答して静止状態を失い,自己複製能を変化させ一時的に増殖,分化すると考えられている.2015年にPietras等は成熟マウス骨髄の造血幹細胞を,先述の幹細胞のマーカーであるSLAMレセプターファミリーのCD150にCD48,そしてFLT3LのレセプターであるFLK2(FLT3)を組み合わせることで,骨髄前駆細胞をFlk2– CD150+ CD48+ KSL細胞をMPP2,Flk– CD150– CD48+ KSL細胞をMPP3,Flk+ CD150– CD48+ KSL細胞をMPP4の3つに分類し,通常状態では古典的なリンパ球優位なMPP4が優勢に造血を担っているが,炎症や放射線などによる骨髄破壊後の骨髄再生期においては,巨核球の産生能力が高く骨髄球系も産生できるMPP2や骨髄球系細胞産生能力の高いMPP3が一時的に活性化して急速に造血を回復させるとしている9).I型IFNは真性多血症の治療などにも使われ,またC型肝炎に対するIFN治療の副作用として血小板減少が良く知られているように,I型IFNによる長期刺激は造血抑制の方向に働くものと考えられてきた.これに対して2009年にEssers等はdouble-stranded RNAを模倣するpoly I:C刺激でLSK CD150+ CD48–骨髄幹細胞分画が増殖し,この現象をIFNα/β受容体であるIFNARノックアウトマウスでは認めないことより,急性IFNα刺激が幹細胞を増殖させることを明らかにした10).興味深いことにIFNα刺激によってSca-1のmRNA及び膜表面への発現が増加し,Sca-1ノックアウトではこの幹細胞分画の増殖を認めないことから,I型IFN刺激による造血幹細胞の増殖にSca-1自体も関与していることが示唆されている.このような炎症性サイトカインによる幹細胞への造血刺激作用は成人骨髄だけでなく胎生期における大動脈-生殖原-中腎(aorta-gonad-mesonephros: AGM)領域からの造血細胞の出現にも重要な役割をしている11).それではI型IFNによる造血の刺激と抑制といった相反する作用は血小板産生にどのような影響を与えるのであろうか? 2015年Haasらは,poly I:Cを投与したマウスからKSL CD150+ CD48–骨髄LT-HSC分画とKSL CD150+ CD48+骨髄前駆細胞分画をソーティングし,質量分析に基づく定量的プロテオミクス解析を報告した.この研究によりLT-HSC分画の中に静止状態ではあるが既に巨核球分化への準備が完了している幹細胞様巨核球前駆細胞(stem-like megakaryocyte committed progenitor: SL-MkPs)が存在し,炎症シグナルによりタンパク質合成および巨核球の分化,成熟が活性化され,血小板減少の回復に寄与することが明らかになった12).彼らの研究で,炎症刺激に反応して,IFN応答遺伝子だけでなく,integrin αIIbβ3(CD41,CD61)やGPIb-IX-V複合体,β1tubulinといった巨核球,血小板に特異的なタンパク質や血小板α顆粒の構成因子であるVWFやPlatelet factor 4(PF4)も有意に誘導することが示された.興味深いことにIFN応答遺伝子は転写レベルでの発現増強が起こるのに対して,巨核球遺伝子はmRNAの増加を認めず,転写後すなわち翻訳レベルでの増強によることが明らかになった.このようにI型IFNのシグナルは炎症ストレス等の状況下においては,LT-HSCを細胞周期に入れて増殖させるだけでなく,MK-biased HSCに準備されている巨核球関連mRNAからのタンパク質合成を促し,急速な成熟巨核球と血小板産生により,ウィルス感染等で惹起された血小板減少の早期回復に貢献することが分かってきた.
アミノアシルtRNA合成酵素は,タンパク質合成の第一段階を触媒する細胞質内蛋白質である.Wakasugi等は1999年にチロシルtRNA合成酵素(tyrosyl-tRNA synthetase: YRS)が一部細胞外に分泌され,エラスターゼ等のタンパク分解酵素による切断を受けることにより活性型となり,本来の機能とは異なるサイトカインやケモカイン活性を発揮することを明らかにした13).以来,多くのアミノアシルtRNA合成酵素が進化の過程で付加ドメインを得ることにより,タンパク質合成以外の新たな機能を獲得し,細胞外や核で作用することが明らかになってきた14).我々はチロシルtRNA合成酵素の活性化型(YRSACT)タンパク質に血小板増加作用があることを見いだし,抗GPIbα抗体投与による血小板減少マウスモデルを用いて,YRSACT投与が血小板回復を促進することを明らかにした15).マウス骨髄細胞を用いた作用機序解析により,YRSACTがF4/80陽性の骨髄細胞や末梢血単核細胞のTLR2,TLR4に結合し,MyD88を介してIL-6,VEGF-Aなどのサイトカインの産生を刺激することにより巨核球増殖,成熟を促すことが分かった.またYRSACT刺激により幹細胞マーカーであるSca-1と単球/マクロファージマーカーであるF4/80を発現するユニークな多核巨核球を誘導することをin vivoのマウス投与実験,及びex vivoの骨髄細胞培養実験で示した(図1).TLRは自然免疫において微生物の構成成分を認識し,感染防御に必要なシグナル伝達に重要な役割を果たす.またTLRは微生物構成成分だけでなく,細胞障害等により放出された細胞質タンパク質などの内因性リガンドによる活性化も受け,炎症反応を惹起することが知られている.我々はYRSがこういったTLRに対する内因性リガンドの一つとしての機能を持ち,ストレス応答の一環として造血制御に関与しているものと考えている.その後の検討でIFNARノックアウトマウスではYRSACT刺激によるSca-1陽性巨核球の誘導を認めないことより,Sca-1陽性巨核球の誘導にはI型IFNシグナルが必須と考えられた.先述のHaas等の報告と併せて,YRSACTはI型IFNシグナル依存性にMK-biased HSCを刺激することにより,血小板産生促進効果を発揮すると考えている.Sca-1はグルコシルホスファチジールイノシトールに係留された膜タンパク質であるが,当然のことながら定常状態で成熟巨核球から産生された血小板にはほとんど発現を認めない.私達はSca-1分子がMK-biased HSC由来の巨核球・血小板のマーカーになるのではと考え,Sca-1発現を高感度かつ容易に検出するべく,Ly6a-EGFPトランスジェニックマウス(Tg)を用いて解析を行っている16).このマウスではSca-1(Ly6a)遺伝子発現制御下にEGFP遺伝子が挿入されており,Sca-1発現の高感度マーカーとしてEGFPを用いることができる.私達はこのLy6a-EGFP TgマウスにYRSACTを投与することにより,末梢血中にEGFP(=Sca-1)陽性血小板が増加することを見いだした.さらに骨髄からMK-biased HSC由来の巨核球(EGFP+ F4/80+ CD41+ CD42b+),及び通常の分化経路で産生された巨核球(EGFP– F4/80– CD41+ CD42b+)をソーティングし,RNA Seqを行ったところ,前者の巨核球では後者と比較してCD41の発現は10倍高く,さらにCD34などの幹細胞のマーカーも発現していたが,赤芽球系の遺伝子の発現は低いことが分かった.一方後者の通常の分化経路で産生された巨核球は赤芽球系の遺伝子の発現がMK-biased HSC由来の巨核球と比較して60~80倍高かった17).これらの知見から我々はEGFP(=Sca-1)陽性巨核球はMK-biased HSC由来であり,MEPを介する通常の分化経路をバイパスするため,幹細胞マーカーを有しており,赤芽球系の遺伝子発現が低いものと考えている.
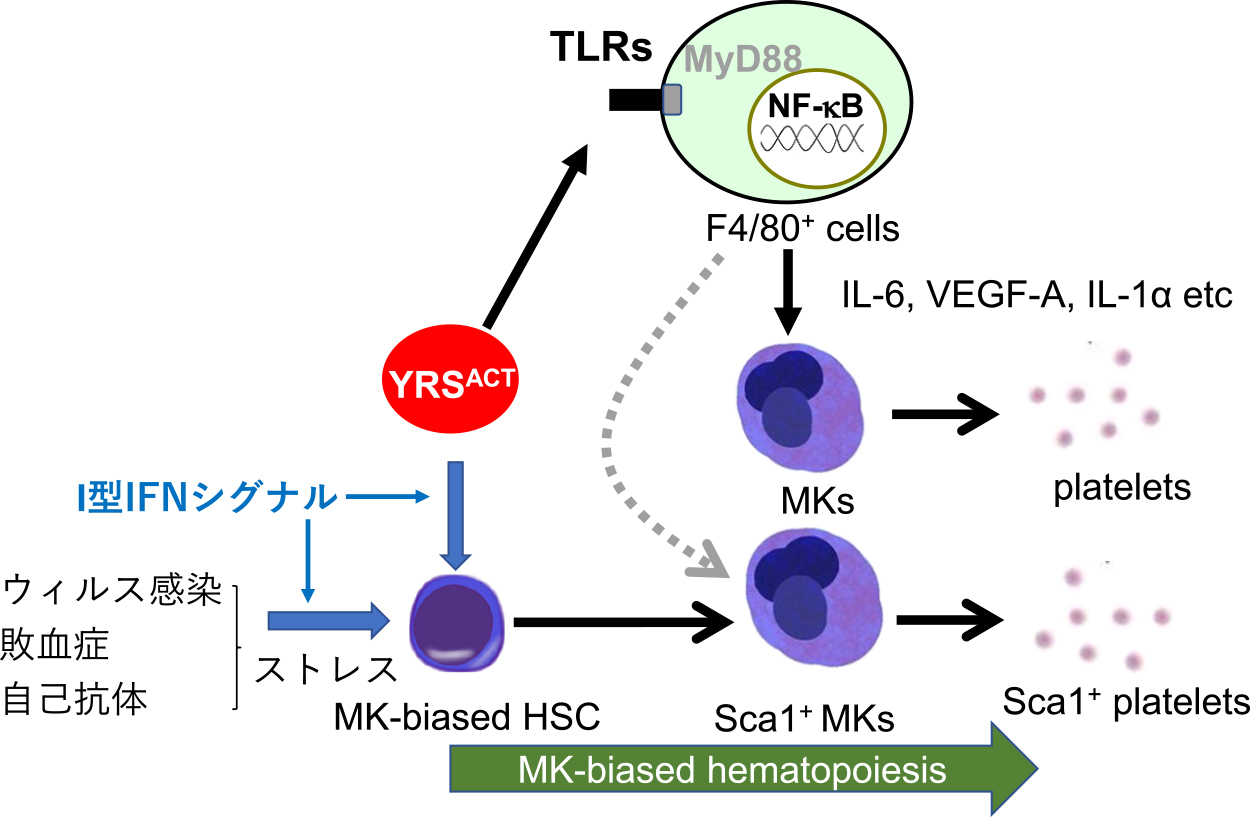
チロシルtRNA合成酵素の活性化型(YRSACT)による血小板産生刺激
YRSACTは骨髄のF4/80+細胞のTLR2/4に結合し,血小板産生促進作用のあるサイトカイン(IL-6,VEGF-A,IL1-α等)の産生を促し,巨核球の分化増殖及び血小板産生を刺激する.YRSACTは同時に骨髄のMK-biased HSCに働き,幹細胞を増殖させると共に,MK-biased HSCからの急速な血小板産生を刺激する.同様のメカニズムがウィルス感染や敗血症,あるいは抗体投与による血小板減少モデルによるストレス応答による誘導されており,I型IFNシグナルにより制御されている.
血小板は止血や血栓形成だけでなく,感染防御や炎症反応,免疫応答制御等においても重要な役割を果たしている.例えば敗血症においては,血小板は迅速に反応し,インテグリン活性化,P-セレクチンの発現,血小板-白血球凝集体形成,顆粒に貯蔵された殺菌作用を有するタンパク質の放出等が起こることが知られている.一方血小板は無核細胞であり,DNAから新たな転写によるmRNA産生をすることができない.Tissue Factor(TF)など一部の遺伝子については,血小板にpre-mRNAの状態で存在し,活性化刺激に応じてスプライシングを完了し,タンパク合成が起こることが知られている.しかし血小板減少を伴う様々な炎症ストレス下においてどのようにして血小板の産生,機能が制御されているのか,どの程度血小板内においてmRNAの量的変化,新たなタンパク質産生が起こっているのかについては詳しく分かっていない.2019年Middletonらは,次世代RNA-seqとリボソームフットプリントプロファイリングを組み合わせることにより,敗血症の病態において,どのように血小板遺伝子のmRNA及びタンパク質発現が変化するかをヒト患者とマウスモデルを用いて網羅的に比較検討した.その結果健康なドナーと比較して有意に発現増強を認めた遺伝子の一つは,integrin αIIb(CD41)をコードするITGA2Bであった18).また,同グループのCampbell等は,同年インフルエンザやデングウイルス(dengue virus: DENV)感染時にヒト血小板において,抗ウイルス免疫エフェクター遺伝子であるIFITM3の発現が増強していることを報告した.彼らはさらにヒトCD34+ HSCsから分化させた巨核球にDENVを感染させることによって,巨核球からI型IFNが産生され,巨核球でのIFITM3の発現を増強,ウイルス感染抑制に寄与することを見いだした18).我々の研究でもSca-1陽性巨核球ではIFITM3の発現増強を認めており,細菌やウィルス感染といった炎症ストレス下に産生されるintegrin αIIb及びIFITM3を高発現した血小板は,MK-biased HSC由来の血小板である可能性が高いと考えている.このように炎症等のストレス下では定常状態で産生される血小板とはmRNAやタンパク発現さらには機能や活性化状態の異なる血小板が産生されていることが分かってきており,私達はこの違いはMK-biased HSCからの血小板産生によるものである可能性を考えている.
Nishimuraらは2015年にマウス骨髄の巨核球からの血小板産生の過程を3次元かつリアルタイムで高速高解像度で観察することにより,従来の巨核球の細胞質が細長く伸張した血小板前駆体(proplatelet)からちぎれて産生されるタイプの血小板造血とは異なり,巨核球が破裂(rupture)するように一度に大量に血小板が産生される新たな血小板産生過程を報告した19).この破裂型血小板産生は,炎症刺激や抗GPIbα抗体投与による急性血小板減少などにより一過性に現われる.さらに血小板減少時に誘導されるサイトカインのプロファイリングによってIL-1αが巨核球を破裂型血小板産生に導くことを示した19).興味深いことにIL-1 αは先述のYRSACT刺激でマウス骨髄細胞に誘導されるサイトカインの一つでもあり,炎症ストレス応答時の破裂型血小板産生の寄与を支持している.その後2019年にBurzynskiらはトロンビンによるpro-IL-1αの切断が急速な血小板回復に必要なことを示し,トロンビンの活性化が抗GPIbα抗体投与における破裂型の血小板産生に必要なことを示した20).さらにトロンビンによって切断されたIL-1αはヒト敗血症においても増加していることを示しており,炎症ストレス時の血小板産生にこの経路が関わっていることが示唆された20).2019年Ramasz等は抗血小板抗体(ウサギ血清)投与による血小板減少モデルマウスを用いて,骨髄の造血幹細胞や前駆細胞の動態を解析した21).その結果CD41– HSCやCD41– MPP2は血小板除去後速やかに増殖し始めるのに対して,CD41+ HSCは急速に分化して巨核球を産生することが分かった.私達の抗GPIbα抗体投与による急性血小板減少モデルにおいても,血小板除去後一過性にSca-1+血小板が現れ,YRSACT投与によりストレス応答が増強しMK-biased HSCからの血小板産生によりSca-1+血小板はさらに増加することが分かっている15).これらの結果を併せると,急性血小板減少に反応してまずMK-biased HSCから急速に巨核球,血小板を産生することによって緊急状態に対応し,同時に通常のCD41– HSCからの巨核球分化によるバックアップにより,その後の血小板回復をサポートするといった非常に理にかなったシステムを生体は構築しているものと考えられる.
血小板減少マウスモデルの研究に抗GPIbα抗体投与がよく用いられている.最近我々は抗GPIbα抗体(5A7)を用いて複数の血小板減少マウスモデルを作製し,血小板除去メカニズムや肝でのTPO産生に与える影響を解析した22).その結果,高用量抗GPIbα抗体静注による急性モデルでは抗GPIbα抗体が血小板脱シアル化及び凝集を惹起し,肝細胞AMRを介したTPO産生シグナルを誘導すること,低用量抗GPIbα抗体連続皮下注による慢性モデルでは,投与抗体が骨髄巨核球にも結合し内在化して行くこと,さらにGPIbαが切断された血小板が経過とともに増加することを示した22).そしてこれらのモデルにおいてもMK-biased HSCからの巨核球,血小板産生を示唆する知見が得られていることから,ウィルスや細菌感染だけでなく,抗体投与により血小板減少を惹起した骨髄内でもストレス応答が起こっていることが推察される.またこれらの知見はMK-biased HSCからの造血を慢性的に活性化することにより,幹細胞の枯渇や骨髄系優位の造血を引き起こし,MDSや白血病を誘発する可能性も示唆される.
通常の分化経路を介さない,MK-biased HSCからの巨核球,血小板産生は,感染症,自己免疫応答,あるいは放射線照射等様々な原因で起こる血小板減少において急速な血小板産生に重要な役割を果たしている.これまでに得られた知見から,この血小板産生機構は現在問題となっているCOVID-19の病態形成にも寄与している可能性が推察される.通常の巨核球,血小板と区別すべく,特異的マーカーとして我々が注目しているSca-1はヒトには対応抗原が存在しない.今後より詳細な機序の解析やマーカーの同定により,これらの血小板マーカー検査が,ウィルス感染などにより造血が受けているストレスの状況を反映する診断的価値を発揮する可能性も期待される.
本論文発表内容に関連して開示すべき企業等との利益相反なし.