2022 年 33 巻 4 号 p. 466-473
2022 年 33 巻 4 号 p. 466-473
私たちは蛇毒ロドサイチンの受容体として,血小板活性化受容体C-type lectin-like receptor 2(CLEC-2)を同定した.さらに,その生体内リガンドがPDPNであり,それらの相互作用が様々な病態生理学的役割を持つことを報告してきた.これらの検討にあたり作製した巨核球・血小板特異的CLEC-2ノックアウトマウスが思いがけず貧血を呈したことから,巨核球・血小板が別の系統の造血環境に影響を及ぼしている可能性について検討を行った.その結果,骨髄細動脈周囲に存在し,細網線維芽細胞に似た表面抗原発現をもつPDPN発現間質細胞が,CLEC-2の刺激によりIGF-1を産生,このIGF-1が赤芽球のアポトーシスを抑制することでその造血を正に制御していることが判明した.このように,系統の決定した造血細胞が,別の系統の造血を制御するという機序はこれまでにないユニークな機構であり,本稿ではこの詳細について考察を交えて解説する.
赤血球造血は造血幹細胞から成熟赤血球がつくられるまでの成熟過程を指し,これにはエリスロポエチンをはじめとする様々なサイトカインが関与する.この成熟過程が阻害されたり,赤血球の破壊が亢進したりすると貧血を生じることとなる.
私たちは,蛇毒ロドサイチンの受容体として,C-type lectin-like receptor 2(CLEC-2)を血小板上に同定した1).その生体内リガンドは,腎臓の足細胞,リンパ管内皮細胞,I型肺胞上皮細胞,特定のがん細胞に発現するポドプラニン(Podoplanin: PDPN)である.私たちは,CLEC-2そのものが血栓の安定化作用といった血栓止血機能に携わるほか,PDPNとの相互作用により,血管・リンパ管の分離2),腫瘍の転移3, 4),肺発生5)など,様々な役割を示すことを報告してきた.
これらCLEC-2のもつ役割解明のために私たちが作製した巨核球・血小板特異的CLEC-2ノックアウトマウス(以降,CLEC-2をコードするClec1b遺伝子より,Clec1bΔPLTマウスと記載)は血小板減少と貧血を呈しており,前述の役割の他にも,巨核球や赤芽球の造血にもCLEC-2がなんらかの影響を及ぼしていることが判明した.巨核球造血については,細網線維芽細胞に似た表面抗原発現をもつPDPN発現間質細胞を骨髄細動脈周囲に新たに同定し,重要な役割を持つことを示した.具体的には,この間質細胞が巨核球に結合することでその増殖を促したり,CLEC-2の刺激により間質細胞がCCL5を分泌することで巨核球の成熟が促されたりすることを解明した6).その一方で,このマウスがなぜ貧血を呈するのかは長らく不明であった.
以上の知見をもとに,巨核球・血小板上にもっぱら発現するCLEC-2が赤血球の造血に影響しているという興味深い造血制御機構が解明できる可能性に期待して,本検討を行うこととした7).
はじめに,Clec1bΔPLTマウスの呈する貧血について,赤血球恒数を用いて評価を行った.その結果,ヘモグロビン値は野生型マウスと比べて有意な減少を認める一方で,MCV値や網状赤血球数は増加するという結果が得られた.Clec1bΔPLTマウスが大球性貧血を呈することはすでに報告されており8),今回われわれが確認した結果もそれらに矛盾のない結果であった.この原因を探るため,骨髄中の造血細胞についてどのような変化が生じているか確認することとした.両側の脛骨および大腿骨から骨髄細胞を回収し,その有核細胞数を比較したところ,Clec1bΔPLTマウスにおいて有意な減少を認めた(図1A).各分化段階における赤芽球数については,グリコホリンAに会合するTER119とトランスフェリン受容体CD71の発現をもとに,フローサイトメーターを用いて評価を行った.具体的には,TER119陰性CD71陽性を示すS1分画には主に前赤芽球が,TER119陽性CD71陽性を示すS2分画には主に塩基好性赤芽球が,TER119陽性CD71中等度陽性を示すS3分画には主に多染性赤芽球が,TER119陽性CD71陰性を示すS4分画には主に正染性赤芽球が分類される性質を利用した.その結果,前述の4分画のうち,S2からS4の分化段階の細胞数が有意に減少していた(図1B,C).一方で,2つの赤芽球マーカーを発現しない細胞数には変化がなかったことから,有核細胞数の減少は,赤芽球および赤血球数の減少によるものであることが判明した.髄外造血を生じる可能性のある臓器について観察を行ったところ,脾臓に肉眼的に明らかな腫大を認め(図1D),その重量,細胞数,そのうちTER119が陽性を示す細胞割合はClec1bΔPLTマウスにおいて有意に増加していた(図1E~G).
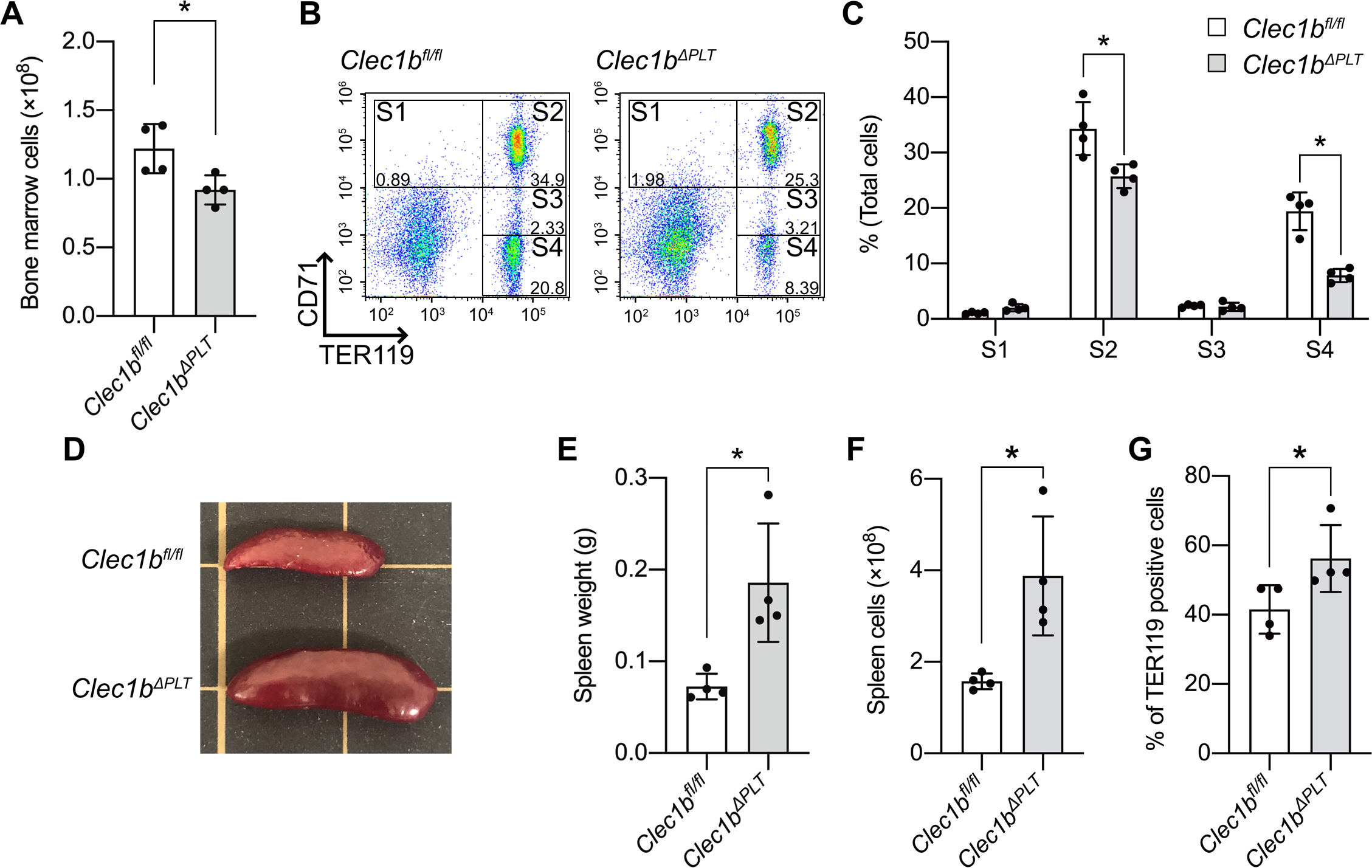
Clec1bΔPLTマウス骨髄中の赤芽球は減少し,脾臓での髄外造血を伴う
(A)骨髄の有核細胞数.TER119とCD71を用いたフローサイトメトリー法(B)よる赤芽球細胞割合の定量(C).脾臓の肉眼的所見(D),脾臓重量(E),脾臓細胞数(F)およびTER119陽性を示す赤芽球割合(G).
前述の赤芽球数の減少がどのような機序によるものか,赤芽球のアポトーシス細胞割合を追加で検討した.これには,前述した赤芽球系マーカーのTER119とCD71に加えて,AnnexinVおよび7-AADを用い,フローサイトメーターで検討を行った.具体的には,AnnexinV陽性7-AAD陰性を示す早期アポトーシス細胞,AnnexinV,7-AADどちらも陽性を示す後期アポトーシスおよびネクローシス細胞の,両者の細胞割合を比較した.S1分画は細胞数自体に有意な差が認められなかったことから,S2(図2A~C)およびS4分画(図2D~F)におけるアポトーシス細胞割合を比較したところ,Clec1bΔPLTマウス骨髄における赤芽球のアポトーシス細胞割合はどちらの分画においても有意に増加していた.

Clec1bΔPLTマウスにおいて,赤芽球のアポトーシス細胞割合は増加する
(A~C)TER119陽性CD71陽性を示すS2分画におけるアポトーシス細胞割合の比較.AnnexinVと7-AADを用いたフローサイトメトリー法(A)によるアポトーシス細胞解析.AnnexinV陽性7-AAD陰性の早期アポトーシス細胞割合(B)およびAnnexinV陽性7-AAD陽性の後期アポトーシス・ネクローシス細胞割合(C)を比較.(D~F)TER119陽性CD71陰性を示すS2分画におけるアポトーシス細胞割合の比較.フローサイトメトリー法を用いた細胞周期解析(G)および各細胞周期割合の比較(H).
細胞周期に変化があるかどうかについても,フローサイトメトリー法を用いて細胞周期の解析を行った.具体的には,CD71に加えてKi67,リン酸化ヒストンH3および7-AADを用い,G0期,G1期,S期,G2期,M期の各細胞周期の割合を評価した.CD71陽性を示す比較的幼弱な赤芽球にゲートしてこの割合を比較したが,明らかな変化はみられなかった(図2G,H).このことから,Clec1bΔPLTマウスにおける赤芽球系細胞の減少は,TER119を発現した赤芽球のアポトーシス細胞割合増加によることが判明した.
ここまでの検討で,CLEC-2が何らかの機序により,赤芽球のアポトーシス抑制を介してその細胞数維持に関わっていることがわかった.しかしながら,赤芽球にはCLEC-2は発現していないことから,巨核球造血におけるCLEC-2の役割と同様,CLEC-2とPDPNの相互作用を中心とし,液性因子を介した赤芽球造血維持機構が存在しているのではないかと仮定して検討をすすめることとした.この検討のため,骨髄細胞を培地に播種し,浮遊細胞をリコンビナントCLEC-2-ラビットFc蛋白で刺激し,放出された液性因子をサイトカイン・ケモカインアレイにより比較した(図3A).なお,コントロールとしてラビットFc蛋白を用いた.赤芽球造血に影響を及ぼすサイトカイン・ケモカイン(IGF-1, IL-3, IL-6, G-CSF, GM-CSF, SCF)を比較したところ,成長ホルモンの刺激により主に肝臓から産生され,インスリンに類似した化学構造をもつインスリン様成長因子(Insulin-like growth factor-1: IGF-1)が有意に上昇していた(図3B,C).

CLEC-2で刺激されたPDPNを発現する間質細胞はIGF-1を分泌する
(A)PDPN陽性間質細胞の培養方法およびリコンビナントCLEC-2による刺激方法の概要.サイトカイン・ケモカインアレイの結果(B)および半定量の結果(C).
赤芽球造血におけるIGF-1の役割を確認するため,マウス胎仔の肝臓より調製した未熟な赤芽球を1 μM,10 μM,100 μMのIGF-1受容体阻害剤またはDMSOを添加した培養液中で培養し,24時間後に細胞を回収,TER119とCD71を用いたフローサイトメトリー法によりCD71陽性細胞割合と,CD71陽性赤芽球におけるAnnexinVの陽性率を比較した.すると,IGF-1受容体阻害剤の添加は有意にCD71陽性を示す赤芽球数を低下させ(図4A,B),CD71陽性赤芽球のAnnexinV陽性率を高めた(図4C,D).
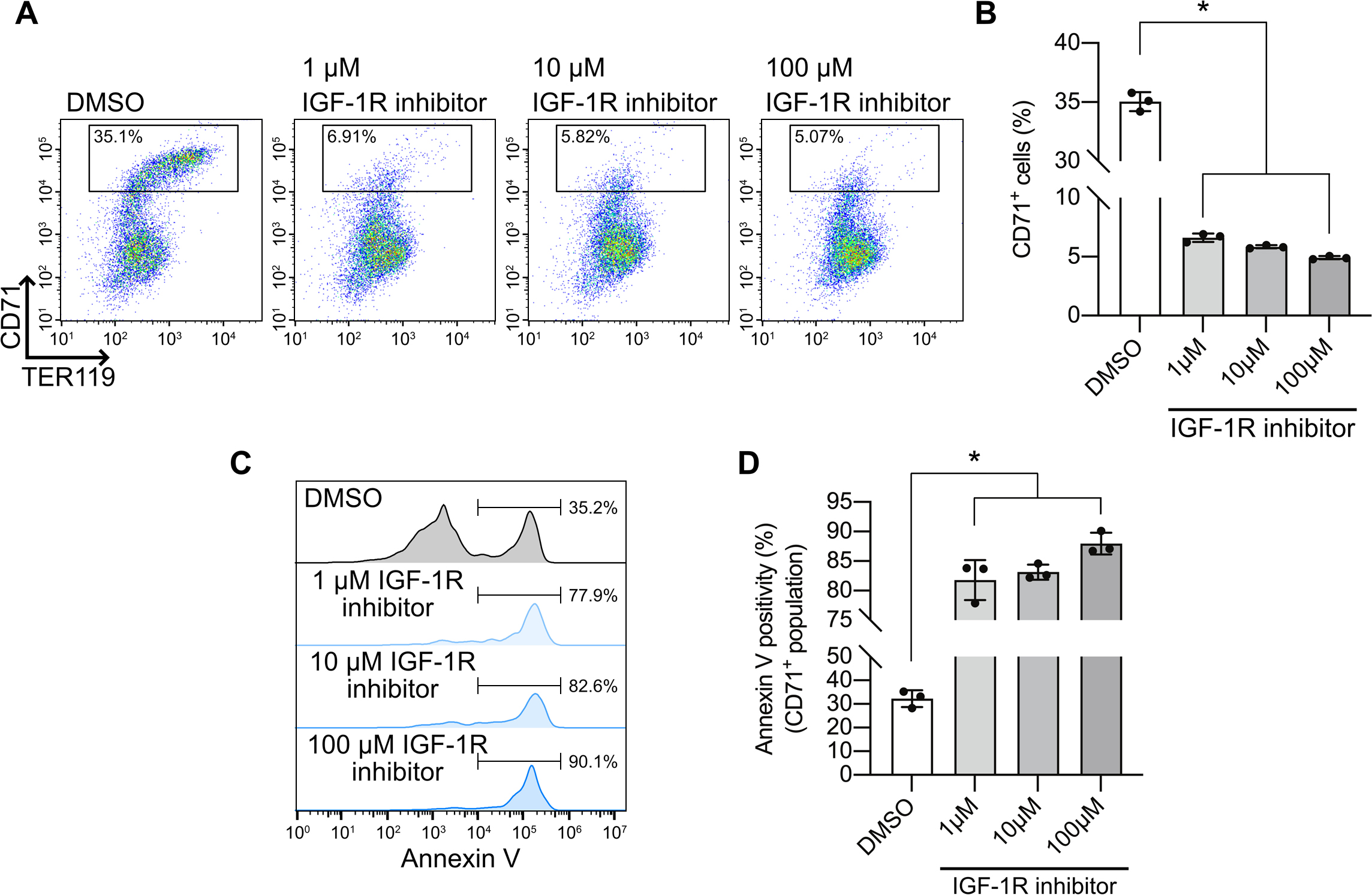
In vitroにおいてIGF-1受容体阻害は赤芽球のアポトーシスを増加させる
フローサイトメトリー法を用いた,IGF-1受容体阻害剤添加の有無による赤芽球細胞の評価(G)およびその定量(H).CD71陽性分画におけるAnnexinV陽性率の評価(E)およびその定量(F).
In vivoにおいても,Clec1bΔPLTマウスの示す貧血がIGF-1の低下を介しているかどうか確かめるために,まずClec1bΔPLTマウスにおける血清・骨髄細胞外液のIGF-1濃度をELISA法で測定した.すると,両者のIGF-1濃度がコントロールマウスと比べて有意に低下していた(図5A,B).その一方で,赤芽球上のIGF-1受容体の発現については有意な差はみられなかった(図5C).IGF-1の主要な産生臓器は肝臓であることから,肝臓におけるIGF-1合成をRT-PCR法により定量したところ,IGF-1の相対的な発現には変化がみられなかった(図5D).このことから,骨髄におけるIGF-1の産生不良こそが血清中のIGF-1濃度低下の主因であると考えられた.
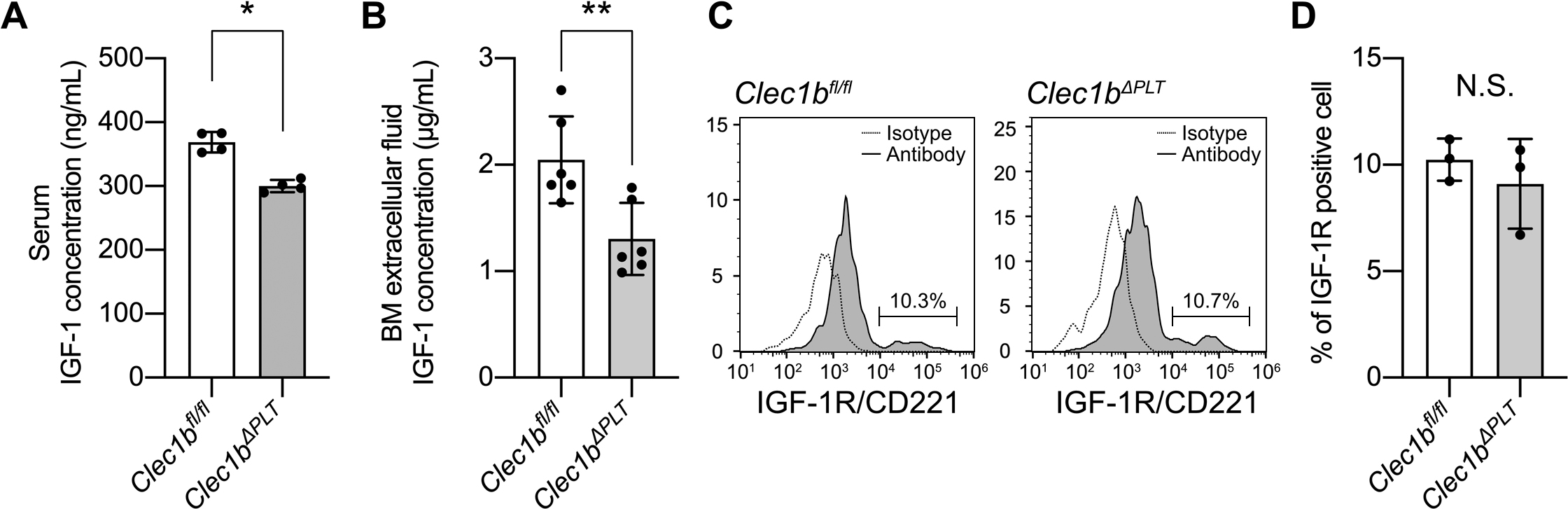
Clec1bΔPLTマウスは低い血清・骨髄細胞外液IGF-1濃度を示す
(A)血清および(B)骨髄細胞外液におけるIGF-1濃度の比較.フローサイトメトリー法を用いたIGF-1受容体の評価(C)およびその定量(D).
最後に,外因性のIGF-1の補充がClec1bΔPLTマウスにみられる貧血を改善させるかどうか,リコンビナントマウスIGF-1の皮下注射を4週齢のClec1bΔPLTマウスに3週間行い,ヘモグロビン値の推移を週に1回確認した.すると,2週目以降,IGF-1の投与を受けたClec1bΔPLTマウスは貧血が有意に改善した(図6A).3週間の投与が終了したところで骨髄細胞を回収したところ,骨髄中の有核細胞数が有意に上昇していた(図6B).赤芽球については特にS4分画の細胞数が有意に上昇しており(図6C,D),同分画における後期アポトーシス・ネクローシス細胞割合が低下していた(図6E,F).また興味深いことに,Clec1bΔPLTマウスにおいて確認されていた脾腫はIGF-1の投与で腫大が改善し,細胞数も減少した(図6G,H).これは,脾臓における髄外造血が外因性IGF-1の投与により軽減したことを示している.
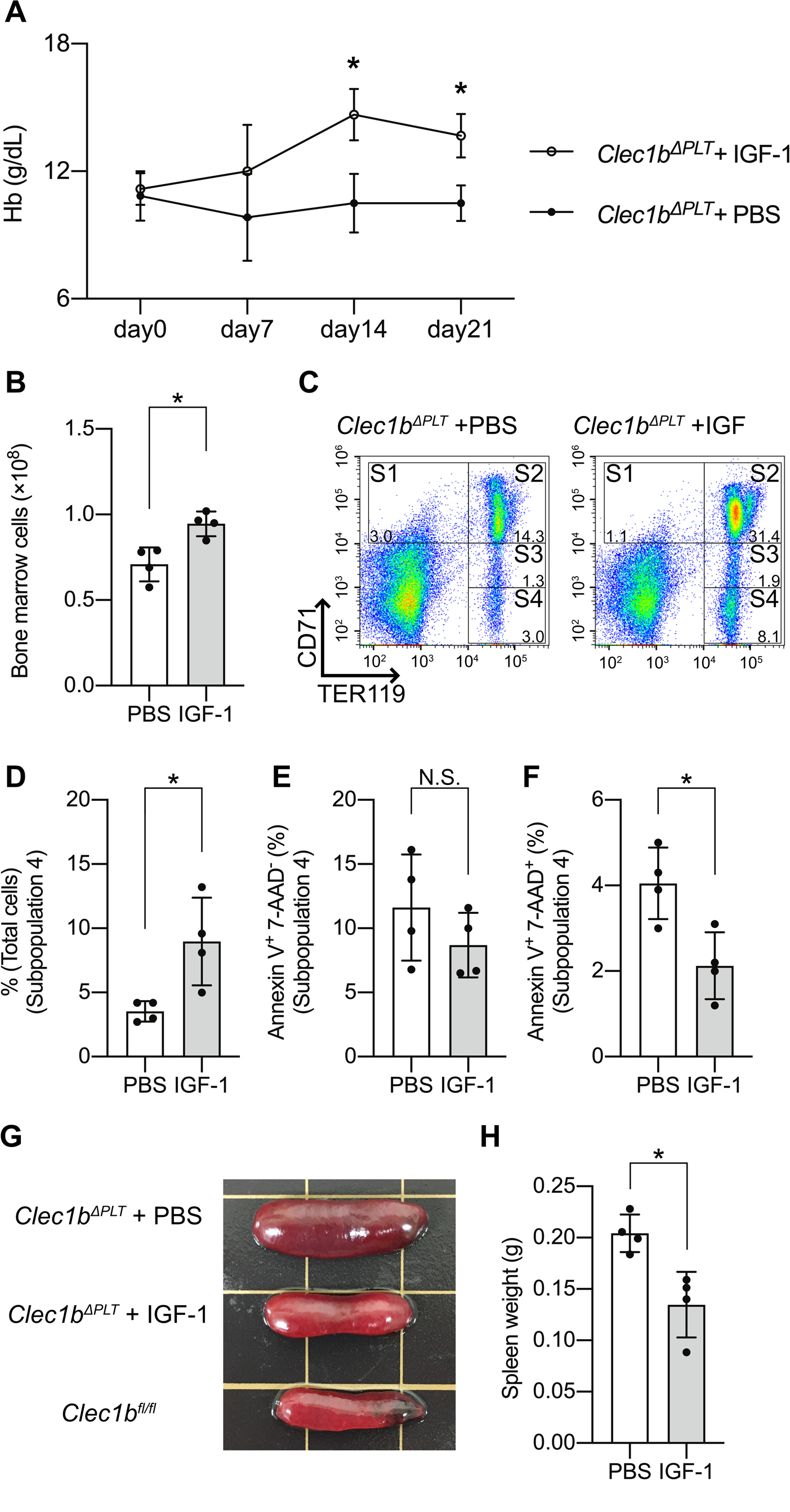
外因性のIGF-1投与はClec1bΔPLTマウスの貧血を改善する
(A)外因性のIGF-1投与後のヘモグロビン値の推移.(B)IGF-1投与後3週間における骨髄有核細胞数の比較.(C)フローサイトメトリー法を用いた赤芽球細胞の評価.TER119陽性CD71陰性を示すS4分画の細胞割合(D),AnnexinV陽性7-AAD陰性(E),AnnexinV陽性7-AAD陽性(F)を示す細胞割合.IGF-1投与後の脾臓の肉眼所見(G)および細胞数の変化(H).
本研究により,CLEC-2はPDPN発現間質細胞を刺激することで,骨髄微小環境においてIGF-1の適切な分泌を促し,赤血球造血を正に制御することが判明した.分化の進んだ巨核球・血小板上に発現する分子が他の系統である赤芽球の造血環境を維持しているという造血制御機構は非常に興味深い.さらに,骨髄におけるIGF-1の分泌細胞特定という意味でも本研究は重要な役割を持つ.IGF-1の主要な産生臓器は肝臓であるが,それ以外の産生臓器については,マウス骨髄間質細胞由来の細胞株であるTC-1がIGF-1をin vitroで分泌するという報告がある9)ものの,正確な産生細胞については不明であった.今回,骨髄の細動脈周囲に存在するPDPN発現間質細胞がIGF-1を分泌することを新たに特定したが,多発性骨髄腫などにおいて腫瘍細胞の増殖やアポトーシス回避にIGF-1が関わるといった報告もあり10),本研究で新たに判明したIGF-1産生機構にはさらなる興味をかきたてられる.今後,PDPN発現間質細胞の造血機能におけるさらなる役割解明や,CLEC-2異常に関連した未知の病態解明を目指して検討をすすめていきたい.
本研究を行うにあたり,研究遂行にご協力を頂いた著者の皆様,実験のサポートをいただいた大塚貴子様,吉河佑莉様に感謝申し上げます.また,本研究は,科学研究費助成事業若手研究(18K16080)および日本血液学会研究助成事業(2017年度)の助成を受けて行われました.本論文の内容についてはすでにJ Thromb Haemost誌に原著論文として投稿されており,二重投稿となることを避けるため概要について考察を交えて総説的に記載しました.
本論文発表内容に関連して開示すべき企業等との利益相反なし