2023 年 34 巻 4 号 p. 443-448
2023 年 34 巻 4 号 p. 443-448
ヘパリン起因性血小板減少症(heparin-induced thrombocytopenia: HIT)はヘパリン投与後に血小板減少とともに血栓症を発症する疾患である.診断にはHIT抗体検査が行われるが,免疫学的測定法は偽陽性が多いという問題がある.正確な診断には患者検体中に含まれるHIT抗体が血小板活性化能を有するかどうかを評価する機能的測定法が重要だが本邦では普及していない.機能的測定法は適切な健常者血小板ドナーを選択して,そこに患者検体とヘパリンを添加することで血小板が活性化するかどうかを測定する.血小板活性化の測定にはセロトニン放出試験がゴールドスタンダードだが放射性同位元素を用いるため本邦では導入が困難であり,フローサイトメトリー法を用いた血小板マイクロパーティクル法が開発された.現在,臨床試験も行われているが安定した検査体制の確立のためにさらなる改良とデータ蓄積が重要である.
ヘパリン起因性血小板減少症(heparin-induced thrombocytopenia: HIT)はヘパリン投与5~10日後に血小板減少とともに血栓症を発症する疾患である.ヘパリンが投与されると血小板第4因子(platelet factor 4: PF4)と結合しヘパリン/PF4複合体が形成されるが,ヘパリンとPF4が一定の割合で混在するとPF4が構造変化を起こして抗原決定基が露出し,抗ヘパリン/PF4複合体抗体(HIT抗体と呼ばれる)が産生される.ヘパリン/PF4/HIT抗体の免疫複合体は血小板表面上のFcγRIIAに結合して血小板が活性化し,消耗性に血小板減少症を引き起こす.さらに放出された血小板マイクロパーティクルがプロコアグラント活性を有し,トロンビンを過剰産生して血栓症の発症に寄与する1).
HITの歴史をみると,1958年に初めてHITの症例報告があり2),その後1973年にHITという診断名や免疫病態が関与していることが提唱された3).1986年にHITの診断目的にセロトニン放出試験(serotonin release assay: SRA)が開発され4),1994年になってHIT抗体がヘパリン-PF4複合体に結合することが解明5),2001年になってHIT抗体を検出する酵素免疫測定法が開発された6).当時,HIT抗体の存在が解明されていなくとも,患者血清中に血小板を過剰に活性化させる物質があることが判明しており,その診断法としてSRAが確立された.SRAの歴史は古く,現在でも確定診断に使われる検査法である.
2)HIT抗体検査HITの診断にはHIT抗体の存在の証明(免疫学的測定法,表1)とHIT抗体が血小板を活性化することを証明(機能的測定法)する必要がある.本邦において保険収載されて行われている検査は免疫学的測定法だけであり,測定法としてラテックス凝集免疫比濁法と化学発光免疫測定法が行われている.また,イムノクロマト法が2022年に体外診断用医学品として承認を受け今後,臨床現場でも使用できるようになる.これらの検査はともに感度が高く設定されているため,陰性であれば確実にHITを否定できるが,特異度は高くないため陽性であっても確定診断とはならない.
| 測定法 | 測定アイソザイム | 測定場所 | 試料 | 特徴 |
|---|---|---|---|---|
| 酵素免疫測定法(ELISA) | IgG/IgA/IgM | 研究施設 | 血漿/血清 | 海外,国内の研究室での実施実績はあるが,国内では保険未収載.VITTにおける抗PF4抗体の測定用として本邦では臨床試験で測定可能 |
| IgG | 研究施設 | 血漿/血清 | ||
| Diamed PaGIA | IgG | 研究施設 | 血漿/血清 | 迅速検査として感度,特異度とも高いが研究施設でしか測定できない |
| 化学発光免疫測定法(CLIA) | IgG/IgA/IgM | 外注なし | 血漿/血清 | 保険収載されているが,検査センターで採用されていないため測定不可 |
| IgG | 院内/外注 | 血漿 | 保険収載されており,検査センターで施行可能である | |
| ラテックス凝集免疫比濁法 | IgG/IgA/IgM | 院内/外注 | 血漿 | 保険収載されており,検査センターで施行可能である |
| イムノクロマト法 | IgG | 院内 外注 研究施設 |
血漿/血清 | 2022年に体外診断用医薬品として承認 2023年5月1日,保険収載 |
ELISA:enzyme-linked immunosorbent assay
CLIA:chemiluminescent immunoassay
VITT:vaccine induced immune thrombotic thrombocytopenia
PaGIA:particle gel immunoassay
機能的測定法は患者検体中に含まれるHIT抗体が健常者の血小板を活性化するかどうかを評価する検査法である.高い感度と特異度のため確定診断として用いられるが,その検査精度を高く維持するためには高い精度管理のもと行われる必要があり,活性化血小板の扱いに長けていなければ偽陽性・偽陰性になるため慎重に行う必要がある.
機能的測定法の原理について概説する(図1).準備するのはHIT抗体が含まれている患者検体(血清または血漿)と健常者の血小板である.適切な患者検体の採取方法は表2に示す7).特に重要となるのは,患者検体中にヘパリンを含んでいないことと,検体採取後の適切な保管である.患者検体は検査開始前に解凍して残存トロンビン活性を不活化させるために56°C,30分で熱処理し,高速遠心した上清を用いる.次に血小板の準備であるが必ず健常者の血小板を準備する.患者血小板はin vivoにおいて過剰な活性化をしていること,HIT疑いであれば血小板減少をきたしており,検査に必要な血小板数を得るために大量の採血が必要になるため使用は推奨されない.適切な健常者検体の採取方法は表2に示す.特に重要となるのは,HIT抗体に感受性の高い血小板ドナー(ハイレスポンダードナー)を選択することと多血小板血漿(platelet rich plasma: PRP)ではなく洗浄血小板を用いることである.PRPではHIT抗体への感受性が著しく低下し,HIT抗体への感受性に低い血小板ドナー(ローレスポンダードナー)であれば偽陰性になる可能性があるため,ドナーの選択は事前に調べておく必要がある.
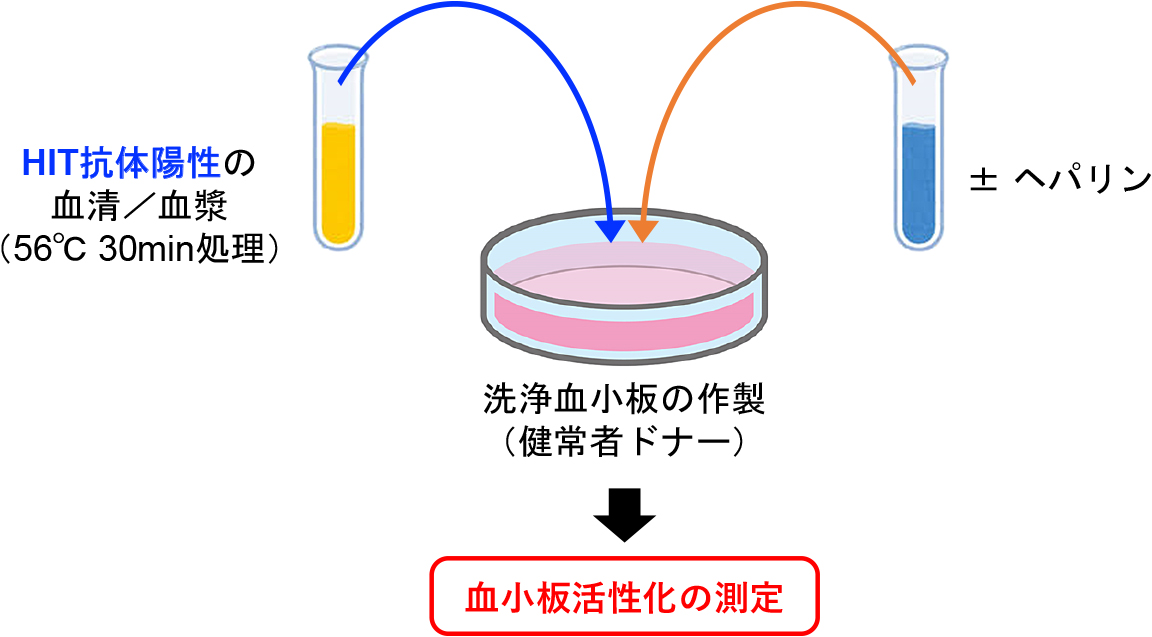
機能的測定法の原理
56°C 30分で熱処理したHIT抗体陽性の患者血清/血漿と健常者からの洗浄血小板を混合し,ヘパリン添加/非添加で血小板活性化を測定する.
| 患者血清/血漿の準備 |
| ○ 患者血清は56°C 30分で処理して残存トロンビン活性を不活化させ,高速遠心を行う ○ 血清には血小板活性化の際にPF4の放出があるため,血漿よりも多くのPF4が含まれている.検体中でPF4-HIT抗体の複合体が形成され,感度が変わる可能性がある ○ チカグレロルを内服している患者だとfunctional assayが偽陰性となるが,直接経口抗凝固薬は問題ない ○ 患者血液中のヘパリン濃度も影響することがあるため,可能ならヘパリン注射を中止後少なくとも4時間後,また皮下注射直前の採血が推奨される |
| 血小板ドナー(健常者)条件 |
| ○ HIT抗体に感受性の高い血小板ドナーを用意する ○ 1回の検査で協力してもらうドナー人数は2~5人が多い(コンセンサスはない) ○ 喫煙してから30分以上,カフェインを摂ってから2時間以上あけてから採血する ○ 血小板機能に影響する薬を飲んでいない(非ステロイド性抗炎症薬なら3日以上,アスピリンなら10日以上あける) ○ 選択的セロトニン再取り込み阻害薬やハーブ(キニーネ,クミン,ドンクアイ,フェヌグリーク,ニンニク,玉ねぎ,生姜,高麗人参)を避ける |
| 洗浄血小板の作成 |
| ○ 多血小板血漿ではなく,洗浄血小板を使う ○ 採血から解析まで4時間以内に終わらせる ○ 洗浄血小板の作成中,血小板活性化を予防するためにプロスタグランジンE1またはアピラーゼまたはヒルジン,またはすべてを含むACD液で準備する |
| 測定上の注意点 |
| ○ ドナー血小板表面上のPF4密度が異なるため,ドナーによって適切なヘパリン濃度は異なっている.そのため,ヘパリン濃度は2種類(0.1と0.3 U/mL)で行うのが望ましい |
熱処理した患者検体とハイレスポンダードナーの洗浄血小板を混ぜて,その後,ヘパリンを添加して血小板の活性化の有無を測定する(図1).添加するヘパリン濃度は血小板ドナーにより適切な濃度が異なるため,最終濃度0.1または0.3 U/mLとなるようにし,ヘパリン依存性の確認のためにヘパリン非添加をコントロールとして設定する.HITではヘパリン/PF4複合体にHIT抗体が結合し,その免疫複合体がFcγRIIAを介して血小板を活性化することが重要であり,その反応を阻害する高濃度ヘパリン(通常は100 U/mL)や抗ヒトCD32抗体(クローンIV.3)をヘパリン添加前に加えておくことで血小板活性化が完全に抑制されるかを評価することも必要である.これらの評価をハイレスポンダー2~5人で評価することが推奨されているが人数については明確な規定はない.
血小板ドナーの選択には多くの注意点が必要であり表2にまとめた.これらの注意点に配慮した上で採血を行い,HIT抗体への感受性を事前に確認しておく必要がある.ハイレスポンダードナーは低力価HIT抗体で血小板が活性化するドナーを指し,ローレスポンダードナーは血小板が活性化しないドナーを指す.ここで使用するHIT抗体は事前に血小板活性化能を有することがわかっているHIT患者の検体を用いることが一般的であるが,リコンビナントHIT抗体を用いることもある.低力価HIT抗体は,高力価の患者検体を希釈して準備する8).事前にハイレスポンダードナーと判明していても食事や薬などの影響で実験ごとに反応性が変わることもあるため,複数のドナーで検討することが重要である.
活性化血小板の測定法のゴールドスタンダードはSRA9)とヘパリン惹起性血小板凝集試験(heparin induced platelet aggregation test: HIPA)10)であるが,フローサイトメトリー法をベースにした測定法11)も多く報告されるようになった.機能的測定法で行われる活性化血小板の測定では,慣れていないSRAやHIPAを導入して行うのではなく,各施設で扱い慣れた測定法を高い精度で行うことの方が重要とされる.
1)SRA機能的測定法の感度を高くするためには,血小板凝集を評価するよりもより血小板活性化の早期に起きる顆粒放出を評価する方が良いとの考えから開発されたのがセロトニン放出試験である.具体的な方法は,健常者からプロスタグランジンE1またはアピラーゼを含むACD液含有の採血管で採血後,PRPを採取し,14C-放射標識セロトニンとインキュベートする.その後,洗浄血小板を作成してから患者検体を加えてヘパリンで刺激する.予め最大放射能値をライセートした血小板サンプルで測定し,最小放射能値としてバッファーの放射能を測定して,上清中の14C-放射標識セロトニン放出率を算出する.
14C-セロトニン放出率が20%以上かつ高用量ヘパリンで20%未満または50%以上の抑制率になっていれば陽性と判定する.SRAは感度88~95%,特異度99%以上であるが,SRAの質を評価するための標準物質や参照基準がない点には注意が必要である.
2)HIPAHIPAはSRAと同様に健常者の洗浄血小板を作成し,患者検体と混合後にヘパリンを添加して血小板凝集を評価する方法である.マグネットスターラーで撹拌しながら5分ごとに目視で血小板凝集を確認し,30分以内に血小板凝集を確認できれば陽性と判定する.ランダムに選択した4人の健常者のうち少なくとも2名以上が陽性になることが必要で,高用量ヘパリン添加で血小板凝集を認めないこと,ポジティブコントロール,ネガティブコントロールを必ず設定しなければいけない.HIPAもSRAと同様にゴールドスタンダートと考えられているが,SRAと比較した試験は少なく,それも同じ研究室からの発表のため信頼性に乏しい.主観的な評価だけで特異度が高いとは考えにくく,これを応用して透過光血小板凝集能検査法を用いて評価する方法も報告されている12).
3)フローサイトメトリー法フローサイトメトリー法は蛍光標識リガンドを用いて血小板表面の血小板活性化マーカーを検出する.この血小板活性化マーカーとしてP-セレクチン(CD62P)やGpIIb/IIIaの活性化(PAC-1)が最もよく使用されている.SRAやHIPAと同様に健常者の洗浄血小板と患者検体,ヘパリンを混合し,1時間反応後に血小板マーカーであるCD41aと血小板活性化マーカーであるCD62Pで染色を行い,CD41a及びCD62Pがともに陽性の割合を測定する.報告により感度70~100%,特異度75~100%とばらつきがある.
4)血小板マイクロパーティクル測定血小板マイクロパーティクルは血小板の放出反応と共に膜の一部がちぎれて放出される粒子である.最も重要な機能は凝固能促進活性(プロコアグラント活性)であり組織因子を多く含むことで血液凝固の促進に大きく関与している.P-セレクチンやGpIIb/IIIaの活性化が血小板活性化の早期であるのに対して,血小板膜の一部から放出されるマイクロパーティクルは血小板活性化の後期におきる.感度がやや低下する可能性がある一方で,採血の影響などを受けにくいのが特徴である.
HITの機能的測定法のひとつとして血小板マイクロパーティクルをフローサイトメトリー法で測定した血小板マイクロパーティクル測定法(platelet microparticle assay: PMA)が報告されたのは1996年であり,SRAとの一致率は96%と高く,放射線同位元素を用いない検査として有用であることが示された13).PMAをROC曲線で解析した結果,陽性と定義する最適な閾値は10%以上と結論付けられた.ただし,フローサイトメトリー法で検出される小さなサイズの物質が本当に活性化された血小板から放出された真の血小板マイクロパーティクルなのか不明であったが2000年にBlood誌でこの小さな物質が血小板マイクロパーティクルであることが実証された14).その際,血小板マイクローパーティクルはサイズが0.1~1.0 μmかつ抗GP1bα抗体陽性と定義された.その後,本邦においてMaedaらがPMA法として臨床現場で活用し始め15),現在はわれわれが本法を用いて臨床試験を開始している.
われわれの施設で行っているPMA法について紹介する(図2).血小板ドナーの選択は事前にHIT抗体への感受性が高いかどうかを評価した.HITモノクローナル抗体(5A1)と血小板活性化能を有していると事前に判明している患者血清を用いて,両者においてヘパリン0.1 U/mL存在下で血小板マイクロパーティクルの放出を認めるものとした.その中でも特に放出率が高い健常者ドナーをハイレスポンダードナーとした.ハイレスポンダードナーから採血後に洗浄血小板を作成し,56°C 30分で熱処理した患者検体(血清または血漿)に添加し,ヘパリンの有無(0, 0.1, 0.3 U/mL)と高濃度ヘパリン100 U/mL,抗ヒトCD32抗体(クローンIV.3)における血小板マイクロパーティクル放出量をフローサイトメーターで測定した.血小板マイクロパーティクルはCD42b-FITC陽性かつ0.9 μm以下のサイズと定義し,既報より10%以上を陽性とした.

血小板マイクロパーティクル法(platelet microparticle assay: PMA)
機能的測定法ではヘパリンなし,0.1または0.3 U/mL,ヘパリン100 U/mLまたは抗ヒトCD32抗体(IV.3)で評価する必要があり,ヘパリン依存性の有無や高濃度ヘパリン,IV.3で完全に失活すること証明する.HITモノクローナル抗体(5A1)7.5 μg/mLでヘパリン依存性に活性化する血小板ドナーでCLIA-IgGがともに陽性の2検体で評価すると,高力価サンプルではヘパリン依存性の血小板活性化(マイクロパーティクルの放出)を認め,低力価サンプルでは血小板活性化を認めなかった.前者のCLIA-IgGは真の陽性,後者は偽陽性と判定できる.
HIT診断を目的として測定するいわゆるHIT抗体検査は感度が優れているものの偽陽性が多いため,予期せずに陽性になった場合,しばしば診断に難渋する.確定診断には健常者の血小板を用いて,患者血清に血小板活性化能を有するHIT抗体が存在するかを評価する必要があるが本邦ではその手段が限られている.HITに関する知識と血小板機能(活性化機序)に関する知識を熟知し,高い精度管理が求められる検査でありそれを標準化していくにはまだハードルは高いがさらなる研究を重ねることで本検査法がどこでも可能となるようなデータ蓄積が重要である.
本論文発表内容に関連して開示すべき企業等との利益相反なし