要 旨
卵子の発育および成熟には、それを内在する卵胞の良好な発育が必要不可欠である。特に初期卵胞はFSH受容体を有していないため、良好な初期卵胞発育のためにはゴナドトロピンよりも、卵巣局所因子が重要であることが考えられる。卵巣局所因子のうち、特にTGF-βsuperfamily
に属するbone morphogenetic
protein(BMP)サイトカインがこれまで良く研究されてきた。本稿では卵巣におけるBMPサイトカインについて、我々の行ってきた研究も含め紹介する。
1.BMPサイトカインについて
BMPはTGF-βスーパーファミリーメンバーに属し、異所性骨化を促す物質として1965年Uristらにより同定された[1]。現在ではBMP様の物質はBMP-1~-20、GDF-1~-9などが同定されており、骨関連細胞だけでなく、多くの細胞における増殖・分化・アポトーシス・細胞の形態等に関与することが知られている。
卵巣においてFSH,LH等のゴナドトロピンが卵巣機能制御の中心を担っていることは明らかである。しかしin
vitroではFSHは顆粒膜細胞のエストロゲンおよびプロゲステロン産生を誘導するのに対し、in
vivoでは卵胞発育期に血中FSHの上昇に伴い、血中エストロゲン濃度は増加するもののプロゲステロン濃度は低値を示し、排卵時のLH刺激後に急上昇する[2]。このin vitroと in
vivoにおける結果の乖離の原因は不明であった。
Shimasakiらは莢膜細胞より分泌されるBMP-4,-7が単独では顆粒膜細胞におけるエストロゲン、プロゲステロン産生に影響を与えないものの、FSH存在下ではエストロゲン産生を上昇させる一方でプロゲステロン産生を抑制することを見出し、莢膜細胞より分泌されるBMPが顆粒膜細胞の黄体化抑制作用を有することが明らかとなった[3]。また、Matzukらのグループにより、GDF-9のノックアウトマウスが一次卵胞の段階で卵胞発育停止を生じたことから卵胞発育に関しての研究が開けた[4]。その後、GDF-9に相同性をもつ蛋白としてBMP-15(GDF-9B)が同定され、同遺伝子の異常がヒツジやヒトにおける卵巣機能不全を引き起こすことが確認された[5,6]。GDF-9とBMP-15は種々の動物において卵子に特異的に発現することから、卵子より分泌されるBMPが初期卵胞発育に重要であることが明らかになった[6]。
2.ヒト卵巣におけるBMPサイトカイン発現
我々がこれまで、検討してきたヒト卵巣構成細胞におけるBMPサイトカイン発現を図1に示す[7-9]。いずれのサイトカインも初期卵胞から発現を認めている。

図1
活性型BMPサイトカインの分泌には、プロプロテインからのプロセッシング過程が重要である[10]。この過程でproprotein convertase subtilisin
/kexin(PCSK)6などが関与しているといわれている。我々はBMPサイトカイン刺激がヒト顆粒膜細胞におけるPCSK-6の発現を抑制することから、BMPサイトカインとPCSK6発現にはnegative
feedback機構が存在することを見出した[11]。
3.BMP受容体
BMPおよびGDFは2種類のセリン・スレオニンキナーゼ型のレセプター(I型とII型)に結合し、Smad蛋白を活性化して細胞内にシグナルを伝達する。BMPはI型受容体としてALK-2
(ActR-I),ALK-3(BMPR-IB),ALK-6(BMPR-IA)の三種類を、II型受容体としてBMPR-II,ActR-II,ActR-IIBを使用することが知られている。これら受容体は卵子、顆粒膜細胞、莢膜細胞に発現することが知られている[6]。BMPリガンドによるこれらの受容体の活性化により、Smad
1/5/8のリン酸化が生じ、Smad4と結合して核内へ刺激が伝達される。一方、GDF、アクチビン、TGF-βはI型受容体としてALK-4(ActR-IB),ALK-5(TβR-I),ALK-7を、II型受容体としてBMPR-II,ActR-II,ActR-IIB,TβR-IIを使用することが知られている[6]。その後BMPとは異なりSmad
2/3のリン酸化が生じ、Smad4と結合して核内へ刺激が伝達される[12]。
4.BMPの機能について
4-1 始原生殖細胞との関連
BMP-4のノックアウトマウスでは、始原生殖細胞(primordial germ
cell,PGC)が完全欠損しており、ヘテロ体でも著明にPGCが減少することが報告されている[13]。同様にBMP-2
やBMP-8b欠損マウスでも同様の表現系を示す[14,15]。興味深いことにBMPのI型受容体であるALK-2欠損マウス[16]やBMPにより活性化されるSMAD-1や-SMAD-5の欠損マウスでは同様にPGCの減少・欠損を示すことから[17,18]、卵巣形成にBMPサイトカインの果たす役割は大きいことが伺える。
4-2 FSH受容体誘導作用
我々はヒト顆粒膜細胞にBMPサイトカイン,GDF-9,アクチビンを添加し検討を行ったところ、BMPサイトカインの共通作用として、FSH受容体の発現を上昇させ、またLH受容体の発現を低下させることで、卵胞の黄体化を抑制しつつ卵胞発育を促進することを見出した(図2A)[7-9,19]。healthy follicle
ではFSH受容体が高発現しており、FSHに反応してさらに成長することが期待される。我々はhealthy follicle
においてFSH受容体誘導作用を有するBMP-6の発現が強いことを認めた[8]。また、成人女性において卵巣顆粒膜細胞からのみ産生されるAMHは卵胞数を反映するため、血中AMH濃度測定が不妊治療の現場ではよく行われている。我々はBMPサイトカインが顆粒膜細胞におけるAMH発現を誘導することを見出した(図2B)[19]。血中AMH濃度が陽性症例の血中BMP-2,-6,-7濃度を測定したところ、測定感度以上を示した症例は少なく、またBMPサイトカインと血中AMH濃度間には相関関係を認めなかったことから、血中BMPサイトカイン濃度測定は意義が低いことが判明した[20]。

図2A

図2B
現行の不妊治療では内因性FSHの誘導もしくはFSH製剤投与により卵胞発育を誘導している。下垂体より産生されるFSHが卵胞に到達するためには、卵胞周囲における良好な血管網の形成が必要である。卵胞は二次卵胞から血管網を形成することが知られているが、その制御は不明である。我々は莢膜細胞由来のBMP-7がヒト顆粒膜細胞に働きかけ、VEGFを誘導し、また一方で血管内皮細胞の細胞数を増加させるとともに、内皮細胞におけるVEGF受容体を誘導することで卵胞周囲の血管網形成に関与する可能性を見出した(図3)[21]。即ち、BMP-7の初期卵胞への作用として、卵胞における血管網およびFSH受容体を誘導することで血中FSHに反応しやすくさせる作用が考えられる。
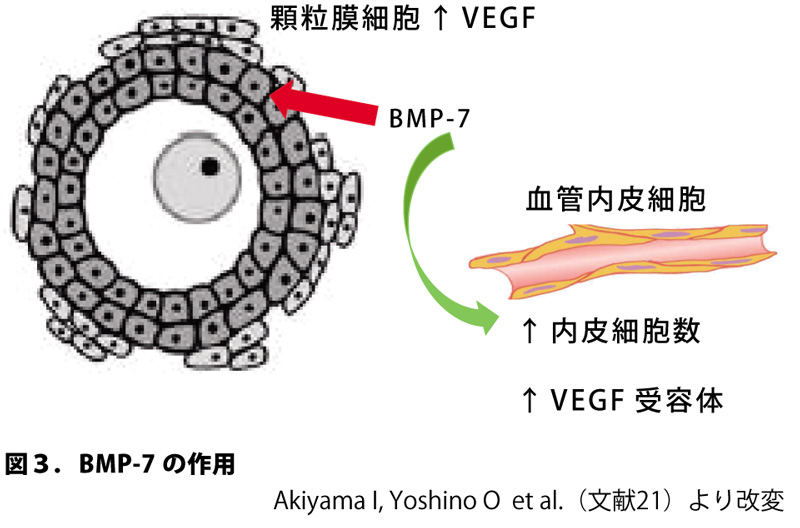
図3
排卵とは炎症性反応と捉えられている。黄体化未破裂卵胞(LUF)症例に対するGranulocyte colony-stimulating
factor(G-CSF) 投与の有効性が報告されていることから、排卵における好中球の関与が示唆される[22]。卵子および顆粒膜細胞に存在するBMP-6は、そのノックアウトマウスの排卵数が減少することから、排卵に関与することが知られている[23]。我々は、排卵前の顆粒膜細胞で強発現を示すBMP-6がヒト顆粒膜細胞に作用して好中球遊走能を有するケモカインGRO-αを誘導し、また好中球プロテアーゼ阻害作用を有するsecretory
leukocyte peptidase
inhibitor(SLPI)の顆粒膜細胞における発現を減少させることで、好中球が作用し易い環境を提供していることを見出した[24]。また、我々は排卵直前のマウス卵子ではBMP-15蛋白の発現および分泌を認めた[25]。排卵直前にBMP-15蛋白が分泌される意義を調べるため、マウス卵子―卵丘細胞複合体(cumulus
oocyte
complex,COC)を用いて卵丘膨化作用について検討を行った。卵丘膨化とは卵子周囲の顆粒膜細胞間にヒアルロン酸が蓄積することで引き起こされる。ヒアルロン酸蓄積によりCOCは物理的に体積が増大することで排卵が促進され、また排卵時に多く存在するプロテアーゼによる卵子の質低下を防ぐことが知られている。マウスCOCにBMP-15蛋白の添加したところ、卵丘膨化誘導作用を認め、BMP-15が排卵に関与することを見出した[25]。(図4)

図4
図2Cに示すように、我々はBMPサイトカインがヒト顆粒膜細胞におけるプロゲステロン産生の律速段階を担うStAR発現を抑制することを認めている[7-9,19]。排卵後には黄体化抑制作用を有するBMPサイトカインは、作用を減弱する必要がある。卵子に発現するBMP-6、BMP-15、GDF-9は排卵することで卵胞から消失し、卵胞の黄体化を促進する。また、排卵時のLH刺激は、顆粒膜細胞からBMPサイトカインの阻害物質であるBAMBIを誘導することを認めた[9]。即ち、黄体化抑制作用を有するBMPサイトカインは、排卵後にはその発現および作用を低下させることで、顆粒膜細胞の黄体化促進に寄与することを認めた。

図2C
5.おわりに
我々はヒトにおいても他の動物種と同様にBMPシステムが卵巣機能に重要な役割を担うことを示してきた。今後、BMPサイトカインを利用した卵巣機能不全患者の治療の可能性を追求していきたい。
文 献
- 1) Urist MR: Bone: formation by
autoinduction. Science 1965;150:893-899.
- 2) Groome NP, Illingworth PJ, O'Brien M, Pai
R, Rodger FE, Mather JP, McNeilly AS: Measurement of dimeric inhibin B
throughout the human menstrual cycle. J Clin Endocrinol Metab
1996;81:1401-1405.
- 3) Shimasaki S, Zachow RJ, Li D, Kim H,
Iemura S, Ueno N, Sampath K, Chang RJ, Erickson GF: A functional bone
morphogenetic protein system in the ovary. Proc Natl Acad Sci U S
A 1999;96:7282-7287.
- 4) Dong J, Albertini DF, Nishimori K, Kumar
TR, Lu N, Matzuk MM: Growth differentiation factor-9 is required during early
ovarian folliculogenesis. Nature
1996;383:531-535.
- 5) Dube JL, Wang P, Elvin J, Lyons KM,
Celeste AJ, Matzuk MM: The bone morphogenetic protein 15 gene is X-linked and
expressed in oocytes. Mol Endocrinol
1998;12:1809-1817.
- 6) Shimasaki S, Moore RK, Otsuka F, Erickson
GF: The bone morphogenetic protein system in mammalian reproduction.
Endocr Rev 2004;25:72-101.
- 7) Shi J, Yoshino O, Osuga Y, Nishii O, Yano
T, Taketani Y: Bone morphogenetic protein 7 (BMP-7) increases the expression of
follicle-stimulating hormone (FSH) receptor in human granulosa cells.
Fertil Steril 2010;93:1273-1279.
- 8) Shi J, Yoshino O, Osuga Y, Koga K, Hirota
Y, Hirata T, Yano T, Nishii O, Taketani Y: Bone morphogenetic protein-6
stimulates gene expression of follicle-stimulating hormone receptor,
inhibin/activin beta subunits, and anti-Mullerian hormone in human granulosa
cells. Fertil Steril 2009;92:1794-1798.
- 9) Shi J, Yoshino O, Osuga Y, Koga K, Hirota
Y, Nose E, Nishii O, Yano T, Taketani Y: Bone morphogenetic protein-2 (BMP-2)
increases gene expression of FSH receptor and aromatase and decreases gene
expression of LH receptor and StAR in human granulosa cells. Am J Reprod
Immunol 2011;65:421-427.
- 10) Hashimoto O, Moore RK, Shimasaki S:
Posttranslational processing of mouse and human BMP-15: potential implication in
the determination of ovulation quota. Proc Natl Acad Sci U S A
2005;102:5426-5431.
- 11) Akiyama I, Yoshino O, Osuga Y, Shi J,
Hirota Y, Hirata T, Harada M, Koga K, Fujimoto A, Yano T, Taketani Y: The
localization and regulation of proprotein convertase subtilisin/kexin (PCSK) 6
in human ovary. Am J Reprod Immunol
2012;68:491-498.
- 12) Miyazawa K, Shinozaki M, Hara T, Furuya
T, Miyazono K: Two major Smad pathways in TGF-beta superfamily signalling.
Genes Cells 2002;7:1191-1204.
- 13) Lawson KA, Dunn NR, Roelen BA, Zeinstra
LM, Davis AM, Wright CV, Korving JP, Hogan BL: Bmp4 is required for the
generation of primordial germ cells in the mouse embryo. Genes
Dev 1999;13:424-436.
- 14) Ying Y, Liu XM, Marble A, Lawson KA, Zhao
GQ: Requirement of Bmp8b for the generation of primordial germ cells in the
mouse. Mol Endocrinol 2000;14:1053-1063.
- 15) Ying Y, Zhao GQ: Cooperation of
endoderm-derived BMP2 and extraembryonic ectoderm-derived BMP4 in primordial
germ cell generation in the mouse. Dev Biol
2001;232:484-492.
- 16) de Sousa Lopes SM, Roelen BA, Monteiro
RM, Emmens R, Lin HY, Li E, Lawson KA, Mummery CL: BMP signaling mediated by
ALK2 in the visceral endoderm is necessary for the generation of primordial germ
cells in the mouse embryo. Genes Dev
2004;18:1838-1849.
- 17) Chang H, Matzuk MM: Smad5 is required for
mouse primordial germ cell development. Mech Dev
2001;104:61-67.
- 18) Tremblay KD, Dunn NR, Robertson EJ: Mouse
embryos lacking Smad1 signals display defects in extra-embryonic tissues and
germ cell formation. Development
2001;128:3609-3621.
- 19) Ogura-Nose S, Yoshino O, Osuga Y, Shi J,
Hiroi H, Yano T, Taketani Y: Anti-Mullerian hormone (AMH) is induced by bone
morphogenetic protein (BMP) cytokines in human granulosa cells. Eur J
Obstet Gynecol Reprod Biol 2012;164:44-7
- 20) Ogura-Nose S, Yoshino O, Akiyama I,
Hirota Y, Hirata T, Harada M, Hiroi H, Koga K, Saito S, Osuga Y, Fujii T: Serum
concentration of bone morphogenetic proteins (BMPs) is not linked toserum
anti-mullerian hormone (AMH) level Integrative Molecular
Medicine 2011; 1: 26-28
- 21) Akiyama I, Yoshino O, Osuga Y, Shi J,
Harada M, Koga K, Hirota Y, Hirata T, Fujii T, Saito S, Kozuma S: Bone
morphogenetic protein 7 increased vascular endothelial growth factor (VEGF)-a
expression in human granulosa cells and VEGF receptor expression in endothelial
cells. Reprod Sci 2014;21:477-482.
- 22) Makinoda S, Hirosaki N, Waseda T,
Tomizawa H, Fujii R: Granulocyte colony-stimulating factor (G-CSF) in the
mechanism of human ovulation and its clinical usefulness. Curr Med
Chem 2008;15:604-613.
- 23) Sugiura K, Su YQ, Eppig JJ: Does Bone
Morphogenetic Protein 6 (BMP6) Affect Female Fertility in the Mouse?
Biol Reprod 2010.
- 24) Akiyama I, Yoshino O, Osuga Y, Shi J,
Takamura M, Harada M, Koga K, Hirota Y, Hirata T, Fujii T, Saito S, Kozuma S:
The role of bone morphogenetic protein 6 in accumulation and regulation of
neutrophils in the human ovary. Reprod Sci
2014;21:772-777.
- 25) Yoshino O, McMahon HE, Sharma S,
Shimasaki S: A unique preovulatory expression pattern plays a key role in the
physiological functions of BMP-15 in the mouse. Proc Natl Acad Sci U S
A 2006;103:10678-10683.





