2020 年 15 巻 1 号 p. 43-50
2020 年 15 巻 1 号 p. 43-50
国立がん研究センター中央病院における終末期鎮静の施行状況を後方視的に調査した.2015年4月〜2016年3月に死亡退院した431例中75例(17.4%)に鎮静が施行された.患者背景は男/女48/27例,年齢61(5〜83)歳,原発巣は肺/膵/血液/骨軟部/その他18/11/11/8/27例と若年・希少がんが多く,対象症状は呼吸困難(38例)とせん妄(30例)が多かった.72例でミダゾラムが使用された.死亡時には61例で持続的深い鎮静が実施されており,鎮静開始後の生存期間は2(0〜54)日であった.緩和ケアチーム(PCT)介入群は非介入群と比べて低年齢(58 vs. 62.5, P=0.048),ミダゾラム開始量が均一(5-12 vs. 9.6-25.2 mg/日)であり,PCT介入の有無で鎮静施行状況が異なる可能性が示唆された.
緩和ケアの普及・発展に伴い,がん患者の症状緩和の質も向上しつつあるが,死期が近い終末期がん患者の一部は,症状に焦点をあてた治療では緩和することができない苦痛を体験し,療養上の大きな問題となる.終末期における苦痛緩和のための鎮静(以下,鎮静)は,このような治療抵抗性の耐え難い苦痛を緩和するための必要かつ重要な治療手段と位置付けられている.鎮静に関しては各国の学術団体が適応や意思決定などを含めたガイドライン1〜4)を策定しており,国内では日本緩和医療学会が2005年にガイドライン初版を公開,2010年の改訂1)を経て,2018年に「がん患者の治療抵抗性の苦痛と鎮静に関する基本的な考え方の手引き」2)を発刊した.この間にも鎮静の概念は大きな変遷を遂げており,とくに倫理的にも実践上も最も配慮が必要とされる持続的深い鎮静のあり方については国際的にさまざまな議論が続いている.
終末期鎮静の施行状況は医療者間あるいは施設間で大きな差があることが知られており5〜7),実態調査は重要であるが,国内外の終末期がん患者の鎮静に関する報告の多くはホスピス,緩和ケア病棟からのものが中心で,がん専門病院における実態はほとんど明らかになっていない.国立がん研究センター中央病院(以下,当院)は,国の医療政策として,がんその他の悪性新生物に関する高度かつ専門的な医療を担うがん専門病院(病床数578床)であり,緩和ケア病棟は設置されていないが,緩和ケアチーム(Palliative care team: PCT)が年間約1,200例(研究当時)の患者の専門的緩和ケアを担っている.
そこで本研究では,当院における苦痛緩和のための鎮静の施行割合,鎮静期間,対象症状,使用薬剤,患者・家族の意思決定過程などの状況を後方視的に調査することで,がん専門病院に特有の終末期鎮静の施行状況,PCTの介入がそれらに及ぼす影響について探索することとした.
2015年4月から2016年3月に当院一般病棟を死亡退院した全患者の診療録を後方視的に調査し,鎮静の施行状況をPCT介入の有無により比較した.
鎮静の定義本研究における鎮静の定義は,「患者の苦痛緩和を目的として患者の意識を低下させる薬剤を投与すること」1)とし,該当する場合を鎮静ありとした.苦痛緩和のために投与した薬剤によって生じた意識の低下を意図的に維持すること(副次的鎮静),意識低下の意図を伴わない鎮静薬の投与,集中治療における人工呼吸中の鎮静は除外した.
調査項目患者背景として,年齢,性別,がん種,入院時Performance status(PS)(Eastern Cooperative Oncology Group: ECOG),入院経緯,入院期間,PCT介入の有無,死亡前1カ月以内の抗がん治療歴,死亡前48〜72時間の輸液量などを調査した.また,鎮静の施行状況としては,鎮静の有無,鎮静の対象症状,鎮静期間,鎮静様式(持続的鎮静/間欠的鎮静),鎮静水準(深い鎮静/浅い鎮静),鎮静薬とその投与量,併用薬とその投与量,意思決定過程などについて調査した.鎮静様式,鎮静水準に関しては,診療録の経過記録,鎮静に関する説明同意文書や説明内容の記録,カンファレンス記録などから総合的に判断した.
倫理的配慮本研究はヘルシンキ宣言に則り,「人を対象とする医学系研究に関する倫理指針」を遵守し,国立がん研究センター研究倫理審査委員会による審査・承認の下に実施した.本研究は日常診療における鎮静の施行状況に関する後方視的調査であり,すでに死亡退院した患者を対象とすることから,個別の同意取得は行わなかったが,当院公式ホームページ内で研究実施情報を公開し,患者の家族等からデータ利用の拒否があった場合は,研究対象から除外することとした.
解析調査項目について記述統計を行い,度数分布を求めた.鎮静の有無,患者の背景因子,薬剤投与量などに関して,カテゴリー変数においてはχ2検定,連続変数においてはMann-WhitneyのU検定を行った.生存解析はLog-rank検定を行い,Kaplan-Meier法による生存曲線を作成した.解析結果は,いずれもP<0.05の場合に有意差ありと判定した.
対象期間中の総死亡退院447例中,集中治療室における死亡症例を除いた一般病棟における死亡退院431例(全例がん患者)を調査対象として解析した.このうち75例(17.4%)で鎮静が施行された(PCT介入群29/111例(26.1%) vs. 非介入群46/320例(14.4%),P= 0.005).
鎮静施行例の患者背景を表1に示す.年齢中央値(範囲)は61(5〜83)歳,39歳以下の小児,思春期・若年成人(Adolescent and young adult: AYA)世代患者が11例(14.7%)を占めていた.原疾患は肺がん18例(24.0%),膵がん11例(14.7%),造血器腫瘍11例(14.7%),骨軟部腫瘍8例(10.7%)が高い比率を占めた.最終入院時点で32例(42.7%)の患者がPS (ECOG)3〜4であった.また,死亡1カ月前の時点で21例(28.0%)の患者が抗がん治療を継続しており,死亡48〜72時間前の時点で26例(34.7%)の患者が1 L/日以上の輸液を受けていた.PCT介入群は,非介入群と原疾患の構成割合が異なり(P=0.015),小児・AYA世代患者が7例を占め,年齢中央値(範囲)が有意に低かった(58(5〜83)歳 vs. 62.5(38〜82)歳,P=0.048).
鎮静対象となった治療抵抗性の耐え難い苦痛の内訳を図1に示す.鎮静施行例75例中21例で2症状,4例で3症状を対象として鎮静が行われ,対象症状は計104件に及び,呼吸困難38例(50.7%),せん妄30例(40.0%)が多数を占めた.PCT介入群ではせん妄が14例(48.3%)と最多であった.疼痛単独は2例(2.7%),精神的苦痛単独を対象とした鎮静はみられなかった.また,小児・AYA世代患者における対象症状は,呼吸困難6例(54.5%),せん妄4例(36.4%),疼痛2例(18.2%),痙攣2例(18.2%)の順であった.
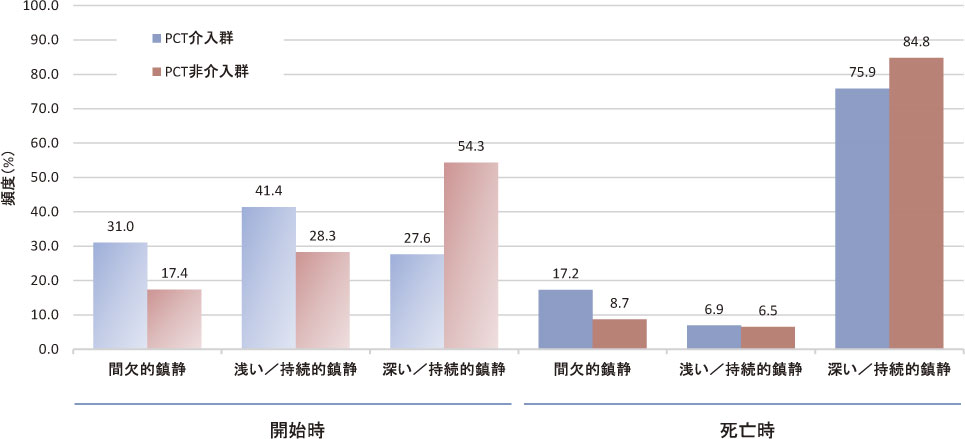
使用された鎮静薬はミダゾラムが72例(96.0%)と大半を占め,うちPCT介入群2例でフェノバルビタール追加併用を要した.その他,フルニトラゼパム,ハロペリドール(PCT介入群),モルヒネ(非介入群)が各1例に鎮静を意図して投与された.鎮静開始時,死亡時の鎮静様式・鎮静水準を図2に示す.鎮静は全例死亡時まで継続され,開始時から持続的深い鎮静を施行したのは33例(44.0%)であったが,死亡時には61例(81.3%)まで増加した.小児1例は浅い間欠的鎮静を継続していた.ミダゾラム持続投与量(範囲)は開始時12(2.4〜60) mg/日,死亡時24(0〜153.6) mg/日(最終日投与中止例あり)であった.統計学的有意差はなかったが,ミダゾラム開始量中央値(四分位範囲)は,PCT介入群9.6(5〜12) mg,非介入群12.8(9.6〜25.2) mgであり,PCT介入群では開始量が少ない傾向にあった(P=0.061)(図3).なお,持続的深い鎮静を意図したなかにミダゾラムによる急速導入2,8,9)を行ったものはなかった.また,鎮静開始時に併用されていたオピオイドの経口モルヒネ換算1日投与量中央値(範囲)は,PCT介入群160.0(14.4〜1,344) mg/日,非介入群48.0(0〜384) mg/日であり,PCT介入群ではオピオイドが有意に多く投与されていた(P<0.001)(付録図1).
次に最終入院時を起点としたKaplan-Meier法による生存曲線を図4に示す.生存期間を鎮静の有無で比較した場合,統計学的な有意差はなかった.また,鎮静開始後の生存期間中央値(範囲)は2(0〜54)日であった(PCT介入群3日vs. 非介入群1日,P= 0.236)(付録図2).
意思決定過程に関しては,鎮静開始に際して全例家族への説明内容,同意の記録は診療録に記載されていていたが,患者本人の意向に関しては不明瞭な記載が多く,診療録記載内容から鎮静への意向が確認できたのは22例(29.3%)であった(PCT介入群10/111例(34.5%) vs. 非介入群12/320例(26.1%),P=0.437).


*Mann-WhitneyのU検定

終末期がん患者に対する鎮静の実態調査はこれまでホスピス,緩和ケア病棟からのものが中心で,がん専門病院からの報告は少なく10,11),国内の現状に至ってはほとんど知られていない.本研究は,がん専門病院における鎮静の実態を示した国内初の調査報告である.当院には緩和ケア病棟は設置されていないが,PCTが専門的緩和ケアにおいて中心的役割を担っている.そこで本研究では,鎮静におけるPCTの役割を考察することを目的に,PCT介入の有無に焦点を当てて比較検討を実施した.
Maltoniらが1980〜2010年の11文献をまとめた系統的レビュー6)によると,終末期がん患者における鎮静施行割合(範囲)は34.4%(14.6〜66.7%),Maedaらによる本邦58施設を対象にした研究12)では,15%の患者が持続的深い鎮静を受けたと報告されている.本研究全体における鎮静施行割合は17.4%と,これらの報告とほぼ同様の結果となった.一方,PCTの介在しない鎮静も相当数あることが明らかになった.PCT介入群(26.1%)では,非介入群(14.4%)と比較して有意に鎮静施行割合が高く,これには両群間の原疾患の構成割合が異なることが影響している可能性があり,また,治療抵抗性の耐え難い苦痛を有する患者ではPCT紹介率が高いこと,あるいはPCTは鎮静導入の判断基準が非PCT医療者と異なっている可能性が考えられる.
鎮静施行例の患者背景としては,39歳以下の小児・AYA世代患者が14.7%を占めたこと,造血器腫瘍(14.7%),骨軟部腫瘍(10.7%)などの希少がんが高い比率を占めたことが特記される.Caraceniらによるイタリアのがん専門病院からの報告10)でも肉腫が対象患者の20%を占めたことが示されているが,当院では2014年に希少がんセンターが開設され,全国から多くの希少がん患者が集まり,小児・AYA世代患者が増加している.PCT介入群で年齢が有意に低かったのは,小児・AYA世代患者への心理社会的支援の必要性が認識されており,PCT紹介率が高いことによると考えられる.
前述のMaltoniらの報告6)では,鎮静の対象症状はせん妄,呼吸困難,精神的苦痛,疼痛の順で多かったとされている.当院では複数症状の合併が多かったが,対象症状としては呼吸困難,せん妄の順であり,PCT介入群ではせん妄が最多であった.一般に難治性疼痛に対する鎮静は,苦痛緩和を目指す諸選択肢の中で鎮静が相対的に最善と判断されるか否か,すなわち相応性が議論されることが多く,精神的苦痛に関しては,複数のガイドラインで単独で鎮静の適応となることは例外的とされている1〜4).本研究で疼痛単独を対象とした鎮静は限定的であったこと,精神的苦痛単独を対象とした鎮静はみられなかったことは,これを支持する結果であると考えられる.また,Jalmsellらは小児がん患者の遺族調査において,死亡前1カ月以内に影響の大きかった症状として,倦怠感86%,行動能力低下76%,疼痛73%,食欲不振71%を挙げているが13),本研究における小児・AYA世代患者の鎮静対象症状としては,呼吸困難54.5%,せん妄36.4%の順で,研究全体と同様の傾向であった.
使用された鎮静薬はミダゾラムが大半を占め,鎮静に用いる第1選択薬としての認識は普及していると考える.一方でPCT介入群では,ミダゾラム開始量が少ない傾向にあり,非介入群では至適開始量の見解が一致していないことが示唆された.ミダゾラム投与量は,鎮静開始時から死亡時にかけて大幅に増加しており,耐性出現の可能性も推察される.そのような場合に,少数例ではあるがフェノバルビタールを追加併用して改善を得た症例があり,状況に応じて有用な選択肢になり得ると考えられる.ハロペリドールやオピオイドは鎮静に用いる主たる薬剤としては推奨されないが,PCT非介入例や夜間・休日PCT不在時に鎮静を開始した例で,これらの薬剤を意識低下の意図の下で使用した症例が確認された.なお,当院では医療安全の観点から,プロポフォールとデクスメデトミジンの一般病棟での使用を制限しており,それらの使用例はなかった.また,坐薬による鎮静も行われなかったが,入院下で静脈ルート等を確保しやすい状況で,調節性に劣る坐薬を用いる利点が少なかったためと考えられる.併用薬に関しては,PCT介入の有無で鎮静開始時のオピオイド投与量に極めて大きな差があったことが特記される.PCT介入群で痛みに難渋する症例が多かった可能性はあるが,PCT非介入群で鎮静の要件としての相応性の評価,とくにオピオイドの効果が期待される症状において治療抵抗性の確実さが適切に評価されていたかは議論の余地がある.
最終入院時を起点とした生存解析では,鎮静の有無で生存期間に有意差はなかった.先行研究では,Maedaらによる傾向スコア法で補正を行った多施設前向き観察研究の解析結果から,持続的深い鎮静は患者の生存期間を短縮させないことが示されており12),単純比較ではあるが,本研究の結果もこれを支持するものである.また,鎮静開始後の生存期間すなわち鎮静期間に関しては,PCT介入の有無では統計学的な有意差はなく,いずれも死亡前数日以内が大半を占めていた.Bellerらによる系統的レビューでは,9件の研究の平均鎮静期間の範囲は19時間~3.4日間と報告しており5),本研究も同様の結果であることが確認された.
意思決定過程に関しては,1980〜2013年に発表された9つのガイドラインをまとめたSchildmannらの報告によると,7件のガイドラインで医師以外の多職種の参加を推奨するとされており4),チームによる判断という倫理的要件からもPCT介入が望ましいと考えられる.また,鎮静開始に際して,全例家族の同意は得られていたが,診療録記載内容から患者本人の意向が確認できたのは29.3%に過ぎず,本人の意向あるいは推定意思という文脈での診療録記載が少なかった.Moritaらの本邦の緩和ケア病棟を対象とした多施設前向き研究14)では,患者本人が鎮静開始に明確な同意を示したのは67%と報告されている.本研究においては,全身状態の悪化から明らかに意思表明できない場合もみられたが,研究当時は診療録記載内容の整備が不十分であったため,後方視的調査では本人の意向に関して正確な状況を評価できなかった.意思決定過程に関する詳細な調査は今後の検討課題である.
本研究の限界本研究の限界として,後方視的調査であること,診療録記載内容が統一されていなかったことから,鎮静の効果,患者の意思決定過程,家族の体験に関する質的評価ができなかったことが挙げられる.また,単施設研究であるため,結果が一般化できず,他の国内外のがん専門病院の実情とは異なることが推察される.さらに研究期間中に国内ガイドラインが改訂され,鎮静の定義,概念が大幅に見直されたため,新たな枠組みに基づいて調査した場合,一部の結果に差異が生じる可能性は否定できない.
しかし,本研究はがん専門病院における鎮静の実態を示した国内初の調査報告であり,当院における鎮静対象患者の特徴として,小児・AYA世代の若年患者,肉腫などの希少がん患者が高い比率を占めたことは特記される.希少がん患者の治療抵抗性の症状の緩和,小児・AYA世代患者における意思決定支援や家族ケアのあり方に関しては,今後議論を重ねるべき課題である15〜17).本研究におけるPCT介入の有無による比較から,PCTは相応性,医療者の意図,患者・家族の意思,チームによる判断といった鎮静の倫理的妥当性を担保し,鎮静方法の標準化などに寄与する役割があると考える.
がん専門病院における鎮静の施行状況の特徴として,若年・希少がん患者の占める割合が大きいことが明らかとなり,意思決定支援や家族ケアにおける特有の課題の存在が推察された.PCTは鎮静の倫理的妥当性の担保,鎮静方法の標準化などに寄与する可能性が示唆され,今後,さらなる質的検討が必要である.
本研究にご協力いただいた患者様,ご遺族の皆様に心より御礼申し上げます.また,共同研究者の皆様のご支援・ご協力に感謝申し上げます.
清水研:受託研究費(株式会社ツムラ)
その他:該当なし
安田は研究の構想およびデザイン,研究データの収集・分析,研究データの解釈,原稿の起草に貢献;西川は研究の構想およびデザイン,研究データの収集・分析,研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献;高田,石木,木内,清水(正樹),清水(研),山口は研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献;里見は研究の構想・デザイン,研究データの解釈,原稿の重要な知的内容に関わる批判的な推敲に貢献した.すべての著者は投稿論文ならびに出版原稿の最終承認,および研究の説明責任に同意した.