2021 年 37 巻 2 号 p. 147-155
2021 年 37 巻 2 号 p. 147-155
乳幼児の乳び胸は,その多岐にわたる病態・病因の把握が容易ではなく,治療に難渋する症例が少なからずある.しかし近年,画像技術の向上により中枢リンパ管の評価が可能となり,これまで未知であった病態も一部解明されつつある.また,治療技術もめざましく進歩しており,乳び胸の背景に存在する病態を評価することの重要性は増している.病態と画像診断を中心に,乳幼児における乳び胸について述べる.
The pathogenesis of infantile chylothorax (IC) varies widely and is very complicated. Frequently it causes difficulties in treating such patients. The recent improvements in imaging technology have made it possible to evaluate the central lymphatic system and clarify some previously unknown pathophysiologies. Additionally, with marked progress in therapeutic techniques, it is becoming increasingly important to evaluate the underlying condition of patients with IC, and radiologists can contribute to it. Herein, we are going to review the pathophysiologies of IC with imaging findings.
乳幼児に乳び胸が生じる背景は,先天性のものから外傷性,外科手技後のものまで様々であるが,micro surgeryなど治療技術の進歩に伴って,画像による原因,病態の評価の重要性が増している.治療開始前に,乳びが特定の場所からの漏出によるものなのか,胸管からの逆行性のリンパ流によるものなのか,あるいは胸管自体に低形成/異形成があるのか,など病態を鑑別し,治療の選択をすることが重要である.
小児の乳び胸の原因は多岐にわたるが大きくTable 1のように分かれるとされる1).
| 先天性 |
| 先天性リンパ管奇形(lymphangiomatosis, lymphangiectasia) |
| 胸管閉塞 |
| 他の症候群に伴うもの(Down syndrome, Noonan syndrome, Turner syndrome, Ehlers Danlos syndrome, 胎児水腫) |
| 外傷性 |
| 縦隔,心臓,肺の外科的手術あるいはカテーテル操作に伴うもの |
| 分娩による外傷,脊椎過伸展によるもの |
| 中心静脈圧上昇に伴うもの |
| SVCや鎖骨下静脈の塞栓,Fontan術後 |
| 悪性腫瘍 |
| リンパ腫,奇形腫,肉腫,神経芽腫 など |
先天性乳び胸水の頻度は10000出生に1人と稀ではあるが,胎児期・新生児期の胸水の原因としては乳び胸水が最多であり,胎児性胸水の65%を乳び胸水が占めるとされる.男女比2:1で男児に多い2,3).先天性乳び胸の多くは正常な肺の発達が妨げられている要素もあり,生後24時間以内に50%が,1週間以内に75%がなんらかの症状を呈するとされる4).あるいは胎児期早期より乳び胸水が胸腔内を大きく占拠する場合には肺低形成で致死的となることもある.胸腔内圧上昇とたんぱく漏出による低蛋白血症により胎児水腫として顕在化することもある.
先天性乳び胸は先天性リンパ管腫症(Gorham-Stout病,Generalized lymphatic anomaly(GLA)/Kaposiform lymphangiomatosis(KLA)),先天性リンパ管拡張症(lymphangiectasia)などを代表とするリンパ管形成異常に伴って発生するもの,非特異的な胸管の無形成/低形成や閉塞によるもの,Down syndromeやNoonan syndromeなど症候群に伴って発症するもの,と大きく分けられる.
先天性リンパ管拡張症は胸膜下や小葉間のリンパ管がびまん性に拡張した状態で,本来胎生16週頃から退縮するべき肺内リンパ管の退縮が起こらなかったため胸膜下,小葉間,気管支周囲などに発達過程の太いリンパ管が残存している病態ではないかと推測されている5).(全身性)リンパ管腫症の一部として発症する場合もあれば(Case 1(Fig. 1)),肺に限局して症状をきたして発症する場合もあり,満期で出生した児において胸水や心嚢液があり,呼吸窮迫が強い場合は全身のリンパ浮腫のあるなしにかかわらず,先天性リンパ管拡張は考慮されるべき病態である6).
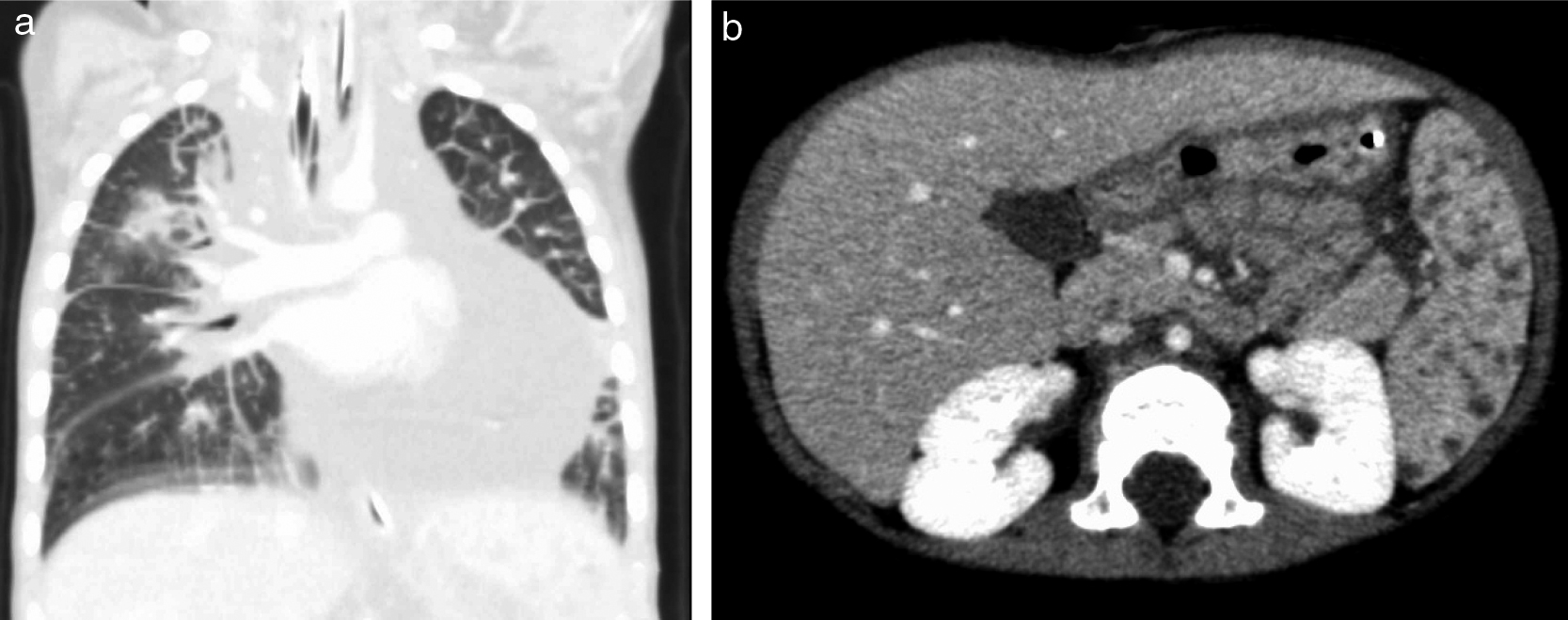
1歳女児,既往歴なし.発熱,感冒症状が続き,単純X線写真で異常を指摘された.画像所見から全身性リンパ管腫症(GLA)の診断に至った.
a:胸部CTでは両側びまん性の小葉間隔壁肥厚,気管支血管束の肥厚が認められる.
b:腹部造影CTで脾臓に多発する低吸収域が認められる.
先天性リンパ管腫症は骨,心臓,肺,縦隔,腹腔,脾臓,皮膚など全身臓器にびまん性にリンパ管組織が浸潤する原因不明の疾患で,幼児期や小児期に発症する.小児期発症例や,乳び胸など胸部病変の存在は,予後不良因子とされる.本邦での先天性リンパ管腫症の全国調査の結果では,Gorham病,GLA,KLAの順に予後が悪くなるとされ,とくにKLAでは15年以上生存した症例はなかった7).
画像診断の向上や,治療の向上による予後の改善が進むにつれ,上述の先天性乳び胸の原因となる病態はオーバーラップして存在し,クリアカットには分けられない症例が多くあることがわかってきている.たとえばNoonan症候群に合併した乳び胸症例では,胸管が欠損したもの,胸管の形成はあるが肺実質に逆行性のリンパ流が認められるもの,びまん性肺リンパ管拡張を呈したものなど病態は一様ではない8).後述する,術後の合併症として発症した乳び胸の中にも胸管に局所的な乳びの漏出点が認められるもの,特定の箇所からではなくびまん性に肺実質へ乳びの逆流・漏出が認められるものなど,病態は様々である.
2. 外科的手術後の乳び胸小児期の乳び胸水の最多の原因を占めるのは,心臓や縦隔,肺などの外科手術後のもので,先天性心疾患術後の2.8–3.9%に乳び胸が生じるとされる9,10)(Case 2(Fig. 2)).特にGlenn/Fontan手術では術後乳び胸の発生頻度は5.7%と最も多く,次いで完全大血管転位術後4.3%と右心バイパス術で術後乳び胸の発生頻度は高くなる9).かつては手技によるリンパ管の直接損傷が主たる術後乳び胸の原因と推測されていたが,実は直接損傷によるものは10%以下と少なく,半数以上は術後の静脈圧の変化などを契機に胸管からリンパ液が肺実質や縦隔に逆行性に流れる経路から発症するものであることがわかってきた(※脚注参照pulmonary lymphatic perfusion syndrome; PLPS).術後に生じる乳び胸の,残りの1/3程度は中枢リンパ管自体に低形成,異形成,閉塞など元来異常がありリンパ液が広範囲の皮膚に逆流する病態であるとされる11).(※脚注参照,central lymphatic flow disorder CLFDあるいは congenital lymphatic dysplasia(CLD))
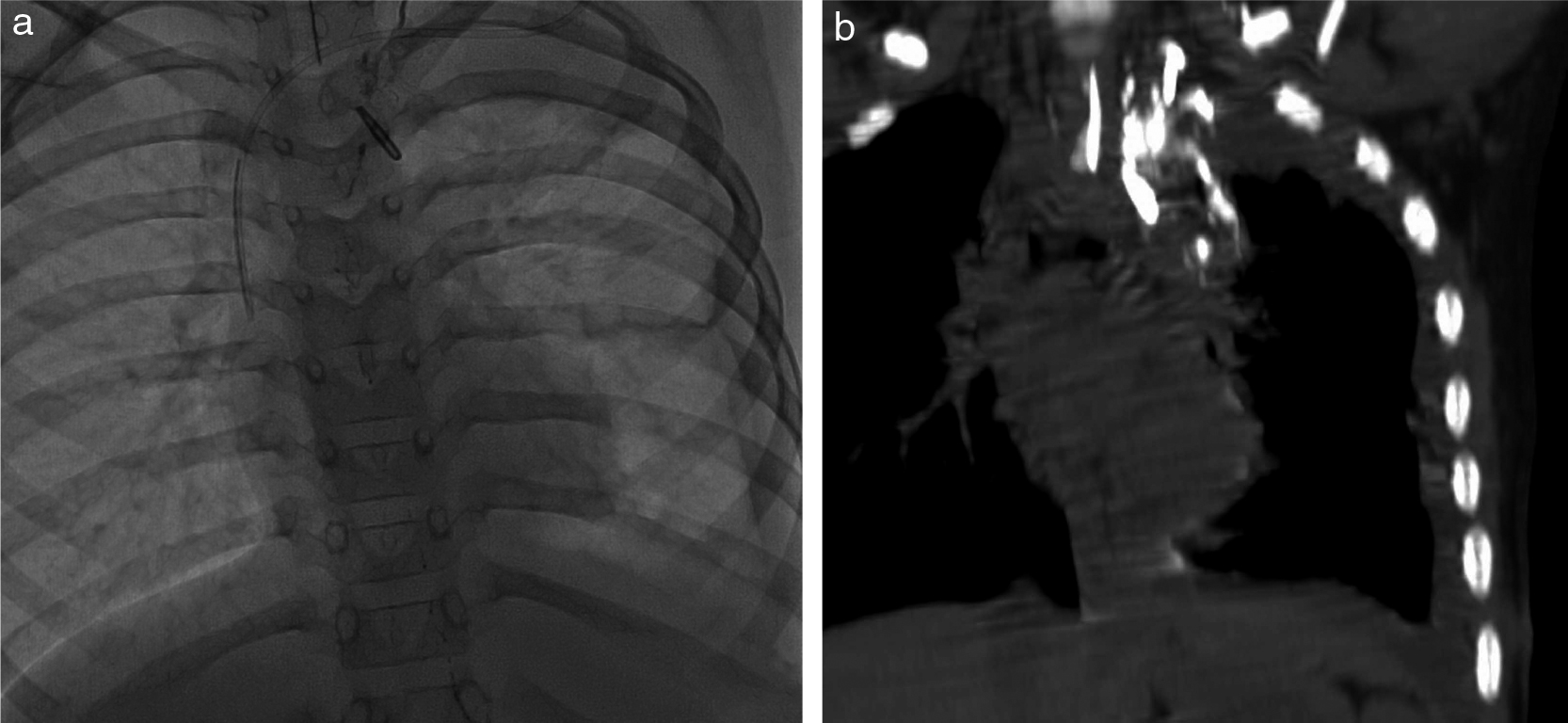
3歳女児,21 trisomy.右側大動脈弓+左鎖骨下動脈起始異常に対する根治術後に乳び胸水を生じた.リンパ管シンチグラフィで左胸腔内への漏出を疑う所見が認められたが,明らかな漏出点は確認できなかった.
a:リンパ管造影で左静脈角付近から造影剤の漏出が認められる.
b:リンパ管造影後CTで左静脈角近傍の漏出部位が明瞭に描出される.
無症状に経過し術後の単純写真で偶然発見されることも,胸水貯留による圧迫に伴う咳や呼吸困難,胸痛などで発症することもある.乳びに含まれる成分が漏出することによる電解質異常,たんぱくやビタミンの漏出による低栄養や,ガンマグロブリンの損失に伴う易感染性が発見の契機となることもある.アンチトロンビンの喪失により乳び胸の児は血栓リスクが高くなるともされる12).Fontan手術などの術後の循環動態を考えると静脈圧を低下させることが現実的には不可能で,心臓手術後の乳び胸水の治療は難渋することがしばしばあり乳び漏出のコントロールが難しく治療が長期にわたった場合には,致死的にもなりうる.
3. 腫瘍性病変に伴う乳び胸胸部に生じた悪性腫瘍により胸管の外からの圧排あるいは腫瘍の直接浸潤で乳び胸をきたすことがある.小児において悪性腫瘍に起因した乳び胸のうち,60–70%の原因を占めるのが悪性リンパ腫である.その他にも奇形腫や神経芽腫など縦隔腫瘍で乳び胸が生じうる.頻度は少ないものの,乳び胸が腫瘍の初発症状となることがあるので外傷の既往がない小児の乳び胸では悪性リンパ腫など腫瘍の可能性も考慮する.成人においては乳び胸の最多の原因は悪性腫瘍である.
※Pulmonary lymphatic perfusion syndrome(PLPS)とcentral lymphatic flow disorder(CLFD)/congenital lymphatic dysplasia(CLD)に関して
いずれも画像技術の向上に伴ってわかってきた概念である.PLPSは胸管から肺実質や縦隔に向かうリンパ路が先天的にあることが原因で,新生児期から成人に至る様々な時期に乳び胸として,あるいは時としてplastic bronchitisとして発症する.下流の胸管の閉塞や狭窄により側副路として胎児期にこのリンパ路が発達したのではないかと推測されているが,このリンパ路が,健常人を含めてどれぐらいの割合に存在するかなど未知の事項は多い.新生児特発性乳び胸,術後合併症として発症する乳び胸症例に,実は多くの割合で背景にこのPLPSが存在することが明らかになってきた(Case 3(Fig. 3)).Salvaら11)は,心臓手術後乳び胸の56%はこのPLPSを背景に術後乳び胸を発症していた,とMR lymphangiographyを根拠に報告している.このPLPSと鑑別すべき病態としてCLFD/CLDがあり,これらは中枢リンパ管の異常(異形成,低形成を含む)により乳び胸水・腹水,乳び心嚢液などをきたし,さらに腹壁の側副路を介してリンパ液が鼠経や下肢の皮膚に逆流するような病態を称した言葉である(Case 4(Fig. 4)).CLDの場合病変は肺だけでなく腹部臓器を含め,複数の臓器に生じることが多くあり,予後も悪い13).CLDはしばしば胎児水腫として発症する.これらは治療戦略も予後も異なるので,画像による鑑別は重要である.

在胎34週,2654 gで出生.胎児期より胸腹水を指摘されていた.出生後,胸腔穿刺により先天性乳び胸水の診断に至る.
a:99mTc-HAS-Dを用いたリンパ管シンチグラフィで両側胸腔内に核種の集積が認められる.特定の漏出点は指摘できない.
b:リンパ管造影(非掲載)および造影後CTでは縦隔や両側肺門から気管支血管束に沿って広がる造影剤の逆流が認められた.
胸腔ドレーン留置後,オクトレオチドやステロイドで保存的加療を試みるも乳び胸は改善しなかった.胸腔鏡下胸管結紮術を施行し,乳び胸水は改善し,その後の経過は良好である.
13歳女児 Cardio-facio-cutaneous syndrome.定期的に行われていた心エコー検査で心嚢液貯留が認められた.画像検査から中枢リンパ管の異形成/形成異常あるいは中枢リンパ管流の異常に伴うリンパ逆流が示唆された.
a,b:胸部造影CTでは,中等量の心嚢液貯留が認められる.肺野はびまん性に小葉間隔壁肥厚,気管支血管束の肥厚がある.
c:リピオドールリンパ管造影で肺門部から気管支血管束に沿った異常なリンパ流が描出された.胸管遠位部は描出が不明瞭である.
d:リンパ管造影後CTでは肺門~気管支血管束周囲,胸腔や胸膜に沿っても網状のリピオドールの漏出が確認できる.腹部では腎門や膵周囲,大動脈周囲,腹壁皮下などにリピオドールの漏出が認められた.中枢リンパ管の異形成/形成異常あるいは中枢リンパ管流の異常に伴う逆流が示唆される.
胸水を採取し胸水中のトリグリセリドが110 mg/dl以上,胸水と血中のコレステロール濃度比が1以上であれば乳び胸の診断を確定できる14).胸水中にカイロミクロンを証明することも乳び胸の診断に役立つ.肉眼的に見て明らかに白濁している場合に乳び胸水と容易に診断できる場合もあるが,経腸栄養を開始されていない場合や術後の低脂肪食の患者の場合には乳び胸でも乳白色とならないことがある.また肉眼的に乳白色の胸水からは膿胸の他,結核や寄生虫感染などによって生じるpseudochylothoraxも鑑別に挙がる.
乳び胸であると診断がついたらリンパ管の形成異常を含めた解剖学的な評価,あるいは漏出部位の同定など原因特定のための画像検査を行う.原因の特定はしばしば困難を伴うが,原因・病態により治療も予後も大きく異なることがわかっており,画像診断による原因検索は非常に大事である.
リンパ管シンチグラフィ,インドシアニングリーンICG蛍光リンパ管造影法に関しては他章参照とし,リピオドールリンパ管造影検査・リンパ管造影後CT,MR lymphangiographyを中心に記載する.
1. リンパ管造影検査リンパ管/リンパ節に直接リピオドール造影剤を注入する直接法と,皮下組織から間接的にリンパ管に取り込ませる間接法があるが,造影剤が皮下に貯留することによる炎症惹起のリスクや検査に時間を要することなどから,現在は直接造影法が用いられている.成人では足背リンパ管を穿刺する方法が以前から用いられてきたが.小児では鼠経リンパ節を穿刺することが多い.エコーガイド下に経皮的穿刺,あるいは皮膚切開をしてリンパ節を露出させ目視下で穿刺し造影剤を注入する.
このリンパ管造影検査で用いる脂溶性造影剤リピオドール(ethiodized oil)は粘稠度が高いためリンパ管の漏出/瘻孔部位で造影剤自体が直接的な瘻孔塞栓作用をもたらしうる.同時に造影剤により局所に生じた炎症後変化としての瘻孔閉塞作用も持つとされる.これらの作用機序でリピオドールリンパ管造影検査は治療としての役割ももちうる.逆に,特定の漏出/瘻孔部位がなく,リンパ管の異形成/低形成のある症例においてはこのリピオドールリンパ管造影検査によりさらにリンパ管に障害をきたす可能性があるのでこの検査は推奨されず,シンチグラフィや後述するMR lymphangiographyで評価,診断されるべきである.また心疾患や肺動静脈瘻など右左シャントを有する症例では脳梗塞をきたすリスクがあるためこの検査を行うべきではなく,事前にこれらの除外が必要である.
リンパ管造影検査はDynamicな情報を得ることができ,漏出点を直接描出できる.しかし,手技が煩雑であること,被ばくがあること,空間分解能はある程度は得られるものの周囲組織との関係性や詳細な解剖学的評価は困難であることなどの欠点がある.また造影剤とリンパ液が混ざりにくいため胸管全体が描出されるのは成人においても80%程度とされており15),さらに小児においては全身麻酔下陽圧換気で行うため胸腔内におけるリンパ管の描出が悪くなることがしばしばある.
2. CTリンパ管造影後のCTは,リンパ管漏出部の同定に有用である.リピオドールリンパ管造影では空間分解能の限界から,漏出点の特定が困難なことがしばしばあるが,リンパ管造影後CTで漏出点の推測が可能となることがある(Case 2, Case 5(Fig. 2, 5)).

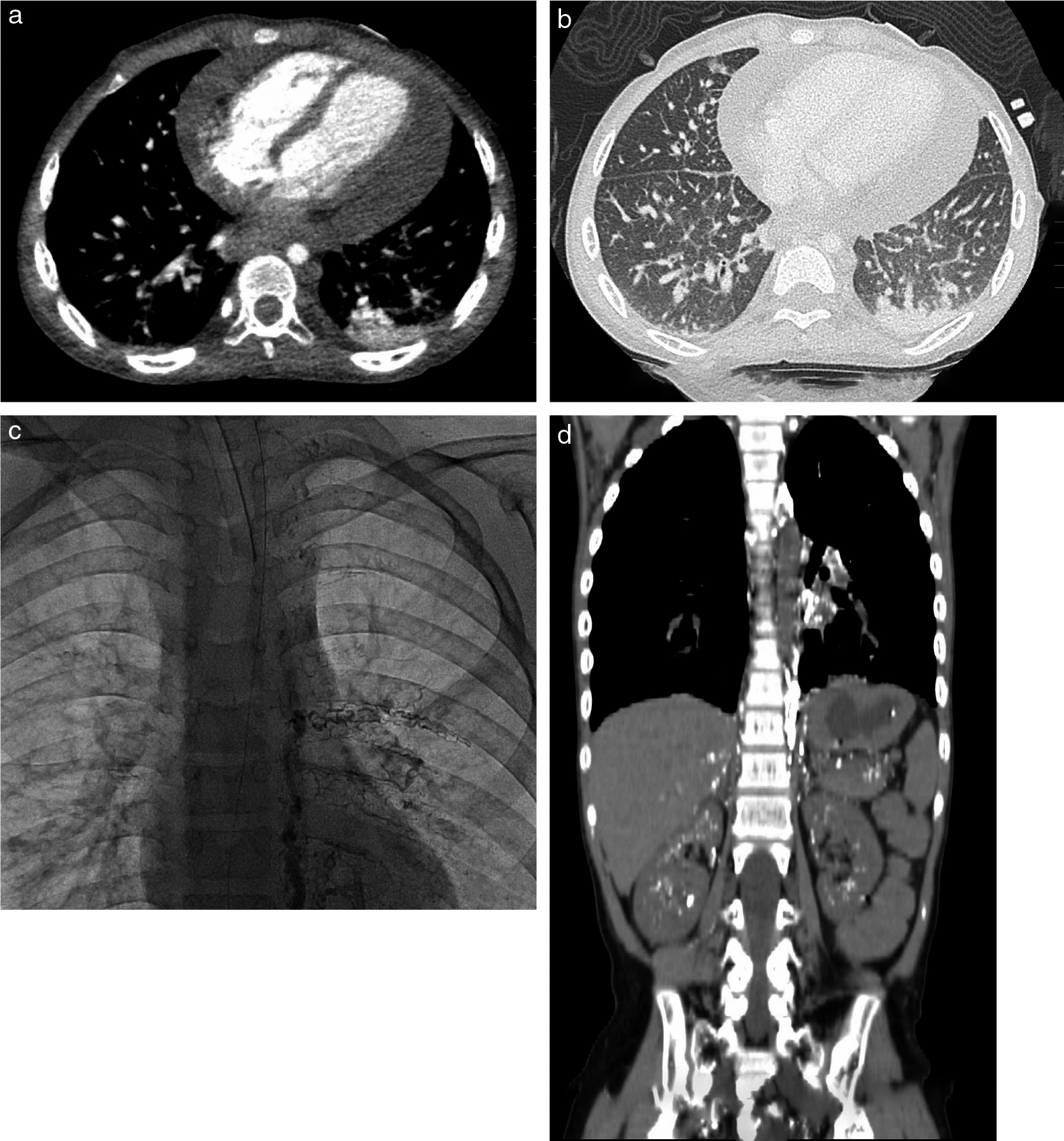
1歳女児,既往歴なし.食欲低下を主訴に近医を受診し胸水貯留を指摘された.胸腔穿刺で右乳び胸の診断に至る.
a:右胸腔内に大量の液体貯留が認められる.
b:99mTc-HAS-Dを用いたリンパ管シンチグラフィで左胸腔内に核種の漏出が認められる.検査後胸水穿刺を行い胸水内に核種の存在を確認した.
c:リピオドールリンパ管造影でTh10/11レベルの胸管から右側に造影剤の漏出が確認された.
d:造影検査後CTでは胸腔の背側に貯留するリピオドール造影剤が確認される.この後,胸管結紮術が施行され,乳び胸水は改善した.
また,乳び胸の背景にリンパ管拡張症が存在する場合には,HRCTは拡張したリンパ管を描出する最も有用な検査となる.小葉間隔壁,気管支周囲間質を含めて間質のびまん性の肥厚が認められる.すりガラス影も混在して認められる.非特異的であるが乳び胸による胸腔内液体貯留も描出される.
腫瘍に伴って生じた乳び胸の場合には,縦隔腫瘍の評価にも用いられる.
3. MR lymphangiographyリンパ管の走行を,低侵襲,かつ3次元的に描出することが可能で,上述の他の検査と比較しても最も高い解像度でのリンパ管の描出が可能な検査である16).
造影剤を用いないMR lymphangiographyは20年以上前からリンパ管を描出するための効果的,かつ侵襲的な方法として成人において有用性が報告されてきた17).MRCP 類似のheavily T2WIでリンパ管や胸管の拡張,乳びによる胸腔内液体貯留などの明瞭な描出が可能である.成人で94%の症例に胸管の描出が可能であったとの報告はあり18),短時間で造影剤を用いずに簡便に施行できる方法ではある.しかし,周囲の静脈や水信号に邪魔されリンパ管の描出が明瞭ではないこともあり,乳び胸水が多い場合には胸管の描出は困難で,小児の乳び胸に対しては広くは用いられてこなかった.
Doriらが提唱したDynamic造影MR lymphangiography(Dynamic contrast MR lymphangiography:以下DCMRL)はGd造影剤を鼠経リンパ節に注入しtime resolve MRAと同様のシーケンスでDynamic撮像する方法である11,13,19).かつては静的評価のみの,T2WIやGd皮下注入後一定時間が経過した後で撮像するMR lymphangiographyが主流で,リークや逆流の評価ができない,胸腔内の乳びやその他周囲水信号に邪魔されて最も描出したい中枢リンパ管の描出が優れない,という欠点があったが,DCMRLによりそれらが克服されてきている.さらには細かいリンパ管まで描出できるという点でだけでなく,透視下リンパ管造影検査で用いられるリピオドールと比較して,造影剤の粘張度が低いためにleak pointを描出するのにも有利でもある.さらにはDCMRLを用いて,中枢リンパ管の流速を定量する方法論も報告があり,乳び胸の背景に存在する病態のさらなる解明につながる期待が持たれる20).
前述のPulmonary lymphatic perfusion syndrome(PLPS),すなわち胸管から肺実質や縦隔への異常リンパ路が原因で乳び胸をきたしている症例においてはDCMRLで胸管から逆行性に肺実質が造影される所見が認められる.同時に上位の胸管に閉塞や狭窄があるか,側副路の発達がどの程度あるかも評価可能である.一方congenital lymphatic dysplasia(CLD)/central lymphatic flow disorder(CLFD)では順行性のcentral lymphatic flowは描出されないか,あるいは著明に減少し,腹壁や鼠経,下肢への逆行性のリンパ流が描出される11).乳び胸の背景にCLDが存在する場合には,リンパ管の異常は肺だけでなく複数の臓器に生じうるため予後も悪い.また前述したように低形成・異形成のリンパ管へのさらなるダメージが危惧されるためリンパ管造影は推奨されない.つまり,治療戦略が異なるためMR lymphangiographyでこれらを鑑別することは非常に大切である13).
これまでの乳児の乳び胸の評価における課題であったcentral lymphatic systemを描出する手段が乏しく乳び胸原因特定がしばしば困難であり,治療選択の決定や治療の有効性を早期に予測する手掛かりとなる評価法に乏しかったという問題が,MR lymphangiography ,特にDCMRLにより,今後克服される可能性がある.
DCMRLの欠点はcentral lymphatic ductの描出に優れるものの,central lymphatic ductに繋がらない部分,あるいは流速の遅い部分のリンパ管の描出が悪いことや,軽微な漏出の検出が困難なことがあることなどがあげられる13).その他,検査室内で鼠経リンパ節から造影剤を投与する必要があること,長時間の麻酔が必要となること,検査室の占拠時間などの問題があり,施設によっては現実的にハードルが高い検査であることは推測される.
治療に関するランダム化比較試験はされておらず症例報告や経験的なものをもとに治療が行われている.
まずは保存的な加療が行われ,胸腔の容積を保つべく乳び胸水の量を減らしリンパ管損傷の部位が自然治癒することや側副路が発達するまでの時間を稼ぐ.食事療法として母乳や通常のミルクをMCTミルクに変える.MCTミルクは腸からリンパ管に吸収される長鎖脂肪酸が含まれておらず,門脈から吸収されリンパ管や胸管を介さず直接肝臓に流入する中鎖脂肪酸のみを含むのでリンパ流量を減らすことができる.薬物療法としてオクトレオチド(ソマトスタチン合成アナログ)やステロイド,フィブロガミンなどを組み合わせて経静脈投与する.オクトレオチドは1990年ごろにUlibarriらが成人の喉頭がん術後の胸管損傷による乳び胸に対してソマトスタチンが有効であったと報告して以来使用されるようになった21).リンパ管のソマトスタチン受容体に作用してリンパ管を収縮させることでリンパ液を減少させる,腸管への血流量を減少させてリンパ液産生を減らすなどの機序で作用すると考えられている.ソマトスタチンは半減期が短く,ソマトスタチンと同等の活性を有する合成アナログとして,半減期が1.8時間,皮下注でも使用が可能なオクトレオチドが生成された.有効例が多数報告されてきており,特に先天性乳び胸には半数以上に有効な成果が報告されている22).しかし現在乳び胸に対してのオクトレオチドは保険適応外であり,また投与量や投与方法,投与開始時期に関してまだ定まった一定の見解はない.
保存的加療で改善しない場合,侵襲的な治療が考慮され,胸管結紮術や,あるいはリンパ管が視認できない場合には葉間と周囲組織を一塊にして結紮する方法,胸膜癒着術,胸腔腹腔シャント術などが以前より行われてきた.しかし,画像診断法の向上により,特定の漏出点の描出,背景にあるリンパ管形成異常を含めたリンパ管の解剖学的な把握が可能になり,治療戦略は今大きく変わり始めている.実際に近年は手技的な観点でもリンパ管塞栓術やリンパ管静脈吻合術などのinterventionやmicrosurgeryにより治療が発展しより低侵襲の治療が小児でも可能となってきている.特定の部位からの漏出やPLPSを背景に発症した乳び胸の場合は比較的予後は良く,経皮的リンパ管塞栓術で治癒し得る23,24).一方でcongenital lymphatic dysplasia(CLD)が背景にある場合には,塞栓術を含めた外科的手技は行わない.
近年PI3K/AKT/mTORシグナル経路がリンパ管や血管の発生に大きく関与していることが明らかになりmTORの阻害剤ラパリムス(一般名:シロリムス)による難治性症例に対する有用性が確認されている25,26).ラパリムス(一般名:シロリムス)はリンパ管の新生をおさえ,リンパ管内皮細胞の機能抑制を介してリンパ管の産生,ひいてはリンパ液漏出の軽減をきたす.投与量や治療適応の決定を含めて今後さらなる症例の蓄積が期待される.