2023 年 39 巻 2 号 p. 62-66
2023 年 39 巻 2 号 p. 62-66
小児呼吸器外科領域における画像技術や画像診断のトピックスについて述べる.完全胸腔鏡下手術やロボット支援手術において3D内視鏡システムによる立体視が可能になってきている.肺手術では3D再構成CT画像による術前シミュレーションが広く行われており,区域切除における術中区域間同定にインドシアニングリーンが用いられることがある.先天性気管狭窄症における正確な気管内径の測定方法が明らかにされ,3Dモデルや流体力学的モデルによるシミュレーションが試みられている.乳び胸に対してはリンパ管造影やMR lymphangiographyが施行されるようになってきた.
Advanced imaging technology and new insights in diagnostic imaging are widely applied in pediatric thoracic surgery. Examples include three-dimensional imaging in thoracoscopic and robotic surgery, preoperative assessment of the pulmonary vessels by three-dimensional computed tomography, identification of lung intersegmental borders using infrared thoracoscopy with indocyanine green, optimal window setting on computed tomography to measure the inner diameter of the trachea, simulated slide tracheoplasty for congenital tracheal stenosis using three-dimensional printed models, computational fluid dynamics assessment of congenital tracheal stenosis, and lymphatic imaging techniques in the management of chylothorax.
近年の画像技術の進歩は著しく,外科手術もその恩恵を多く受けている.本稿では小児呼吸器外科領域で最近使用されている画像技術や画像診断についての知見について述べる.
呼吸器外科領域においても低侵襲化は進んでおり,小児患者に完全胸腔鏡下手術を行う施設も徐々に増えてきている.完全胸腔鏡下手術における課題の一つが,立体感がなく,奥行きを感じることが難しいことであったが,近年は立体視できる3D内視鏡システムが数社から市販されており徐々に普及している.奥行きの感覚が得られるので,特に剥離・縫合操作において有用性が高い.3D内視鏡システムを用いた手術は,手術時間,出血量ともに2Dシステムよりも良好とする報告がある1).また,鉗子等の器具は2D内視鏡システムのものをそのまま使用でき,システムそのものも後述するロボット支援手術に比べると安価なため,導入・維持のコストが抑えられる利点がある.しかし,立体視では外科医・看護師に気分不良,ドライアイ,眼精疲労,頭痛などが認められることがある2).また体格の小さな小児では径5 mm以下の細いポートが使用されることが多いが,まだこのポートに挿入可能な細径スコープは少ない3).
成人の呼吸器外科領域では肺がんと縦隔腫瘍に対するロボット支援手術が保険収載されたこともあり,ロボット支援手術が増加している.立体視が可能なシステムであり,ロボットアームには自在に曲がる多関節システムを備えているため,これまでの胸腔鏡手術では出来なかった複雑な操作が可能である.ただ,小児では胸腔が小さくロボットアームを入れにくいことから,年長児の縦隔腫瘍の報告例が主となっている.
3D再構成CT画像を作成するSYNAPSE VINCENTやZiostation等のソフトが市販され,既に広く普及している.特別目新しいものではないが,3D再構成画像は前後関係や大きさを直感的に把握しやすいので手術計画を立てる際に役立つ4).肺動静脈・気管支が複雑に絡み合った肺の手術に際して特に有用である.ただ,成人では一般的に描出可能とされる1 mm径の肺血管も,小児特に乳児においては描出困難なこともしばしば経験する.また,自動的な画像再構成では肺動脈・肺静脈の分離が不正確なことも珍しくないので,手作業での細やかな修正を要する.
術野に画像を投影できる装置も存在するが,あくまでもCTを撮影したときの画像が表示されるにとどまっている.組織の一部を動かしたり切離したりしても,リアルタイムにその画像が追随するわけではないため,現段階では術前のシミュレーションには有用だが術中のナビゲーションとしては不十分である.手術進行に沿って術野に一致した画像がリアルタイム表示されるようになれば,手術の安全性は著しく向上するであろう.今後の技術革新が待たれる.
小児の肺切除は,気胸を除くと先天性肺気道奇形や気管支閉鎖,肺分画症等の先天性嚢胞性肺疾患の頻度が高く,比較的容易に施行可能な肺葉切除が行われることが多い.しかし,術後呼吸機能のことを考えれば切除する肺の容量は小さい方がよい.このため区域切除が選択されることがあるものの,正確な区域間の同定は容易ではない.通常区域切除では,切除する区域の気管支を結紮後に換気し,換気される部分(残す肺)と換気されない部分(切除する肺)との境界(換気虚脱ライン)を見出す.しかし,側副換気が多い症例などでは換気虚脱ラインが明瞭でなかったり不正確であったりする.また,胸腔鏡下手術では狭い胸腔内で肺を膨らませても換気虚脱ラインを同定しにくい.このような問題を克服すべく,近年成人領域ではICGを用いた区域間の同定が行われるようになってきており,小児領域にも広がってきている5,6).
具体的には,切除する区域の肺動脈を切離後に四肢の末梢静脈からICGを注入すると,血流のある残すべき肺は蛍光発色するのに対し,血流のない切除すべき区域は蛍光発色せず,その境界が区域間面となる.発光時間が20秒程度しかなく,この間に区域切除の切離ラインを電気メスなどでマーキングしきれないことがあるが,追加投与も可能である.
先天性気管狭窄症の手術適応を決め,手術計画を練るうえで,気管内径を正確に測定しなければならない.しかし,この単純な作業が意外と難しく,事前にCTで測定した内径と実際の気管径とに差を認めることがある.そもそも気管内腔を測定するCTの条件が報告例によって異なっており,当然のことながら表示条件次第で計測値は変わってしまう.
我々は適切な気管径の測定条件を求めるべく,1998年から2018年までに当院で手術を施行した先天性気管狭窄症症例の診療録とCT画像を後方視的に検討した.同期間に手術を施行した68例中,離断した気管内径を術中に実測していたのは9例で,このうち8例において気管に含気を認める状態で術前のCTが撮影されていた.この8例の手術時月齢は9.8 ± 7.7(平均±標準偏差)か月,同体重は5.7 ± 2.5 kgであった.CTのスライス厚は1 mmで,ウインドウレベルとウインドウ幅はそれぞれ縦隔条件で100/280,肺野条件で−600/1600であった.離断部の気管内径は,縦隔条件で計測すると4.2 ± 0.9 mm,肺野条件で計測すると2.7 ± 0.5 mm,術中実測値は2.3 ± 0.5 mmであり,これらの間には有意差を認めた(p < .001).気管内径の実測値に近いのは肺野条件での計測値であった(Fig.1).気腔の大きさを論じるときに肺野条件で計測することは当然ではあるが,径が2 mm前後の小さな気腔の計測においても実測値に近い値が得られることが証明された.故に我々はCTでの気管内径の計測は肺野条件で行っている.具体的には高精細モニターを用い,1 mmスライスの肺野条件で,気管内腔の空気濃度と周囲組織との間に形成されたグラデーションの部分の真ん中同士を計測している.
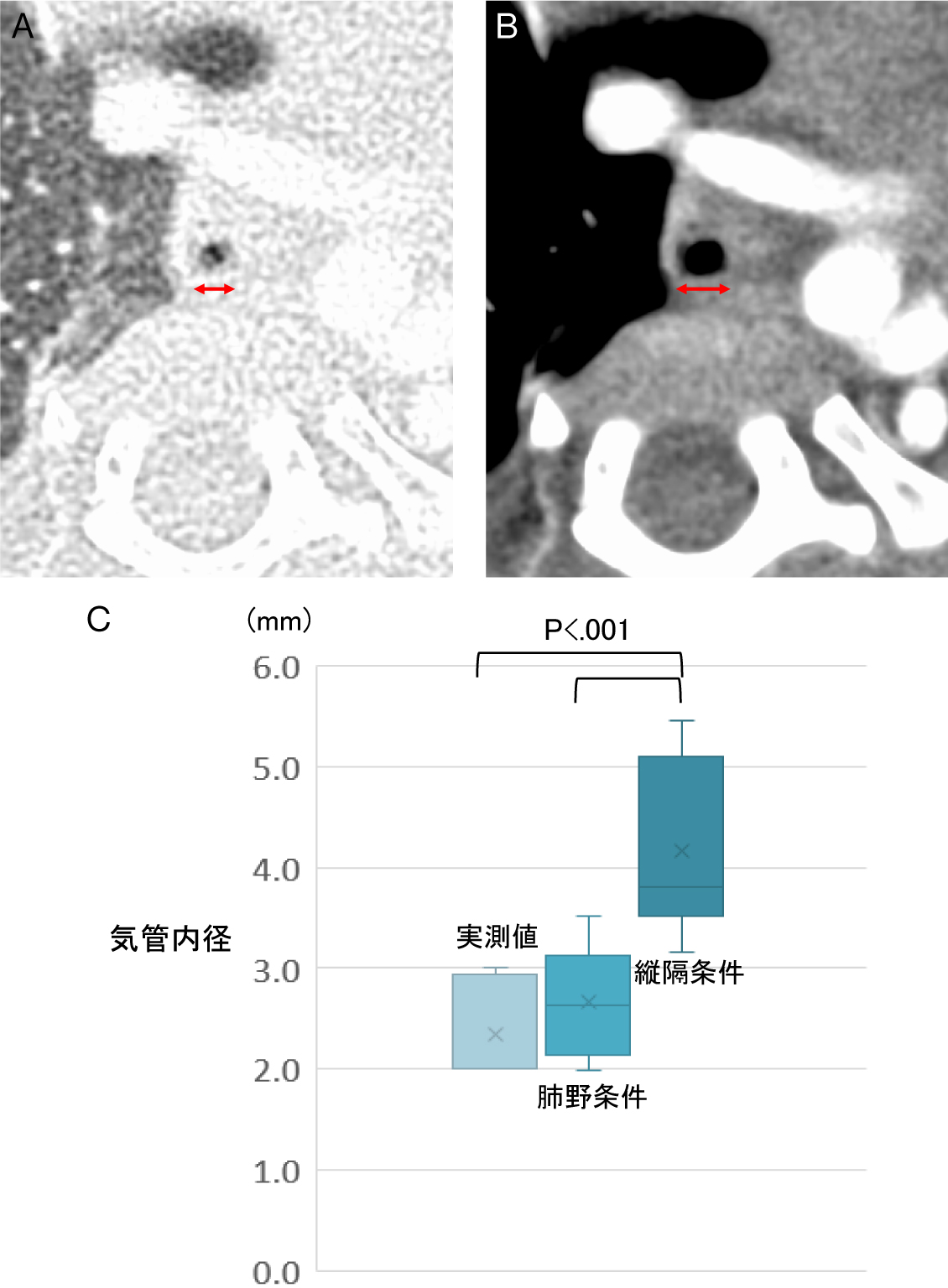
A:肺野条件,B:縦隔条件
肺野条件の方が気管が細く見える.
C:気管内径の実測値に近いのは肺野条件での計測値であった.
先天性気管狭窄症で頻用されるスライド気管形成術は,軟骨が多く含まれる気管を一見いびつな形に吻合しなくてはならず出来上がった形状が想定通りにならないことも時々経験する.Shimojimaらは,術前CT画像を元に樹脂製の気管3Dモデルを作成し,気管のどこを切りどう吻合するのがよいのかいくつかの形成デザインをあらかじめ試すことで,事前に理想のデザインを決めておくことができると報告している.この3Dモデルは,医療スタッフ間の情報交換や手術の流れの事前確認・手術手技への習熟,更には患者・家族への説明の際にも有用である7)(Fig.2).
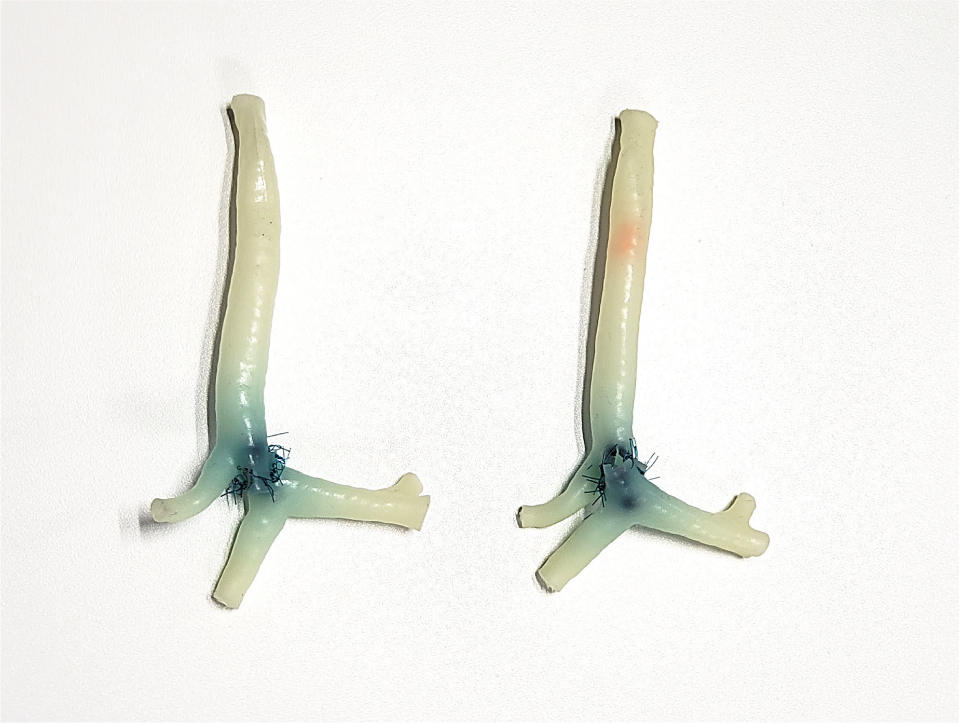
いくつかの形成デザインを術前に試すことで,理想的なデザインを決定できる.
左:通常のスライド気管形成術
右:前後のスリットを逆にしたスライド気管形成術
先天性気管狭窄症の客観的な評価法としては,一般的に気管径や狭窄長等が用いられる.しかし,同じ気管径や狭窄長でも狭窄の部位や形態によって実際の重症度が違うことを経験する.最近では,気流の流れをコンピューター上で解析し(CFD解析),重症度を評価する試みがなされている.MoritaらはCT画像から気管の実形状モデルを構築し,気管最小断面積の測定とCFD解析を行い,入口と出口における流速と圧力で定義されるenergy flux(気管内に気流を駆動するために必要なエネルギー)を評価した.Energy fluxと臨床重症度の間には術前後ともに正の相関関係を認め,先天性気管狭窄症の有用な評価指標となりうることを見出している8).今後は術前・術後のCTからの評価のみならず,前述した3Dモデルと組み合わせることで最適な形成デザインをシミュレーションすることが期待される.
乳幼児の乳び胸には先天的なリンパ管形成不全や心臓・肺の術後に生じるものがあり,治療に難渋し,ときに死に至る.一般的な絶飲食,中心静脈栄養といった治療を行っても改善を認めないような場合,病態の把握目的にリンパ管造影や胸管のMRI撮影が行われることがある9,10).
リンパ管造影は,成人では足背リンパ管を穿刺する方法が以前から用いられてきたが,小児では鼡径リンパ節を穿刺することが多い.乳幼児の鼡径リンパ節は厚さが1~2 mmしかなく,エコーガイド下に穿刺し針の位置を維持するのが難しいため,我々は皮膚を切開しリンパ節を直視下に穿刺して脂溶性造影剤リピオドールを注入している.通常鼡径部から総腸骨動脈周囲,大動脈周囲,乳び槽,胸管の順にリンパ管が描出され,破綻部位からの漏出が明らかとなる.造影後にCTを追加すると更に情報が増える(Fig.3).この詳細な解剖学的情報はその後の胸管結紮術や胸膜癒着療法等の治療方針を検討するうえで非常に有用である.また,リピオドールは粘稠度が高いのでリンパ管内のリンパ流を減少させ,また局所的な炎症も惹起するとされており,結果的に瘻孔を閉鎖し治療効果を発揮することもある.シンチグラフィ等で事前にリンパ管の閉塞が明らかな場合にはリンパ管造影で症状が増悪する可能性があり,心疾患や肺動静脈瘻など右左シャントを有する場合には脳梗塞をきたすリスクがあるので,原則として適応外としている.
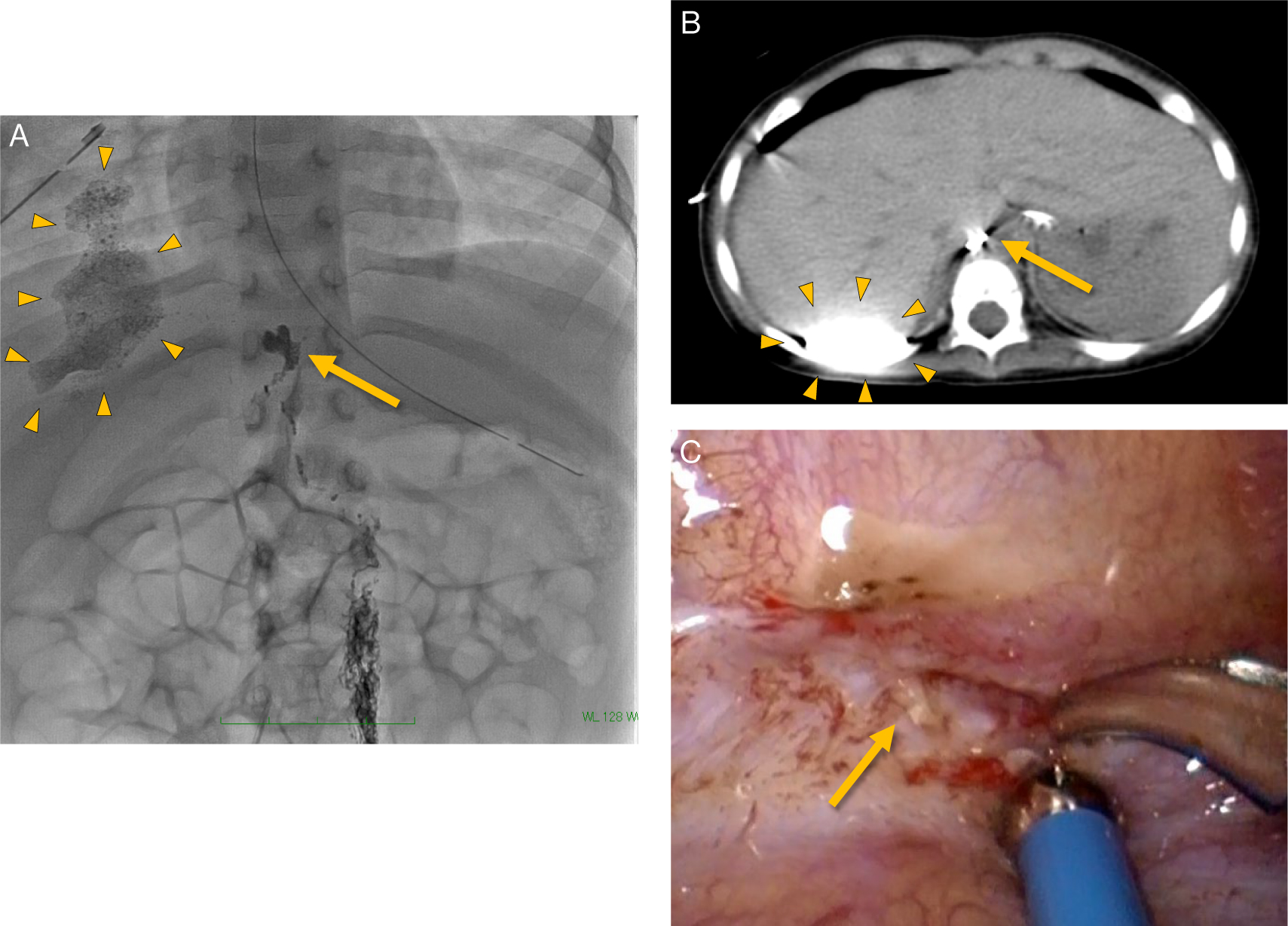
A:リンパ管造影,B:リンパ管造影後のCT
造影剤が胸管から漏出し(矢印),胸腔内に貯留している(矢頭).
C:胸管結紮術時の所見
リンパ管造影やその後のCTで描出されていた部位で,胸管が破綻していた(矢印).
MR lymphangiographyはリンパ管の走行を低侵襲かつ3次元的に描出することができる.造影剤を用いないMR lymphangiographyは成人での有用性が報告されてきたが,小児では広くは用いられてこなかった.近年はGd造影剤を鼡径リンパ節に注入するDynamic造影MR lymphangiographyも行われるようになってきている.