2025 年 41 巻 2 号 p. 102-110
2025 年 41 巻 2 号 p. 102-110
日本の小児肝移植医療は,生体肝移植が主体に発展してきた.1997年に臓器移植に関する法律が制定され,脳死後の臓器提供が可能となり,2010年7月の臓器移植法の改正で,15歳未満の脳死後の臓器提供ができるようになっている.臓器移植に関連した画像診断検査は,脳死判定の判断やレシピエントの術前,術後評価,肝移植ドナーの術前評価に不可欠である.小児肝移植の適応疾患は多岐にわたるが,胆汁うっ滞性肝疾患である胆道閉鎖症が最も多い.そのほか,腫瘍性疾患として肝芽腫,血管腫,劇症肝炎,代謝性肝疾患,先天性門脈大循環短絡などが挙がる.これら肝移植の適応となる肝疾患,肝移植手術に必要な血管や胆管解剖などを含めた画像を踏まえて,適切な画像検査を実施,評価することが大切である.
本稿では,肝移植の適応となる代表的な肝疾患および術前評価,肝移植ドナーの術前評価として必要な知識について解説する.
Pediatric liver transplantation is an important treatment for children with end-stage liver disease. In Japan, pediatric liver transplantation has primarily advanced through use of living donor grafts. The enactment of the Organ Transplant Law in 1997 permitted organ donation after brain death, and a subsequent revision in July 2010 extended this to include donors under the age of 15. Diagnostic imaging is vital for all stages of transplantation, including brain death determination, recipient evaluation before and after surgery, and living donor assessment. The indications for pediatric liver transplantation are diverse, but biliary atresia is the most common. It is crucial to perform appropriate imaging studies based on a thorough understanding of the liver diseases indicated for transplantation, as well as the vascular and biliary anatomy necessary for the surgical procedure. This paper reviews the primary liver diseases indicated for transplantation and the knowledge required for preoperative evaluation of both recipients and living donors.
肝移植には,生体肝移植と脳死肝移植がある1).我が国では,2010年に臓器移植法が改正され,元来行われていた生体肝移植に加えて,15歳未満の脳死後の臓器提供が可能となっている.近年の外科的技術の向上,免疫抑制剤の進歩により5年生存率は85%と良好な治療成績が得られるようになっている2,3).肝移植は,重症肝疾患に対する治療法のひとつとして確立され,実施件数も増加している4).画像診断検査は,肝移植適応の評価,レシピエントやドナーの術前のプランニングのための解剖学的評価,術後合併症の診断に用いられる2).超音波検査(US),CT,MRIが中心である.高速撮影が可能となっているCTについては,呼吸停止が困難な小児においても再構成画像,3D画像の作成が可能で術前評価としての有用性は高い1,5).本稿では,主に,肝移植の適応疾患,レシピエント,ドナーの術前精査の画像診断検査,読影のポイントについて解説する.
小児肝移植の適応疾患をTable 1に示す3,6,7).日本では,胆汁うっ滞性肝疾患が全体の72%を占め,その中でも胆道閉鎖症が最も多い.次いで,先天性代謝疾患(Wilson病,オルニチントランスカルバミラーゼ欠損症などの尿素サイクル異常症,メチルマロン酸血症など),劇症肝炎,肝悪性腫瘍(主に肝芽腫)などが続く3,6,7).
| 1.進行性慢性肝疾患 |
| 1)胆汁うっ滞性病変 |
| 胆道閉鎖症,原発性硬化性胆管炎,アラジール症候群など |
| 2)肝細胞性病変 |
| 自己免疫性肝炎,新生児肝炎など |
| 3)血管性病変 |
| Budd-Chiari症候群,Veno-occlusive disease,慢性肝移植片対宿主病(GVHD)門脈閉塞症 |
| 4)繊毛病 |
| 肝嚢胞,カロリ病,肝線維症など |
| 2.肝腫瘤性病変 |
| 肝細胞癌,血管腫,転移性腫瘍,肝芽腫など |
| 3.劇症肝炎 |
| ウイルス性肝炎,薬剤性肝炎,熱中症など |
| 4.代謝性疾患 |
| Wilson病,糖原病,尿素サイクル異常症(OTC欠損症など),有機酸代謝異常症(メチルマロン酸血症など),シトルリン血症,カルバミルリン酸合成酵素欠損症,進行性家族性肝内胆汁うっ滞症,プロテインC欠損症,新生児ヘモクロマトーシスなど |
生体肝移植の禁忌は,肝臓以外の臓器不全(心不全,呼吸不全),制御不能の肝胆道系以外の活動性感染症,制御不能の肝胆道系以外の悪性腫瘍,肝移植治療の安全性の大きな妨げとなる他臓器疾患とされる.
以下に,小児肝移植の適応となる代表的な疾患について紹介する.
1. 胆道閉鎖症胆道閉鎖症は,新生児から乳児期早期に発症する炎症に伴って胆管組織の線維化がおこり閉塞をきたし難治性の胆汁うっ滞を呈する疾患である.小児肝移植のうちで最も頻度が高い病態である.胆道閉鎖症の治療の第1選択は,葛西手術(肝門部空腸吻合術)であるが,その後の遷延する黄疸,反復性の胆管炎,門脈圧亢進症状(難治性腹水,食道静脈瘤,肝肺症候群,脾機能亢進症状),肺高血圧症状などが見られた場合に肝移植の適応となる3,6–8).繰り返す胆管炎の症例では,肝内にbile lakeと言われる嚢胞構造を認めることが多い(Fig. 1).胆道閉鎖症に伴う門脈圧亢進症の原因の多くは,門脈狭小化と血流減弱の関与が大きい.門脈本幹の狭細化は,移植の適応判断に関与するため,普段のUSなどで注目すべきである.また,門脈圧亢進症状に伴う胃食道静脈瘤や直腸周囲の静脈瘤,脾腎シャントの情報は,術前のプランニングに必要である6)(Fig. 2).

造影CT:脾腫を認める.肝右葉に嚢胞病変あり,bile lakeと考えられる(矢印).
a.腹部US,右肋間走査:門脈本幹径の狭小化を認める.
b.腹部造影CT:肝脾腫を認める.肝実質の造影効果は不均質で,門脈周囲は低吸収である(矢印).
c.腹部造影CT冠状断像:脾腫を認める.胃噴門部に沿って側副路を認める(矢印).
小葉間胆管減少症による慢性胆汁うっ滞性疾患である.非代償性肝硬変,進行性胆汁うっ滞,成長障害が見られた場合は,肝移植が考慮される.常染色体優性遺伝とされ,JAG1とNOTCH2の遺伝子異常が知られている.新生児期から始まる黄疸が主症状であり,しばしば胆道閉鎖症,新生児肝炎との鑑別を要する.肝以外には,特異的顔貌,末梢肺動脈狭窄,脳血管障害,蝶形椎体,眼球異常(後部胎生環),発達障害などが見られる8,9)(Fig. 3).生体肝移植が考慮された場合は,ドナー候補に対して,MRCPなどを実施し,肝内胆管の低形成の有無についての評価を行う必要がある.両親のうち肝内胆管低形成を認める率が12%ほどあるとされている6).

a.CT骨条件冠状断像:胸椎に蝶形椎を認める(矢印).
b.脳血管MR angiography:左総頸動脈分岐レベルで左内頸動脈の閉塞を認める(矢印).
原発性硬化性胆管炎は,まれな胆汁うっ滞性肝硬変を呈する疾患で,近年増加傾向にある.肝内,肝外の胆管が多発性,進行性に線維性硬化をおこし,胆管の狭窄を示す.胆管炎,黄疸などが主症状である.進行性の慢性疾患で,肝不全に至る.炎症性腸疾患の合併頻度が高い.US,CTなどで胆管の拡張を認める.MRCPでは,多発する胆管狭窄と拡張を示す枯れ枝状変化と言われる所見が特徴的とされる(Fig. 4).肝移植は,肝不全例,繰り返す胆管炎症例,門脈圧亢進症症状,制御不能な掻痒感を呈する症例に対して適応が考慮される10).

a.T2強調冠状断像:肝腫大を認める.門脈周囲が高信号で,不均等な肝内胆管の拡張を認める.
b.MRCP:肝内胆管は不整で,枯れ枝状である.
Wilson病は,常染色体劣性遺伝を示す先天性銅代謝異常症で,肝臓をはじめ,中枢神経,角膜,腎などの様々な臓器に銅が過剰蓄積することで臓器障害が生ずる進行性の疾患である.ATP7B遺伝子異常による肝臓から胆汁への銅の排泄障害が生じ,その結果,肝細胞内に銅が蓄積し,肝細胞障害に至る.血性セルロプラスミン値低下と尿中銅排泄量増加が特徴的な血液生化学所見である.劇症肝炎型Wilson病,進行性の肝不全,内科的治療に抵抗性の重症型非代償性肝硬変症例(Fig. 5)が肝移植の適応となる3).

a.T2強調横断像:肝の萎縮と脾腫を認める.肝実質は,結節状で再生結節を疑う.
b.淡蒼球は高信号となり,肝性脳症の所見である(矢印).
小児急性肝不全は進行が速く,早期に治療の介入が必要である.急性肝不全は,正常肝ないし肝予備機能が正常と考えられる肝に肝障害が生じ初発症状から8週以内に高度肝機能障害に基づいてプロトロンビン時間が40%以下ないしはINR値1.5以上を示すものと定義されている11).
肝移植の適応は,血液浄化療法開始後5日を目安に,内科的治療効果判定で,血漿交換での凝固能改善の有無,脳波の異常,肝血流,肝容積の推移などを総合的に評価し,肝障害が不可逆的であると判断された場合と考えられている11).劇症肝炎は,小児肝移植適応疾患の6%を占めるとされている.乳児から小児期の劇症肝炎症例(Fig. 6)では,脳症や,発症から臨床経過が急速に悪化する場合が多く,移植に踏み切るタイミングの判断が難しく,重症肺炎,肺水腫,不可逆的な脳症,敗血症などにより肝移植適応外となっている例もある.肝機能,血液凝固機能などの臨床検査データだけでなく,経時的な肝臓容積の変化,CT,脳波による脳症の評価も適応決定に重要である6,11).

a,b.造影CT:門脈周囲の低吸収域と胆嚢壁肥厚(矢印)を認める.急性肝不全の所見と考える.
c.入院3日後腹部US:門脈周囲の輝度が高く,入院時に比して進行性の肝萎縮を認めた.
レシピエントに対する術前の画像診断検査の主たる目的は,2つあり,門脈血栓や悪性腫瘍などの適応外の病態把握と手術のプランニングのための肝動脈,門脈,肝静脈に関する解剖学的評価である1).
術前のプランニングのための評価の中心はUSであり,続いて造影CT,MRIである.臓器や血管のサイズ,血管解剖など,術中,術後合併症として予測される所見の把握の評価として大切である.小児に対するUSの利点は,被ばくがないこと,成人に比して良好な画質が得られること,様々な角度からリアルタイムに評価できることである2,12).
小児肝移植では,グラフトの至適肝容積が決まっており,患児の体重あたり移植肝容積が1–3%であれば生着率が良好で,生存率も良好と報告されている.小児では,原則として肝左葉外側区が使用され,肝左葉全体または肝右葉全体のグラフトは成人に適応される.グラフトが小さすぎると,胆汁うっ滞,腹水,凝固異常,肝障害を引き起こすリスクが上がるとされsmall-for-size syndromeと言われる.至適肝容積よりも大きかった場合も,術後成績が悪く血管合併症も多いと報告されている13).
生体肝移植におけるドナーの適応条件は,自発的臓器提供の意志を有する成人,レシピエントの3親等以内または配偶者,レシピエントと血液型が一致ないし適合したほうが好ましい,全身麻酔に際し禁忌となるような合併症を有さない,感染症,悪性腫瘍がない,腹部CTの肝容量計測で肝左葉の容積がレシピエント体重の1–4%以内に相当,脂肪肝がない,あるいは肝生検で脂肪沈着した幹細胞が30%以下であるといった内容が含まれる.最も大切なことは,生体肝移植において,健常人であるドナーの安全性が最優先されることである6,14).
ドナーの術前画像診断検査の目的は,適応外の病態の評価と解剖学的評価にある14).腹部US,造影CTで評価し,必要に応じてMRCPなどを考慮する.
1. 肝実質脂肪肝や鉄沈着,腫瘤性病変の有無の評価をする.脂肪沈着が30%以上では移植後早期のレシピエントの肝障害の原因になることが知られており,30%未満が限界とされている.また,病的脂肪肝の場合,将来的にドナーが肝硬変に至ることも懸念されるため,禁忌事項となっている5).脂肪肝の評価は,単純CTで肝臓,脾臓のCT値を計測したLS比(liver/spleen index)が1.1以下,脾臓に比して10 HUより低い,肝実質が40 HU以下のいずれかであった場合に脂肪肝と判断する(Fig. 7).LS比が1.1以下の場合は,病理学的にmild steatosis以上の脂肪肝であると報告されている.MRIでは,T1強調画像であるin phase,out phaseを撮像し,30%以上の信号差を認めた場合に脂肪肝と判定する6,12,13).

a.単純CT,LS比計測例:肝と脾臓に対してROIを用いてCT値で評価する.
b.単純CT:単純CTで,肝実質は不均質で,脾臓に比して低吸収である.LS比は,0.6と低値であった.
c.単純CT 6か月後:ダイエットを実施し,肝実質の不均質さは改善し,LS比は1.12と改善を認めた.
肝動脈の解剖は,腹腔動脈より総肝動脈が分岐しその後,胃十二指腸動脈,固有肝動脈に分かれ,固有肝動脈より左肝動脈,右肝動脈が分岐するタイプが約55%と一般的で最も高頻度である.複数の亜型が存在するが,左肝動脈が左胃動脈から分岐するタイプが約10%,右肝動脈が上腸間膜動脈より分布する亜型が9–12%と比較的頻度が高い(Fig. 8).肝動脈径が2 mm未満であると,吻合が難しく,血栓形成の頻度が高くなるとされている.術前の評価として,肝動脈径,正常亜型についての情報提供は大切である12,13).

a.造影CT動脈相:右肝動脈の上腸間膜動脈起始(矢印).
b.造影CT動脈相:左胃動脈起始による左肝動脈(矢印).
門脈は,脾静脈,上腸間膜静脈,胃静脈合流後門脈本幹を形成し,肝門部にて,門脈右枝と左枝に分岐する.門脈左枝は水平部から尾状葉へ分枝を出しながら臍部を形成し,segment 2,3,4への分枝を形成するのが一般的である.門脈の分岐亜型は,20–35%に見られるとされる.その代表例は,門脈右枝の欠損,3管同時分岐である.3管同時分岐は,門脈右枝の前・後区域枝と左枝が門脈本幹からほぼ同時に分岐するタイプである13)(Fig. 9).門脈と胆道系は,解剖学的亜型に一定の関連性があるとされており,門脈亜型が疑われた場合は,胆道系についてMRCPなどを用いた評価が考慮される(Fig. 9).そのほか,切離面での門脈径,血栓や狭窄の有無についても評価する.肝左葉の摘出が予定されている場合は,門脈左枝の水平部の血管径と長さを測定する12,13).これらの血管解剖の把握は,術中の出血や虚血の予測,予防に必要な情報である13).

a.造影CT 3DCT:門脈(ピンク)肝動脈(赤),肝静脈(青)で示し,肝左葉移植グラフト(緑)の容積予測と切除面を示している.門脈は左枝,右枝の前後区域枝の同時分岐を示している.
b.MRCP:左肝管より右後区域枝は尾側より分岐している(矢印).
c.術中胆道造影:胆管の分岐形態は,MRCPと同様の所見である.
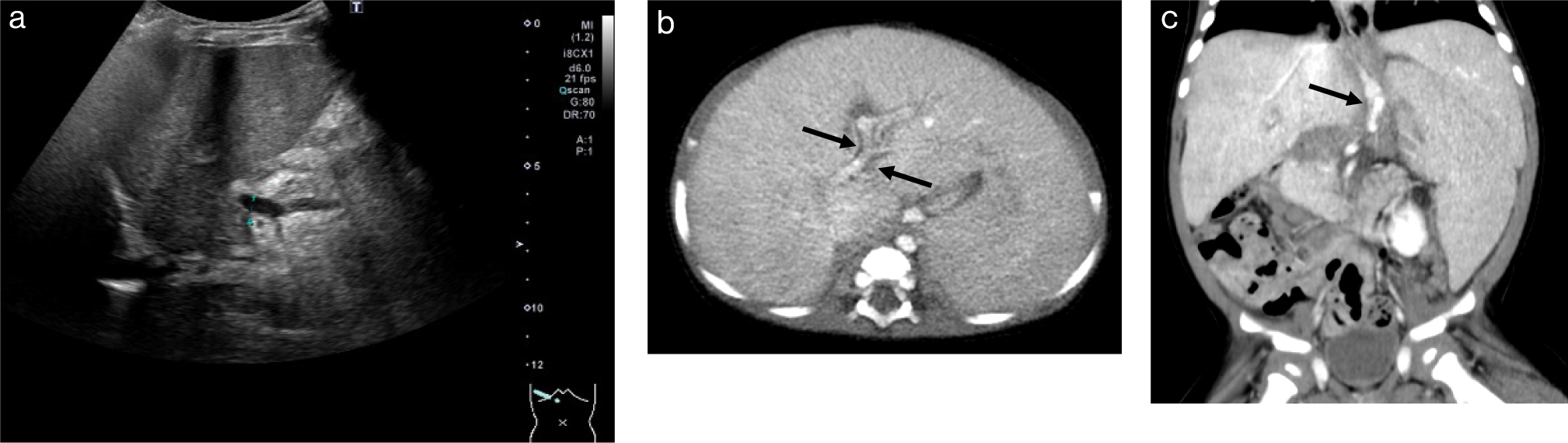
肝静脈は亜型が多く,16–33%に見られるとされている.術前に,把握できていないと,ドナー,レシピエント両方の肝静脈閉塞を引き起こし,肝障害につながる可能性があるため事前の把握は大切である12).60–70%の頻度で,中肝静脈と左肝静脈は,IVC合流部手前で共通管を形成している.左肝静脈には,Segment 2,3,右肝静脈には,主にSegment 5,6,7,中肝静脈にはSegment 4,5,8が灌流している.肝静脈の亜型,accessory veinの術前の把握は,肝うっ血の予測を立てる上で大切であり,手術のアプローチを左右する大切な情報である.特に肝左葉全体または肝右葉のグラフトが考慮される場合は,中肝静脈を含めた切除となるため,中肝静脈の解剖学的亜型の把握は手術成功のひとつの要素となる12,13)(Fig. 9a).
5. 胆道系肝移植ドナーの術後合併症として胆汁漏出,胆管狭窄があり,約2–18%の頻度とされる.術後合併症の予防のためにも術前の胆道系の解剖学的情報は必要である13).一般的には,肝右葉の前・後区域枝が合流し右肝管となり,左葉からの分枝からの左肝管と合流し総肝管となり,その下方で胆嚢管が合流し総胆管となる.胆道系の解剖学的亜型の頻度は約33%と言われる12,13).代表的な亜型としては,右後区域の肝管が左肝管や胆嚢管,総胆管から直接分岐するようなものである.門脈と胆道系の亜型の相関がいわれており,MRCPによる評価が有用である13)(Fig. 9).左側胆嚢は門脈の分岐形態も複雑であるため,十分な評価が必要である6).
6. グラフトの計測とCT撮影移植グラフトの決定は,ドナーの肝臓の解剖学的構造,残存肝とグラフト肝の容量によって決定される.そのため,前述した血管解剖が評価できる撮影が必要である12,14).
著者の施設では,腹部USを実施し,脂肪肝の有無,正常亜型を念頭においた肝内血管の解剖学的構造について観察をする.特に左葉外側区をグラフトにする場合が多いため,門脈の分岐形態,門脈左枝の径と距離の計測,中肝静脈と左肝静脈について注意深く観察するようにしている(Fig. 10).CT検査は,単純CTで,脂肪肝の有無についてLS比を算出したのちに,造影CTを撮影する.造影CTは,上腹部中心に,動脈相,門脈相を,静脈相で腹部全体を撮影する.撮影後の画像は各造影3相の冠状断像と矢状断像の多断面再構成画像の作成,MIP画像,血管の3D画像を作成し,肝容量については,移植外科医が確認の上,肝全体や切除肝容量などをマニュアルで取り囲み計測している(Fig. 9a, 10c).造影CTで門脈分岐の亜型を認めた場合,基礎疾患に胆道系疾患が疑われる症例については必要に応じてMRCPを撮像している.

a.腹部US:門脈左枝の計測例
b.腹部US:肝静脈分岐の確認 本例は,中肝静脈と右肝静脈が合流し共通管となって下大静脈に合流しているように見えた.
c.肝の容量計測と左葉移植グラフトの計測例
小児肝移植の代表的な適応疾患,レシピエントおよびドナーの術前精査としての画像診断検査について解説した.近年,小児肝移植は好成績を示し,重症肝疾患の治療のひとつとして確立されている.その一端には,画像診断検査の技術的向上も寄与していると思われる.より安全に手術が行えるように,移植外科医をはじめ各診療科との連携を密にして,肝不全に苦しむ小児患者の治療に貢献できるように,今後もよりよい画像診断検査の実施が大切と考える.