2020 年 29 巻 1 号 p. 158-161
2020 年 29 巻 1 号 p. 158-161
【緒言】CPAP(continuous positive airway pressure)装置自動検出によるAHI(Apnea Hypopnea Index)とOCST(out of center sleep testing)によるAHIとが乖離するケースにおいて,波形解析が有効であった症例を報告する.
【症例1】68歳 男性.CPAP装置検出のAHIは3-6回/h程度で安定していた.しかしFlow波形の目視解析では,吸気波形の後に呼気波形を認めない波形が頻繁に記録されていた.OCSTを施行すると3%ODI(oxygen desaturation index):50回/h,REI(Respiratory event index):50回/hと呼吸イベントが多く残存しており,CPAP装置検出AHIと大きく乖離していた.
【症例2】63歳,男性.CPAP装置検出のAHIは1-3回/h程度で安定していたが,本人より睡眠が浅い気がするとの訴えがあり.波形解析を実施すると症例1同様の異常波形を認めた.OCSTを施行すると3%ODI:18.0回/h,REI:23.7回/hであった.
【考察】CPAP装置では検出できない呼吸イベントの把握において波形解析が有効であった.Auto CPAPが機能しないため,呼吸イベントの検出が不良であると推察された.更なるFlow波形の研究やArtificial Intelligenceによる画像解析によってCPAP装置の解析精度向上が望まれる.
持続陽圧呼吸(continuous positive airway pressure: CPAP)治療は,閉塞性睡眠時無呼吸症候群の患者に対して睡眠時にマスクを使用し,適切な圧力を持続的に気道へ加えることによって気道の閉塞を防ぐ治療法である.
適正圧の設定はPSG(polysomnography)下でのマニュアルタイトレーションが推奨されているが,PSGは患者・医療者共に負担が大きい.また,外来での治療評価は在宅でPSGを行うことは不可能で,検査施設外睡眠検査(out of center sleep testing: OCST)も頻繁に行うことは困難である.そのため多くの施設は,CPAP装置検出による自動解析AHI(Apnea Hypopnea Index)を活用している.
CPAP装置検出AHIとPSGによるAHIとの間に強い相関を認めたとの報告1,2)があり,一定の有効性は認められる一方,両者に誤差を生じるとも報告1,3)されている.そのため,大部分ではCPAP装置検出AHIはPSGによるAHIに近似するが,特定の患者において近似しているかは不明である.
CPAP装置はエアリークが多いと呼吸イベントを見落としやすい4)とも報告されているが,エアリークが少ない症例においてもCPAP装置検出AHIとPSGによるAHIが乖離するケースはしばしば経験し,乖離するケースの予測因子も明らかではない.
我々はCPAP装置検出AHIとOCSTによるAHI乖離するケースにおいて波形解析が有効であった症例を経験したので報告する.
【症例1】
68歳 男性.BMI:26.5 kg/m2,合併症:COPD,脳出血,狭心症,診断時AHI:66.7回/h,機器:DreamStation(Philips, Netherlands),モード:Auto CPAP,設定:下限圧 6 cmH2O,上限圧 9 cmH2O.CPAP装置検出ではAHI:3-6回/h,Leak:22-26 L/min(ラージリーク:0分)で安定していた.
内部データ解析のFlow波形は装着直後,吸気波形と呼気波形の面積が等しい正常の波形であったが,しばらくすると吸気波形の後に呼気波形をほぼ認めない異常な波形が頻繁に記録されていた(図1).CPAP装置が無呼吸など呼吸イベントを認識するとマーカーが表示されるが,マーカーはなく,CPAP装置は呼吸イベントとして認識していなかった(図2a).

波形解析におけるFlow波形
青線グラフ:Flow,赤線グラフ:CPAP圧
Flow波形は吸気で基線(0 lpm)よりもプラス,呼気でマイナスに描出される.
装着直後は覚醒しており,正常な呼吸であるため,吸気波形と呼気波形が交互に出現している.
一方,呼吸イベントを疑う波形では基線よりもマイナスである呼気波形を認めない.
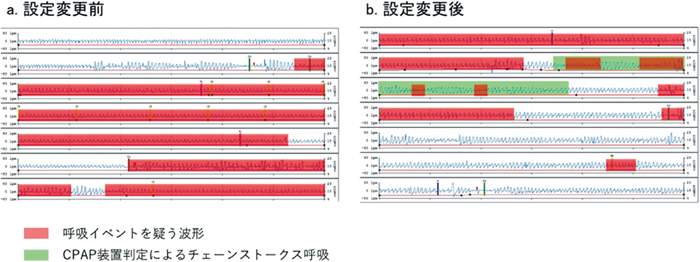
【症例1】設定変更前後のFlow波形
設定変更前と比較し,設定変更後は呼吸イベントを疑う波形が減少している.
しかし,まだ多く残存していることから設定変更を要する.
確認のためWatchPAT(WP-Itamar-Medical, Israel)によるOCSTを施行した.WatchPATはフローセンサーがなく,前胸部のいびき・体位センサーと指先のUPATプローブでSpO2や末梢動脈緊張(Peripheral Arterial Tone: PAT)を計測しており,PATの変化は交感神経活性の変化を反映することから呼吸イベントや覚醒を検出する機器である.結果は3%ODI:50回/h,REI:50回/hと呼吸イベントが多く残存しており,CPAP装置検出AHIと大きく乖離していた.
設定変更が必要であるが,内部データ解析からCPAP装置は呼吸イベントを認識できず,Auto CPAPが機能していないことが明らかとなった.呼吸イベントを認識できなければ下限圧からCPAP圧が上昇しないため,呼吸イベントが残存していた.そのため,下限圧を 6 cmH2Oから 8 cmH2Oに,それに伴い上限圧も 10 cmH2Oに変更した.
変更後のフォローアップではCPAP検出AHIを用いることができないため,波形解析を中心に評価を行った.設定変更により呼吸イベントと推測される波形は減少したが,十分ではなかった(図2b).その後もマスクの変更や圧の調整を継続しており,波形解析にて呼吸イベントが十分に減少した際にPSGにて最終評価を実施する予定である.
【症例2】
63歳,男性.BMI:24.9 kg/m2,合併症:なし,診断時AHI:44.4回/h,機器:DreamStation,モード:Auto CPAP,設定:下限圧 4 cmH2O,上限圧 8 cmH2O.CPAPサマリーではAHI:1-3回/h,Leak:18-22 L/min(ラージリーク:0分)程度で安定していたが,本人より睡眠が浅い気がするとの訴えがあり,波形解析を実施すると症例1と同様の呼吸イベントを疑う所見を認めた(図3a).また,Flow波形が小さくなり,低呼吸を疑う波形も認めたが,CPAP装置は呼吸イベントとして認識していなかった(図3b).

【症例2】設定変更前のFlow波形
a.呼気波形をほぼ認めないため,正常ではなく無呼吸や低換気など呼吸イベントが疑われる
b.前半と後半で振幅が明らかに異なる.
後半は換気量が減少していると推測されるが,低換気を示すマーカーはなく,CPAP装置は低換気を認識していない
WatchPATによるOCSTを施行すると3%ODI:18.0回/h,REI:23.7回/hとCPAP装置検出AHIと大きく乖離していた.
そのため,設定を下限圧 6 cmH2O,上限圧 8 cmH2Oへ変更した.その後も受診のたびに波形解析を行い,設定圧を調整した.1か月後には下限圧 7 cmH2O,上限圧 10 cmH2Oへ,2か月後には下限圧 8 cmH2O,上限圧 11 cmH2Oへ設定変更を行った.
呼吸イベントを疑う波形が消失したため,WatchPATで再検査するとREI:0回/h,AHI:0回/hであり,呼吸イベントは消失した(図4).

【症例2】設定変更後のFlow波形
呼吸イベントを疑う波形が消失した.
OCSTにおいてもREI:0回/hと改善していることが確認された.
CPAP装置では検出できない呼吸イベントの把握において目視による波形解析が有効であった.吸気波形の後に出現すべき呼気波形を認めないことが共通しており,このような波形には注意が必要である.我々が経験した2例はCPAP圧の調整でREIが改善したことから実際は閉塞性無呼吸であったと推測される.NPPVの波形解析において呼気波形が消失する場合は閉塞性無呼吸と考えらており5),原理的にはCPAPでも起こり得る.この場合の吸気波形はエアリークであり,エアリークを吸気と誤認しているため,リーク値も実際より低値であったと考えられる.
Flow波形から呼吸の変化を読み取ることは可能であり,低呼吸などの呼吸イベントの推測も可能である.内部データの解析はOCSTやPSGに置き換わるものではないが,波形解析も組み合わせることで評価の精度が向上すると考えられ,積極的に実施すべきであると考えられた.
外来の限られた時間で波形確認を行うことは困難である場合は,遠隔モニタリングの活用が有効である6).しかし,遠隔モニタリングでは波形解析ができない機器もあるため,CPAP装置を選択する際に解析ソフトの性能も考慮する必要がある.
呼吸イベントの検出不良により,Auto CPAPが機能しないケースがあることが明らかとなった.Auto CPAPのアルゴリズムは呼吸イベントを検出した際にCPAP圧を上昇するようになっており,呼吸イベントの正確な把握は重要な課題である.
Flow波形から呼吸努力関連覚醒反応(RERA)類似イベントが測定可能であり7),CPAP装置よる解析にも応用されている.Flow波形とAHIの関連について研究することによってCPAP装置の解析精度が向上し,Auto CPAPが有効に働くと考えられる.
今後の展望として技術革新によるCPAP装置の解析性能向上が望まれる.画像解析はArtificial Intelligence(AI)が得意とする分野であり,AIによる画像診断システムの開発が行われている8).AIの活用はCPAP装置のAHI自動解析精度向上にも寄与すると期待される.
本論文の要旨は,第28回日本呼吸ケア・リハビリテーション学会学術集会(2018年11月,千葉)で発表し,学会長より優秀演題として表彰された.
本論文発表内容に関して特に申告すべきものはない.