間質性肺炎(interstitial pneumonia; IP)には,原発性肺癌,肺高血圧症(pulmonary hypertension; PH),肺感染症,気胸などを合併することが知られており,いずれも予後に重大な影響を与える合併症である.したがって,合併症対策の意義は大きく,早期発見・診断ならびに適切な対応が求められる.
原発性肺癌の診断は時に遅れる場合もあり,血液中の腫瘍マーカーの測定と胸部CT所見を経時的に比較することが肝要である.また,手術および化学療法は,IPの急性増悪や薬剤性肺障害のリスクが問題となるため,治療適応は制限される.
PHの頻度は,対象患者の重症度や診断方法の相違によりその頻度は一定していないが,気腫合併肺線維症では高くなることが知られている.治療は酸素療法が主体となるが,肺血管拡張薬の適応も検討するべきである.
肺感染症では,肺抗酸菌症,肺アスペルギルス症,細菌性肺炎,ニューモシスチス肺炎,サイトメガロウイルス(CMV)肺炎などのリスクが高くなる.したがって,定期的に血中β-D-グルカン,アスペルギルス抗原・抗体,抗Mycobacterium avium complex抗体,インターフェロンγ遊離試験であるT-SPOT,CMVアンチゲネミアなどの測定を行うことが必要である.
IPでは気胸や縦隔気腫を合併しやすく,中等度以上の気胸では,胸腔ドレナージを考慮する.エアリークが遷延する症例では,胸膜癒着術や外科的治療なども考慮しなければならないが,IP急性増悪の誘因になる可能性があるため,実際には自己血癒着を行うことが多く,治療に難渋する場合も多い.
間質性肺炎の合併症管理は,予後に大きな影響を与えるため,日常臨床において常に注意を払わなければならない.
間質性肺炎(interstitial pneumonia; IP)には,原発性肺癌,肺高血圧症(pulmonary hypertension; PH),肺感染症,気胸などを合併することが知られており,いずれも予後に重大な影響を与える合併症である.したがって,合併症対策の意義は大きく,早期発見・診断ならびに適切な対応が求められる.
特発性肺線維症(idiopathic pulmonary fibrosis; IPF)には,10~30%に原発性肺癌が合併するとされており,同時・異時多発癌も高頻度に認められる1).また,IPの線維化巣と近接して発生することが多く,腫瘍病変が修飾されるため,時に診断が遅れる場合がある.そのためにも定期的に血液中の腫瘍マーカーの測定と胸部CT所見を注意深く経時的に比較することが肝要である.肺癌の外科的手術療法はIPの急性増悪のリスクを伴うため,慎重に適応が検討される.一方,化学療法においても,IPの急性増悪や薬剤性肺障害のリスクが問題となるため,抗癌剤の薬剤選択や治療適応は制限される.
IPF患者を対象にしたPHの頻度は,30%~50%と報告されているが2,3),対象患者の重症度や診断方法の相違によりその頻度は一定していない.治療としては,低酸素肺血管攣縮の改善を目的に長期酸素療法の導入が主体となるが,そのエビデンスは少ない.また,肺血管拡張薬による治療を支持するデータはなく,ガイドラインでも推奨薬剤は明記されていない4).
IP患者では,線維化病変により既存肺の構造が改築され,アスペルギルスや非結核性抗酸菌の感染が問題となる.また,IPに対するステロイド薬や免疫抑制薬による治療により,肺結核,細菌性肺炎,ニューモシスチス肺炎(PCP),サイトメガロウイルス(CMV)肺炎などのリスクが高くなる.したがって,定期的に血中β-D-グルカン,アスペルギルス抗原・抗体,抗Mycobacterium avium complex(MAC)抗体,インターフェロンγ遊離試験であるT-SPOT,CMVアンチゲネミアなどの測定を行うことが必要である.一般にイソジアニドおよびスルファメトキサゾール・トリメトプリム(ST合剤)の予防投与が推奨される.
IPでは気胸や縦隔気腫を合併しやすく,特にステロイド使用により合併頻度が高くなる.縦隔気腫や軽度の気胸では安静のみで経過観察となるが,呼吸困難を伴う気胸では,胸腔ドレナージの適応となる.また,エアリークが遷延する症例では,胸膜癒着術や外科的治療なども考慮しなければならない.しかしながら,これらの治療にはIPの急性増悪を引き起こす可能性があり,実臨床では自己血癒着などを繰り返し試みるが,治療に難渋する場合も多い.
本稿では,IPの合併症対策について,その問題点と管理法について自験例を交えながら概説する.
特発性肺線維症(idiopathic pulmonary fibrosis; IPF)を含むIP患者は高率に肺癌を合併することが知られており,その発生率は5-30%,相対リスクは7-14倍とされている1).最近では,気腫合併肺線維症(combined pulmonary fibrosis and emphysema; CPFE)における高い合併率が注目されており,本邦からの報告では約50%とも言われている5,6).また,既存のIPのために肺癌病変が修飾され発見が遅れる可能性があり,定期的な胸部CTフォローが必要である(図1A, B).さらに通常の水平断撮影では腫瘍の拡がりが限局的なものと判断される場合があるが,矢状断,冠状断撮影も追加することにより,発見時には広範な進展を認める症例も多い(図1C, D).IP合併肺癌では,腫瘍が線維化部あるいはその近傍から発生することが多いが,CPFEでは主に気腫部あるいは気腫と線維化が混在する部分からの発生を認める(図2)7).

肺癌を合併した気腫合併肺線維症
(A)初診時胸部HRCT:右上葉の気腫性病変に接して長径 4 mm大の小結節性病変を認める.(B)12ヶ月後の胸部HRCT:同部位の小結節性病変は長径 25 mmに増大.(C)胸部HRCT:左S6cの胸膜下の蜂巣肺に接して 40×35 mm大の辺縁不整,境界不明瞭な内部にair bronchogramを伴うconsolidationを認める.(D)胸部HRCT矢状断:同病変が上下に拡がっていることが確認できる(腫瘍生検の結果,肺腺癌と判明).

気腫合併肺線維症に合併した肺癌の手術検体
腫瘍(腺癌)は気腫部と蜂巣肺の境界部あるいは気腫と線維化が混在する部分からの発生を認める(矢頭).
IP合併肺癌の術後急性増悪発症率(AE)や全生存期間は術式の違いに加え,手術前のIPの重症度が影響する可能性がある.AE発症後の致死率は33.3-100%と幅があるものの高率である8).本邦での後ろ向き多施設共同研究の結果,画像上何らかの間質性肺炎を指摘された非小細胞肺癌合併患者1,763名中,術後AEは164名(9.3%)に認められ,その致死率は43.9%であった.さらに術後AEの危険因子として,男性,術前のステロイド治療歴あり,過去の急性増悪の既往あり,画像上UIPパターン,血清KL-6値>1,000 U/mL,%VC≤80%,区域切除以上の術式の7因子を挙げ,それらに重み付けの点数を振りスコアー化することによって術後AEの予測発症率を求める方法を提唱した9).本邦のIPF治療のガイドラインでは10),当該患者にとって手術療法は提案されるが,AEのリスクおよびベネフィットを医療者・患者双方が理解することが重要であるとし,AEリスクの高い患者に対して,手術の回避あるいは術式を縮小するなどを考慮する必要がある.また最近では,ピルフェニドンの術前予防投与が,術後AEのリスクを軽減したとする報告11)も認められるが,結論を出すにはさらなる検討が必要である.
一方,抗癌剤治療によるIPのAEないし薬剤性肺障害も致死率は高く問題になる.進行期肺癌患者に対する抗癌剤治療はbest supportive careと比較して有意に予後を改善させるが,IP合併肺癌患者に対しては明らかではない.IP合併進行期肺癌患者での使用禁忌薬剤としては,イリノテカン,ジェムシタビン,アムルビシンがあり,上皮成長因子受容体チロシンキナーゼ阻害剤も原則として用いられない.したがって,非小細胞肺癌においてはカルボプラチンとパクリタキセル併用療法,小細胞肺癌ではカルボプラチンとエトポシド併用療法が選択されることが多い.なお,二次治療以降の報告は少なく,今後の検討課題と考えられる.
正確なPHの診断には,右心カテーテル検査(right heart catheterization; RHC)が必要であり,平均肺動脈圧(mean pulmonary artery pressure; mPAP)が25 mmHg以上をPHと診断し,中でも肺動脈楔入圧が 15 mmHg以下の場合を肺動脈性肺高血圧症(pulmonary arterial hypertension; PAH)と定義されている12).一方,本邦では心臓超音波検査で代用される場合が多いが,過小あるいは過大評価される傾向にあるとの指摘もある.治療に関しては,低酸素性肺血管攣縮の改善を目的に長期酸素療法の導入が主体となるが,そのエビデンスは確立されていない.右心不全に対しては,安静,減塩,水分制限とともに,利尿薬,強心昇圧薬などが使用されることが多い.現在,PHに対して用いられる選択的肺血管拡張薬には,プロスタサイクリン経路,エンドセリン経路,一酸化窒素経路をターゲットにする3系統の薬剤がある.経口のプロスタサイクリン製剤,ホスホジエステラーゼ5型(PDE5)阻害剤のシルデナフィル,タダラフィル,エンドセリン受容体拮抗薬のボセンタン,アンブリセンタン,マシテンタンが広く使用されており,最近では,経口のPGI2受容体作動薬のセレキシパグが承認された.しかしながら,2013年に発表された米国心臓病学会からの報告では,安静時のmPAPが 25 mmHg以上のCOPD,IPF,CPFEに対するPH治療を支持するデータは存在しないとされ,推奨薬剤は明記されていない4).
IPFに対しては,これまでに幾つかの大規模臨床試験が行われているが13,14,15),現時点までPHを合併したIPFに対する肺血管拡張薬の使用によって,予後が改善するという結果は得られていない.一方,Hamadaら16)は,RHCを施行されたIPF患者78例を対象に,一般的なPHの診断基準よりも低い平均肺動脈圧(mean pulmonary arterial pressurer; mPAP)17 mmHgをcutoff値として,正常群とmPAP≥17 mmHg群で比較したところ,5年生存率でmPAP≥17 mmHg群が有意に予後不良であったと報告している.またKimuraら17)は,同じくRHCを施行されたIPF患者101例を対象に検討したところ,mPAP≥21 mmHgを有するIPF患者で高い致死率を示したと報告している.さらに最近,Furukawaら18)は,RHCを施行されたIPF患者273例を対象に,mPAP≥21 mmHgを有するhigher PH群の予測因子として,PaO2<80 Torr,%Dlco<50%,肺動脈径/大動脈径>0.9を挙げ,これらをスコアリングすることによって簡便にPH群の可能性を同定できることを証明している.これらの結果は,より早期のPH,境界型のPHにおける治療介入の意義の検証を推し進めるかもしれない.また,一部のCOPD,IPならびにCPFE患者では,呼吸機能障害が中等度にすぎないにもかかわらず,mPAPが 35~50 mmHgと著明な上昇と高度の呼吸困難を示す症例が存在することが明らかになってきており,このように肺血管病変の寄与度が高いと考えられる症例においては,臨床的有効性を期待して積極的な治療を考慮するべきと思われる.
IP患者では,線維化病変により既存肺の構造が改築され,アスペルギルスや非結核性抗酸菌の感染が問題となる.また,IPに対するステロイド薬や免疫抑制薬による治療により,肺結核,細菌性肺炎,ニューモシスチス肺炎(PCP),サイトメガロウイルス(CMV)肺炎などのリスクが高くなる.特に多発結節陰影などの非典型的な画像所見で発症する肺結核症(図3)や稀にインフルエンザウイルス感染後やステロイドパルス療法後に発症する致死的な侵襲性肺アスペルギルス症(図4)には注意が必要である.したがって,定期的に血中β-D-グルカン,アスペルギルス抗原・抗体,抗MAC抗体,T-SPOT,CMVアンチゲネミアなどの測定を行うことが必要である.一般に高齢者では結核の既感染者が多く,潜在性結核感染症の発病予防という考えからイソニアジドの予防投与,PCPに対してはスルファメトキサゾール・トリメトプリム(ST合剤)の予防投与が推奨される.
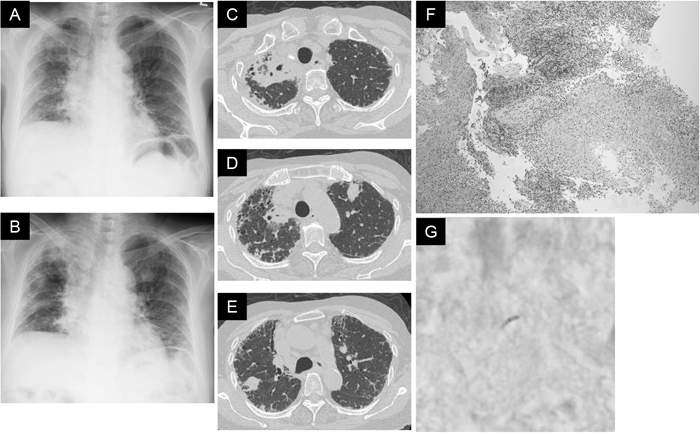
肺結核を合併した特発性肺線維症
(A)初診時の胸部X線写真:両肺の容積減少と両側下肺野を中心に網状陰影を認める.(B)初診から2ヶ月後の胸部X線写真:急性増悪に対してステロイドパルス療法後に,ステロイド 10 mgとピルフェニドン 1,800 mgで維持療法を行っていたところ,右肺尖部,両肺中~下肺野に多発性の結節陰影を認める.(C)胸部HRCT:右肺尖部に小空洞を有する腫瘤性病変を認める.(D, E)胸部HRCT:両肺に転移性肺腫瘍を思わせる多発性結節性病変を認める.(F)右肺尖部の腫瘤に対する経気管支肺生検検体:壊死を伴う肉芽腫性病変を認める.(G)チールネルゼン染色:赤く棒状に染色された抗酸菌を認める(1,000倍).ガフキー1号,結核菌PCR陽性.

線維化型非特異性間質性肺炎に致死的な侵襲性肺アスペルギルス症を合併した症例
(A, B)胸部HRCT:右S8-10を中心にair bronchogramを伴うコンソリデーション,左舌区に腫瘤性病変を認める.(C)剖検肺(左肺):肉眼的には左肺 786 gと重量が増しており,割面では,うっ血水腫,軽度の出血に加えて,胸膜下および肺底部を中心に腔内を埋める灰白色調の充実性病変を認める(矢印)(1 scale=5 mm).(D)病理組織学的所見:左下葉の充実性病変では,主に小葉内均一に線維化病変が拡がっているが,一部に小葉辺縁性の膠原線維の増加を伴う線維化がみられ,気腔は単純化されている.小円形炎症細胞浸潤は乏しく,線維化型非特異性間質性肺炎と考えられる(Elastic van Gieson stain)(1 scale=1 mm).(E)線維化内および肺胞腔内のアスペルギルス菌糸の増殖を認める(Grocott stain)(1 scale=100 μm).(F)肺静脈周囲から血管壁構造の破壊を伴って内腔に向かって,アスペルギルス菌による血管内侵襲を認める(Grocott stain)(1 scale=100 μm).
進行したIPでは気胸や縦隔気腫を合併しやすく,特にステロイド使用により合併頻度が高くなる.特に上葉優位型肺線維症患者では,経過中に高頻度に合併し,状態悪化の要因となり得る(図5).縦隔気腫や軽度の気胸では安静のみで経過観察となるが,呼吸困難を伴う気胸では,胸腔ドレナージの適応となる.また,エアリークが遷延する症例では,胸膜癒着術や外科的治療なども考慮しなければならない.しかしながら,これらの治療にはIPの急性増悪を引き起こす可能性があり,実臨床では自己血癒着,タルクなどを繰り返し試みるが,治療に難渋する場合も多い(図6).さらに,気胸後に急性増悪を合併する症例や気胸治癒後に呼吸機能が著しく低下することが知られている.
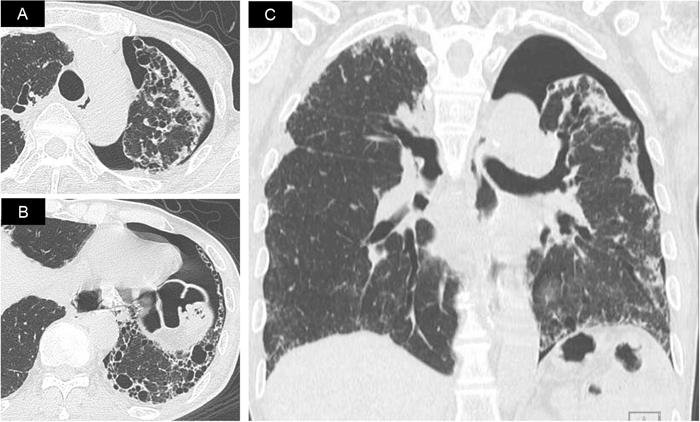
気胸を合併した上葉優位型肺線維症
(A)胸部HRCT:肺尖部の胸膜下に無気肺硬化および嚢胞性病変を認める.(B)胸部HRCT:肺底部には蜂巣肺の形成を認める.(C)胸部HRCT(冠状断):上葉優位の線維化分布と左気胸の拡がりを確認できる.

73歳,男性,気腫合併肺線維症
3度の右気胸に対して,直ちに胸腔ドレーンを挿入し脱気術施行.その後,エアリークが遷延するため,自己血癒着(50 ml-200 ml)を計11回,タルク 4 g/回を3回施行するも改善が得られなかった.入院4ヶ月後に同部位に膿胸を併発し,ようやくエアリークが止まり,気胸の治癒を認めた.
間質性肺炎の合併症管理は,予後に大きな影響を与えるため,日常臨床において担当主治医は常に注意を払わなければならない.また,診断後は治療のリスクとベネフィットを熟考した上で,専門医へのコンサルテーションや患者・家族への十分なインフォームドコンセントが求められる.
本論文発表内容に関して特に申告すべきものはない.