2023 Volume 143 Issue 1 Pages 27-36
2023 Volume 143 Issue 1 Pages 27-36
Retinoid-related orphan receptor alpha (RORα) participates in regulating several physiological processes, including metabolism and circadian rhythms. RORα is an important regulator of plasma cholesterol levels and is involved in lipid homeostasis. Its activation increases high-density lipoprotein (HDL) levels and metabolism of oxysterols. RORα-deficient mice develop atherosclerosis owing to decreased plasma HDL levels, increased expression of inflammatory cytokines, and ischemia/reperfusion-induced damage. The transcriptional activity of RORα is controlled by cholesterol and its derivatives, endogenous ligands that form transcription initiation complexes. Conversely, when intracellular cholesterol is reduced by lipid-lowering drugs such as statins, which inhibit cholesterol synthesis, the transcriptional activity of RORα is attenuated. Therefore, studies have focused on identifying target genes regulated by RORα involved in alleviating atherosclerosis to develop new therapies. Characterization of ligands, transcription-mediating factors, and transcription initiation complexes involved in the transcriptional regulation of RORα will facilitate the development of synthetic ligands and their potential applications in diseases such as atherosclerosis, dyslipidemia, and diabetes. In this review, we discuss the current literature on the structure and function of RORα, the target genes regulated by RORα, and the potential of RORα as a therapeutic target for atherosclerosis.
ステロイドホルモンや脂肪酸などの脂溶性シグナル伝達分子は,細胞質又は核内受容体を介して標的遺伝子の発現を転写レベルで制御する.1980年代,これらシグナル伝達分子の生理作用において中心的役割を担う核内受容体として,ステロイドホルモンであるエストロゲンやグルココルチコイド受容体がクローニングされ,続けてプロゲステロン,ミネラルコルチコイド,甲状腺ホルモン,ビタミンD受容体がクローニングされた.1)その後,それらの高い相同性を示すDNA結合領域のアミノ酸残基に対応するDNAプローブを用いたスクリーニングにより,レチノイド関連オーファン受容体α(retinoid-又はretinoic acid receptor-related orphan receptor alpha: RORα)などのリガンド不明なオーファン受容体が同定された.2)また,疾患に関連する核内受容体はリガンドにより調節可能であることから,創薬分野への応用が期待されている.
小脳形成不全による“よろめき”の表現型を呈するstaggerer(sg)変異は,RORα遺伝子内のリガンド結合ドメイン(ligand-binding domain: LBD)をコードする第5エキソンのフレームシフトによって新たに終止コドンを生じる.3,4)病理学的解析により,sgマウスは低レベルの高密度リポタンパク質(high density lipoprotein: HDL)コレステロール血症や過剰な炎症反応を引き起こし,高脂肪食摂取によって動脈硬化病変の増悪が示される.5)動脈硬化は,動脈の肥厚や脂質沈着にともなう血管機能の低下を主徴とする病変であり,本邦の死因上位に挙げられる脳梗塞や心筋梗塞の主因になると考えられている.脳虚血再灌流(ischemia reperfusion: IR)の損傷を受けたsgマウスは野生型マウスに比べ,脳梗塞サイズや浮腫,アポトーシスが増加する.一方で,RORαを脳特異的に過剰発現させたトランスジェニックマウスでは,脳梗塞サイズが減少する.6)また,心筋IR傷害を受けたsgマウスは野生型マウスに比べ,心筋梗塞サイズやアポトーシスの増加とともに,心筋収縮機能不全の増悪が示される.一方で,RORαを心筋細胞特異的に過剰発現させたマウスでは,心筋IR傷害に対して保護作用が示される.7)すなわち,RORα核内受容体を含めた転写制御ネットワークのはたらきに,動脈硬化の進展抑制とともに脳梗塞や心筋梗塞に対する抑制作用があると推測される.
このような背景から筆者は,RORα核内受容体が制御する標的遺伝子群の探索により,動脈硬化の抑制機構の解明とともに,RORαを制御する創薬応用への研究に着手した.8)本稿では,RORαの機能及びその標的遺伝子とリガンドについて,過去の報告とともに筆者の研究成果を報告する.
RORαは甲状腺ホルモン,レチノイン酸,ビタミンDの受容体を含む核内受容体のNR1ファミリーのメンバーであり,NR1F1とも呼ばれる.RORαの構造は選択的なプロモーターとスプライシングによって,アミノ末端領域のみが異なり,共通のDNA結合ドメイン(DNA-binding domain: DBD)とLBDを含むいくつかのアイソフォームが生成される.ヒトではRORα1–4の4つのアイソフォームが,マウスではα1及びα4の2つのアイソフォームが存在する.4,9)それらアイソフォームは組織や細胞種に特異的な発現パターンを示し,異なる標的遺伝子の発現調節を介して多様な生理反応に関与していると推測されるが,それぞれのアイソフォームによる選択的な発現制御メカニズムについてはいまだ不明である.
核内受容体はホルモン応答配列として知られる特定のDNA配列に結合することにより,標的遺伝子の転写を活性化又は不活性化する.RORαは単量体として機能し,6つのA/T-リッチ配列に続くコアハーフサイトRGGTCA(R; A or G)を含むROR応答配列(ROR response element: RORE)に結合する.9)同様に,RORαと高い相同性を示すreverse strand of ERB(REV-ERB)も単量体としてROREへ結合する.REV-ERBはDNA結合能を有するが,転写活性化能のない転写抑制因子として機能し,RORαと競合して概日リズムの調節に係わる.10)RORαによるRORE依存的な転写調節は1つのハーフサイトに基づいているが,2つのハーフサイトを含む他のホルモン応答配列と重なるデュアルエレメントの存在も示されている.11–13)例えば,シトクロムP450に分類されるCYP7B1のROREは肝臓X受容体(liver X receptor: LXR)の応答配列(LXRE: AGGTCAハーフサイトが4塩基で隔てられたダイレクトリピート)と重なっているため,LXR-レチノイドX受容体(retinoid X receptor: RXR)の二量体による活性化及びRORαによる抑制が生じ,それらが競合的に転写調節に係わる.12)また,ペルオキシソーム増殖因子活性化受容体γ(peroxisome proliferator-activated receptor gamma: PPARγ)の応答配列(PPRE: AGGTCAハーフサイトが1塩基で隔てられたダイレクトリピート)もROREと重なっているため,RORαはPPARγ-RXRの二量体と競合することによりPPARγ転写ネットワークを負に調節し,脂質恒常性の制御に係わる.13)これら核内受容体は標的遺伝子がもつ応答配列に依存しているが,核内受容体のDNA結合親和性や発現レベル,またリガンドや転写仲介因子の有無によっても巧妙に調節されている(Fig. 1).

Retinoid receptor-related orphan receptor α (RORα) binds as a monomer to the ROR response element (RORE) containing the RGGTCA (R; A, or G) consensus motif, preceded by an A/T-rich region in its target genes. The reverse strand of ERBA (REV-ERB) competes with RORα to bind ROREs. The liver X receptor (LXR) and peroxisome proliferator-activated receptor (PPAR) bind to the LXR response element (LXRE) and PPAR response element (PPRE) and overlap with RORE. RORα interacts with co-regulators as coactivators or corepressors to positively or negatively regulate transcription, respectively. Specific ligands (including cholesterol, oxysterols, provitamin D3, and their derivatives) can modulate basic transcription complex formation through RORα and co-regulator interactions. RORα is critical for regulating several physiological functions through the expression of its target genes and may play a role in various pathologies. RORα and its regulatory networks may serve as potential novel targets for developing therapeutic strategies to intervene in various disease processes. Reproduced with permission from Biol. Pharm. Bull., 44(11), 1607–1616 (2021).8) Copyright 2021 The Pharmaceutical Society of Japan.
動脈硬化の抑制分子を同定するために,動脈硬化の病態に基づいた順遺伝学による探索と,動脈硬化に係わる特定遺伝子の機能欠失に基づいた逆遺伝学による探索が行われている.動脈硬化抑制に寄与するRORαの機能欠失及び機能獲得を用いた転写制御解析によって,RORαの標的遺伝子群が同定されている.筆者はRORαによる転写調節がROREへ依存していることに着目し,RORαへの強い結合性と応答性を有するRORE候補配列をヒトゲノムワイドに検索することで,標的遺伝子を同定するための手掛かりとしてきた.14–17)
概日リズムの調節に係わる概日時計因子(BMAL1, CLOCK, NPAS2, CRY1)の発現はRORαの発現レベルに連動して上方制御され,一方でRORαと競合するREV-ERBによって下方制御される.10)また,RORαはHDLの主要な構成成分となるアポリポタンパク質(apolipoprotein: APO)A1, APOA5, APOC3や,細胞内のコレステロール放出に係わるATP結合カセットトランスポーター(ATP binding cassette subfamily: ABC)A1やABCG1,脂質代謝のマスターレギュレーターであるステロール調節配列結合タンパク質1c(sterol regulatory element-binding protein 1c: SREBP1c)などの脂質代謝関連遺伝子群を発現調節し,血中のHDLコレステロール量の維持に重要な役割を果たしている.18–20) RORαの活性化や発現レベルはステロールリガンドや概日時計因子によっても制御されており,動脈硬化病態においてステロール代謝や概日リズムの複雑な相互関係が推測される.21,22)ステロールリガンドや概日時計因子のはたらきを考慮すると,脂質代謝異常症等に対して細胞内のコレステロール量を制御する従来のスタチン療法において,薬剤を投与する時間や期間も重要な要素としてとらえることが,より効果的な治療へつながるのかもしれない.
RORαは,NF-κB inhibitor α(IκBα)の発現増加を通じて,NF-κB経路を阻害する抗炎症レギュレーターとしても機能する.23)ヒトマクロファージ様分化細胞におけるRORα欠失は,IκBαによるNF-κB阻害が消失し,その制御下にある炎症性サイトカインであるtumor necrosis factor(TNF)α, interleukin(IL)-1β, IL-6の発現を過剰にさせる.24)また,筆者はマクロファージにおけるコレステロール逆転送系に対するRORαの役割について着目してきた.動脈硬化病変で観察される単球からマクロファージへの分化時や,通常酸素から低酸素への虚血時に応答してRORαの発現は誘導された.16,25) RORα誘導時の機能を模倣するために,RORαの過剰発現あるいはアゴニスト処理をしたところ,細胞内の蓄積コレステロールエステルを遊離コレステロールに変換する中性コレステロールエステル水解酵素1(neutral cholesterol ester hydrolase 1: NCEH1)の発現量が増加し,蓄積コレステロールエステルからなる脂肪滴が縮小した.一方で,RORαのsiRNAノックダウンあるいはROREへの変異導入によってRORαによるNCEH1への発現調節が消失した.すなわち,RORαを活性化させることによってNCEH1発現亢進とともにコレステロール逆転送系が促され,それにより動脈硬化が抑制されると示唆された(Fig. 2).16)

Monocytes in the vessel lumen pass between endothelial cells and differentiate into macrophages. When macrophages absorb excessive amounts of oxidized low-density lipoprotein (ox-LDL), lipid droplets composed of cholesterol esters are formed and become foamy macrophages. Vascular endothelial cells obtrude the vessel lumen due to foamy macrophages, thereby exacerbating atherosclerotic lesions. In macrophages, retinoid receptor-related orphan receptor α (RORα) increases the expression of neutral cholesterol ester hydrolase 1 (NCEH1), an enzyme that converts cholesterol esters to free cholesterol; ATP-binding cassette protein A1 (ABCA1) and ABCG1 cholesterol reverse transporters; and the apolipoprotein A1 (APOA1) and APOC3 components of high-density lipoprotein (HDL). RORα reduces intracellular cholesterol ester-containing lipid droplets. This work is based on reference 16.
筆者は血管内皮細胞におけるRORαの役割についても着目してきた.細胞間の密着結合の形成に係わるクローディンファミリーのメンバーであるclaudin domain containing 1(CLDND1,別名CLDN25)は,脳梗塞及び心血管疾患のバイオマーカーとしても注目されている.CLDND1はRORαと共通の組織発現分布を示し,RORαの過剰発現あるいは発現抑制に連動して調節された.また,その調節はCLDND1プロモーター領域のRORE及びRORαリガンドに依存的であることが示された.15,26)更に,CLDND1発現はmyeloid zinc finger 1(MZF1)やETS domain-containing protein 1(ELK1)転写因子によっても転写レベルで調節され,microRNA-124によってmRNAの3′-非翻訳領域に作用し転写後レベルで調節された.27–29)脳卒中易発症性高血圧自然発症ラット(stroke-prone spontaneously hypertensive rat: SHRSP)及び対象ラットの脳組織を用いた比較実験において,microRNA-124減少にともないCLDND1増加が観察された.また,コラゲナーゼ処理による脳出血誘導マウスの実験及びin cellulo透過性実験において,CLDND1の発現低下が細胞間の物質透過性を増加させ,それにより脳出血リスクを高めることが示唆された(Fig. 3).30,31)

Claudin domain containing 1 (CLDND1) is a member of the claudin family of cell adhesion molecules and is involved in forming tight junctions between endothelial cells. CLDND1 expression is transcriptionally regulated by retinoid receptor-related orphan receptor α (RORα), myeloid zinc finger 1 (MZF1) and ETS domain-containing protein-1 (ELK1). This RORα-mediated regulation is accompanied by weak transcriptional activation of RORα when the RORα ligand cholesterol analogs are reduced by treatment with statins (cholesterol synthesis inhibitors), thereby decreasing CLDND1 expression. Post-transcriptionally, CLDND1 mRNA stability is regulated by microRNA-124. Brain hemorrhage-induced mice and tight junction permeability experiments suggested that decreased CLDND1 expression increases cell-to-cell permeability, thereby exacerbating brain hemorrhage. This work is based on references 15, 26, 27, 28, 29,30, and 31.
多くの毒物や薬物は,肝臓の異物代謝酵素によって解毒され,排泄される.解毒には酸化や還元,抱合などに関する酵素群が存在しており,中でも酸化や還元反応を触媒するシトクロムP450は中心的な役割を果たしている.代謝酵素に対するRORαの役割は,オキシステロールの解毒に係わるステロール7α水酸化酵素(CYP7B1, CYP39A1),その経路の下方に位置し胆汁酸合成にも係わるステロール12α水酸化酵素(CYP8B1),ステロイドホルモンであるアンドロゲンからのエストロゲン合成に係わるアロマターゼ(CYP19A1)などのオキシゲナーゼ活性を有する酵素,及びオキシステロールの硫酸抱合に係わる硫酸転移酵素(sulfotransferase: SULT)2A1やSULT1B1などの抱合酵素の転写調節因子として機能する.12,17,32–36)筆者は強い神経細胞毒性を示す24S-ヒドロキシコレステロール(24S-hydroxycholesterol: 24-OHC)のCYP39A1による選択的代謝機構に着目してきた.CYP39A1のプロモーター及び第1イントロン内には2つのROREが存在し,その配列依存的にROR αが結合することで発現亢進され,その発現はROR αアゴニストにより誘導された.17)このような酵素群の発現調節は,細胞内のコレステロールを循環させるために一過的にオキシステロールへ変換することで肝外組織のコレステロール代謝に寄与し,オキシステロールの解毒,胆汁酸合成,ステロイドホルモン合成などの様々な生理的プロセスの制御に係わる.22)
肝臓における糖新生はアミノ酸やピルビン酸等からのグルコースの新たな合成であり,絶食時のエネルギー供給の手段として生命維持に必須である.肝糖新生に不可欠な律速酵素であるグルコース-6-ホスファターゼ(glucose-6-phosphatase: G6PC)及びホスホエノールピルビン酸カルボキシキナーゼ1(phosphoenolpyruvate carboxykinase 1: PCK1)の発現は,RORαとそのコアクチベーターであるsteroid receptor coactivator 2(SRC2)により調節され,血中へのグルコース放出の制御によりエネルギー供給とともにグルコース恒常性の維持に係わる.14,37)筆者は肝糖新生の発現調節におけるRORαの役割についても着目してきた.PCK1プロモーター領域に存在するRORE及びそれに隣接するcAMP応答配列に対して,RORα及びcAMPにより活性化されたCCAAT/enhancer binding protein(C/EBP)β転写因子が相乗的な発現亢進に作用し,その発現及び糖新生がRORαインバースアゴニストの作用により減弱した.14)
高LDLコレステロールや低HDLコレステロールをともなう脂質代謝異常,高血糖による血管壁への障害をともなう糖代謝異常,及び血管壁への慢性的な炎症反応は動脈硬化の危険因子として考えられており,このようにRORαの標的遺伝子群を明らかにすることにより,動脈硬化に関連する病態の分子メカニズムの一端が理解でき,新たな標的分子を基盤とした治療法開発への応用が進むと期待される(Fig. 4).
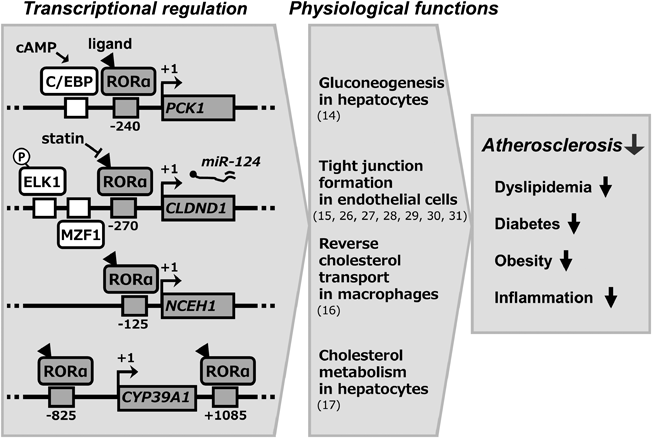
Retinoid receptor-related orphan receptor α (RORα) binds to the ROR-responsive elements in target genes to regulate their transcription. ROR-responsive elements are located at position numbers from the transcriptional start site as +1. The transcriptional activity of RORα is activated by cholesterol analogs, which are endogenous ligands. Statins are lipid-lowering drugs that attenuate RORα transcriptional activity. The authors identified several genes involved in the physiological functions of RORα target molecules. These include genes encoding for phosphoenolpyruvate carboxykinase 1 (PCK1), a glycogenic rate-limiting enzyme; claudin domain containing 1 (CLDND1), an adhesion molecule involved in tight junction formation; neutral cholesterol ester hydrolase 1 (NCEH1), an enzyme involved in the reverse cholesterol transport system; and CYP39A1, an oxysterol-metabolizing enzyme. The molecular mechanisms related to atherosclerosis have been previously described on references 14, 15, 16, 17, 26, 27, 28, 29, 30, and 31. These genes may serve as new therapeutic targets for controlling dyslipidemia, diabetes, obesity, inflammation, and atherosclerosis.
RORα-LBDの結晶構造解析及び質量分析によって,RORα内因性リガンドとしてコレステロール,コレステロール硫酸,7-デヒドロコレステロール(別名:プロビタミンD3),及び一部のモノヒドロキシルコレステロールが同定されている.38,39) 7α-ヒドロキシコレステロールは胆汁酸代謝における中間体であり,RORαの高親和性リガンドとしてコアクチベーターとの相互作用を制御し,RORαの標的遺伝子を転写抑制する.40)また,24-OHCは脳内に多く存在することからセレブロステロールとも呼ばれ,中枢神経系からのコレステロール排泄の中間体として重要な役割を果たすとともに,RORαの高親和性リガンドとしてコアクチベーターとの相互作用を減弱させ,RORαの標的遺伝子を転写抑制する.41)興味深いことに,24-OHCを選択的に代謝するCYP39A1の発現は,24-OHCレベルを感知するRORαにより発現調節されており,代謝酵素の発現量においてその基質をリガンドとする核内受容体の重要性が示唆された.17)これらのオキシステロールはRORαのインバースアゴニストとして作用する一方で,LXRのアゴニストとしても作用しており,RORαとLXRの競合的な遺伝子発現調節の一端を担っている.12,22)また,7-デヒドロコレステロールから生成されるビタミンDヒドロキシ化代謝物はRORαのインバースアゴニストとして作用する一方で,ビタミンD受容体(vitamin D receptor: VDR)のアゴニストとしても作用する.42)更に,コレステロール合成経路を抑制する薬剤として,ヒドロキシメチルグルタリル-CoA還元酵素(hydroxymethylglutaryl-CoA reductase: HMGCR)阻害剤であるスタチン系,あるいはステロール14α脱メチル化酵素(CYP51)阻害剤であるアゾール系を用いると,RORαの内因性リガンドであるコレステロール類縁体が枯渇するとともに転写活性化能が低下し,それによりRORα標的遺伝子の発現量が減少する.26,43)このように,これら核内受容体のそれぞれが多様な内因性リガンドを感知し,それらリガンドへの結合が競合して相互的な転写調節に係わると推測されるが,そのメカニズムの全貌は不明である.22,42,44)
核内受容体へのアゴニスト結合は核内受容体とコアクチベーターの結合を促し,ヒストンアセチル化酵素活性によりユークロマチン状態を生じさせ,プロモーター上への転写開始複合体形成の促進とともに転写を亢進する.一方,核内受容体のコリプレッサーとの結合は,ヒストン脱アセチル化酵素活性によりヘテロクロマチン状態を生じさせ,転写開始複合体形成の抑制とともに転写を抑制する.これらの機構は,アゴニストの未結合状態には核内受容体へコリプレッサーが結合し,アゴニスト結合後にコリプレッサーが解離してコアクチベーターとの結合が成立する.45)このように核内受容体と転写開始複合体との相互作用に影響を与えるリガンドは,様々な疾患治療のための創薬標的として注目されている.RORαリガンドにおいて,天然化合物,合成アゴニストやインバースアゴニストによるRORα活性調節を通じた疾患治療を目指した応用研究がいくつか報告されている.
柑橘類の果皮へ豊富に含まれる天然化合物ポリメトキシフラボノイドの一種であるノビレチンはRORαアゴニストとして作用し,食事誘発性肥満マウスにおいてRORα活性化を介して時計調節因子依存的にエネルギー消費及び運動量を増大させ,糖及び脂質の代謝異常を抑制させる.46)
LXRの合成アゴニストであるT0901317は,RORαを抑制するインバースアゴニストとしても作用する.47) T0901317のアミド誘導体として合成されたSR1078は,RORαを活性化するアゴニストとして作用し,コアクチベーターとの結合を増加させる.48) SR1078によるRORα活性化は,マクロファージにおいてKrüppel-like factor 4(KLF4)転写因子の発現調節を介して,抗炎症作用を示すM2分極化を誘導し,非アルコール性脂肪性肝炎(nonalcoholic steatohepatitis: NASH)の発症を抑制させる.49)筆者はSR1078によるRORα活性化によって,脂質代謝遺伝子の発現調節を介して動脈硬化の要因となる細胞内の蓄積コレステロールが除去されることを明らかにした.16)また,RORαの発現低下やミスセンス変異による発現調節異常は自閉スペクトラム症(autism spectrum disorder: ASD)の要因となることも示されている.ASDモデルマウスにおいてSR1078は,RORα標的遺伝子であるASD関連因子(CYP19A1, A2BP1, ITPR1, NLGN1)を発現亢進させるとともに,反復行動などの自閉スペクトラム症状を緩和させる.50)
RORαアゴニストであるチオ尿素誘導体JC1-40は,メチオニン・コリン欠乏食により誘発させたNASHマウスにおいて,抗酸化酵素であるスーパーオキシドジスムターゼ2(superoxide dismutase 2: SOD2)及びグルタチオンペルオキシダーゼ1(glutathione peroxidase 1: GPX1)の発現亢進,更に炎症性サイトカインであるTNFα及びIL-1βの発現抑制を介し,活性酸素種による酸化ストレス及び炎症を減弱させてNASH増悪を緩和させる.51)
RORαアゴニストであるRS-2982は,高脂肪食摂取によるNASHマウスにおいてRORα標的遺伝子である線維芽細胞増殖因子21(fibroblast growth factor 21: FGF21)及びmicroRNA-122を発現亢進させ,肝トリグリセリドの蓄積抑制とともに繊維症関連因子(ACTA1, COL1A1, COL3A1, TGFBR2, TGFB2)の発現減少を通じて,肝脂肪毒性及び肝線維化を抑制させる.52)
RORαインバースアゴニストであるSR1001は,RORα及びRORγtによるコアクチベーターへの結合抑制を通じてIL-17Aを発現抑制し,自己免疫疾患に係わるTh17分化,及びIL-21とIL-22サイトカインの産生を抑制させる.53)また,インスリンを産生する膵臓β細胞の自己免疫性破壊にともなう1型糖尿病マウスにおいて,SR1001はTh17を介したサイトカイン産生を抑制し,膵臓炎症及び糖尿病発症率を減少させる.54)更に筆者は肝細胞培養系において,SR1001により糖新生律速酵素PCK1の発現抑制とともに,糖新生が減少することを明らかにした.14)また,RORαインバースアゴニストであるSR3335は,食事誘発性肥満マウスにおいて糖新生律速酵素G6PCを発現抑制し,肝糖新生の抑制とともに血糖値を減少させて耐糖能異常を緩和させる.55)
上記のように,RORαリガンドによるRORαを介した標的遺伝子の発現調節は,動脈硬化,NASH,脂質異常症,糖尿病を含むいくつかの疾患に対する新たな治療戦略としての発展性が期待される.
本稿では,RORαによる標的遺伝子の発現調節を通じた動脈硬化の抑制作用,及び動脈硬化の危険因子として挙げられる脂質異常症や糖尿病などの関連疾患に対するRORαリガンドの創薬応用への可能性を中心に紹介した.その中で筆者はRORα標的遺伝子として,糖新生に係わる律速酵素PCK1,細胞間密着結合に係わる接着分子CLDND1,コレステロール逆転送系に係わる酵素NCEH1,オキシステロール代謝に係わる酵素CYP39A1を同定し,それらの発現がRORα合成リガンドにより制御可能であることを報告した.また生体内におけるRORα活性化は,その内因性リガンドであるコレステロール類縁体により促進される一方で,スタチンなどの脂質降下薬によって細胞内コレステロールの減少を通じて減弱することについても報告した.今後,RORαと相互作用する転写仲介因子とともに転写開始複合体の詳細な特徴が明らかとなれば,RORα合成リガンドの創薬開発が進展すると期待される.更に,動脈硬化抑制に係わるRORα転写制御ネットワークの解明を通じて,動脈硬化に関連する病態の分子メカニズムの理解が進み,新たな標的分子を基盤とした治療法開発への応用も期待される.しかし,RORαが複数種の内因性リガンドの違いをいかにして感知し,更に生体内でどのように他の核内受容体と競合的に相互作用して標的遺伝子群の発現を活性化又は抑制しているのかについては,いまだ不明な点も多い.また,筆者はin silicoによるゲノムワイドなRORE検索を手掛かりとしてRORα標的遺伝子の探索を進めており,生体内における発現制御ネットワークの全容解明には至っていない.現在,動脈硬化抑制分子の候補と成り得るRORα標的遺伝子群を網羅的に同定するためにトランスクリプトーム解析を進めている.また,RORαアイソフォームの差異による制御系の違いを明らかにするとともに各アイソフォームの発現分布を考慮し,それらアイソフォームに対して選択的なリガンドの開発も視野に入れて解析を進めている.
本研究を実施するにあたりご指導を賜りました福山大学薬学部の道原明宏教授ならびに松井隆司教授に心より感謝申し上げます.また,多大なるご支援を頂きました同大学薬学部の志摩亜季保助教ならびに病態生理・ゲノム機能学研究室の学部生の皆様に深謝申し上げます.なお,本研究の一部は科学研究費補助金(JP21K06791),国立遺伝学研究所NIG-JOINT(7A2019, 73A2018),及び福山大学研究助成(GARP2019-103, GARP2018-103)の支援を受けて行われました.
開示すべき利益相反はない.
本総説は,2021年度日本薬学会中国四国支部奨励賞の受賞を記念して記述したものである.