2023 年 143 巻 11 号 p. 883-887
2023 年 143 巻 11 号 p. 883-887
p-Hydroxyamphetamine (p-OHA) is an active metabolite of amphetamine (AMPH) and methamphetamine (METH), and can be detected in the brain for a relatively long period after high-dose administration of AMPH in rodents. p-OHA may be involved in the abnormal behavior observed during the withdrawal period after a chronic administration of AMPH or METH. Therefore, the author investigated the effect of an intracerebroventricular (i.c.v.) administration of p-OHA on the changes of locomotor activity and prepulse inhibition (PPI) in the acoustic startle response in rodents. The i.c.v. administration of p-OHA significantly increased locomotor activity in mice. This effect was prevented by a pretreatment with a dopamine (DA) uptake inhibitor. Furthermore, local infusion of p-OHA into the nucleus accumbens (NAc) significantly increased locomotor activity in rats. Together these results suggest that dopaminergic systems in the rodent NAc may play important roles in p-OHA-induced locomotor activity. Next, the author tested the effects of the i.c.v. administration of p-OHA on PPI in mice. p-OHA induced PPI disruptions that were significantly improved by the pretreatment with a typical or an atypical antipsychotic, D2 or D4 receptor antagonists, respectively. p-OHA-induced PPI disruptions were also improved by a serotonin (5-HT)2A receptor antagonist, a 5-HT synthesis inhibitor or a 5-HT neurotoxin. These results suggest that p-OHA-induced PPI disruptions were mediated by DA and 5-HT release and subsequent stimulation of D2, D4 and 5-HT2A receptors. Our recent series of reports indicate that the study of p-OHA may provide new insights into drug abuse as well as psychiatric disorders such as schizophrenia.
Amphetamine(AMPH)は脳内dopamine(DA),noradrenaline,serotonin(5-HT)及びその他の神経伝達物質遊離を増加させることにより無食欲,身体能力の一時的な向上,不眠,多幸感など様々な神経行動変化を引き起こす.1) AMPHの神経伝達物質遊離増加は①シナプス小胞に貯蔵されているカテコールアミンを細胞質に排出,②細胞膜取り込み輸送担体を介したカテコールアミンの逆輸送,③monoamine oxidase(MAO)活性阻害,などによると提唱されている.2,3) AMPH置換体としてmethamphetamine(METH),methylphenidateなどがあり,それ自身が持つ精神機能や行動に強く働きかける薬理作用により,多くの国や地域,文化圏において医療的及び社会的役割を担うものもあるが,神経変性及び薬物依存を起こし得る.2)げっ歯類において,AMPHやMETHを含む乱用薬物の投与により自発運動量の増加,4,5)常同行動,6,7)音響驚愕反応に対するprepulse inhibition(PPI)障害8,9)など,多くの行動変化が報告されている.
p-Hydroxyamphetamine(p-OHA)はAMPH及びMETHの活性代謝物である(Fig. 1).10) AMPHが末梢で代謝され生成したp-OHAは血液脳関門を容易には通過せず,11)血液脳関門を通過したAMPHが脳内DA-β-hydroxylaseによってp-OHAに代謝される.12,13)興味深いことに,AMPHは投与後に体内から速やかに排泄されるにもかかわらず,比較的長期間脳内の様々な部位においてp-OHAが検出されることから,14,15) AMPH常用者やげっ歯類へのAMPH慢性投与後の離脱期間状態に生じる異常行動にp-OHAが関与する可能性がある.実際,p-OHAをマウスの脳室内に投与すると首振り行動(head-twitch response: HTR)が発現し,そのp-OHA誘発性HTR発現に中枢5-HT神経系が関与することが明らかにされている.16)

上述のような背景から筆者は,p-OHAの中枢神経系への影響を検討する目的で,げっ歯類へのp-OHA脳内投与による自発運動量の変化や音響驚愕反応に対するPPI変化について行動薬理学的検討を行い,p-OHAが自発運動量を増加させること,PPI障害を示すこと,それら行動異常に脳内ドパミン・セロトニン神経系が関与することを報告してきた.10,17–19)
ddY系雄性マウスに対しp-OHAを20–80 µgの用量で脳室内投与すると,対照群と比較して有意かつ用量依存的に自発運動量を増加させた[Figs. 2(A), (B)].17) AMPHが脳内でp-OHAに代謝されたのち,p-OHAは更に水酸化されp-hydoxynorephedrine(p-OHN)へと代謝が進行する(Fig. 1).10)そこで,p-OHNについても同様に脳室内投与したが,有意な自発運動量の変化はみられなかった[Figs. 2(C), (D)].17)このことから,p-OHA自身がマウスの自発運動量を増加させることが明らかになった.p-OHA脳室内投与による自発運動量増加はDA再取り込み阻害薬で有意に抑制され,5-HT再取り込み阻害薬やDA-β-hydroxylase阻害薬ではp-OHA誘発性自発運動量増加に影響を及ぼさなかった(Table 1).17,19)また,ラットを用いてDA神経終末部の側坐核にp-OHAを局所投与したところ,用量依存的にラットの自発運動量を増加させ,DA再取込み阻害薬によりその自発運動量増加は有意に抑制されたことから,げっ歯類におけるp-OHA誘発性自発運動量増加に中枢DA神経系が関与し,p-OHAの作用部位として側坐核が重要であることが示唆された.17)マウス,ラットともに,p-OHAの投与量が高用量になるほど,有意な自発運動量増加が早期に発現したが,作用発現のピークはラット側坐核のp-OHA(0.5, 1, 2 µg/rat)局所投与では投与後60–75分をピークとした自発運動量増加がみられた.17)マウス脳室内投与ではp-OHA 80 µg/mouseの用量で同様のピークの自発運動量増加が観察されたことから,17)マウス脳室内投与ではp-OHA 80 µg/mouseの用量で,側坐核におけるDA遊離が自発運動量増加に強く関与すると予想された.一方,20, 40 µg/mouseの用量では投与後90分をピークとした自発運動量増加がみられたが,p-OHAのマウス脳室内投与により,中枢5-HT神経系が関与するHTRも発現することから,16) HTRの発現量によって自発運動量増加のピークに違いが生じたことも考えられ,今後は行動量とHTRの同時測定を検討する必要がある.
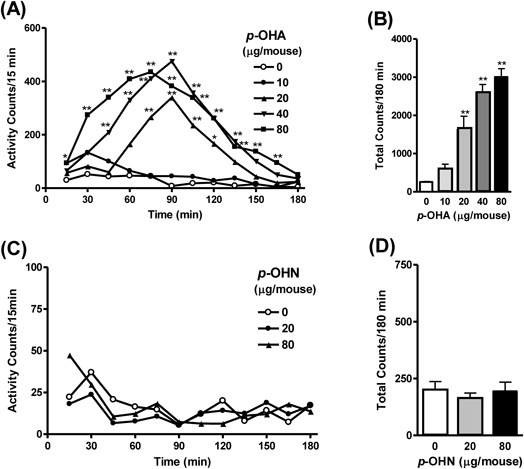
(A, B) or p-OHN, (C, D) on locomotor activity in mice.17) (A, C) Time course of locomotor activity. Ordinates give the mean numbers of photocell counts within 15-min periods. (B, D) Total locomotor activity during a 180-min period. Data represent the means±standard errors of the mean (S.E.M.) for 10–15 animals per group. * p<0.05, ** p<0.01 vs. the Ringer’s only (0 µg/mouse, i.c.v.) group (one-way ANOVA followed by post hoc test). Adapted from Ref. 17.
PPIとは,突然の音刺激に対する驚愕反応が,刺激の直前に小さな音刺激を差し挟むことにより,大幅に抑制される現象であり,20) PPI障害は運動出力の調節機構として知られる感覚運動制御機能の障害として解釈される.21) PPI測定には,50 ms, 120 dBの驚愕音負荷時のマウスの驚愕反応を,圧電型加速度センサーが100回分/1 kHzの圧振動データの平均値として算出した値を用いており,18)測定感度が高い実験系である.統合失調症患者はPPI障害を示し,21) AMPHやphencyclidineなどの幻覚発現薬をげっ歯類に投与してもPPI障害が観察され,いずれも抗精神病薬により改善されることから,22) PPIは統合失調症の病態生理研究の重要なツールとして提案されている.21)
マウス脳室内にp-OHAを投与し,音響驚愕反応に対するPPI変化について検討したところ,p-OHAは驚愕度には影響を及ぼさずに用量依存的なPPIの減弱を示し(Fig. 3),18)そのp-OHA誘発性PPI障害は定型及び非定型抗精神病薬により有意に改善した(Table 2).10,18) p-OHA誘発性PPI障害に対するDA神経系作用薬を検討した結果,DA神経破壊薬及びD2, D4の各選択的受容体拮抗薬でPPI障害が改善したことから(Table 2),10,18) p-OHA誘発性PPI障害発現にはDA遊離とそれに基づくD2及びD4受容体の刺激を介することが示唆された.18)

The left panel (A) shows PPI expressed for each prepulse intensity level (73, 76, 79, 82 and 85 dB), and the right panel (B) shows PPI data expressed as an average across all prepulse intensities (Average.PPI). Data represent the means±S.E.M. for ten animals per group. * p<0.05, ** p<0.01 vs. Ringer’s only (i.c.v.) group (one-way ANOVA followed by post hoc test). Adapted from Ref. 18.
| Drug | Agent type | Attenuate/ineffective |
|---|---|---|
| Haloperidol | A typical antipsychotic | Attenuate |
| Clozapine | An atypical antipsychotic | Attenuate |
| SCH23390 | A selective D1 antagonist | Ineffective |
| L-741626 | A selective D2 antagonist | Attenuate |
| Eticlopride | A D2/D3 antagonist | Ineffective |
| L-745870 | A selective D4 antagonist | Attenuate |
| 6-Hydroxydopamine | A neurotoxin for DA neurons | Attenuate |
| GBR12909 | A DA-reuptake inhibitor | Ineffective |
| Ketanserin | A 5-HT2A/2C antagonist | Attenuate |
| MDL100907 | A selective 5-HT2A antagonist | Attenuate |
| 5,7-Dihydroxytryptamine | A neurotoxin for 5-HT neurons | Attenuate |
| p-Chlorophenylalanine | A 5-HT synthesis inhibitor | Attenuate |
p-OHA誘発性HTR発現に中枢5-HT神経系が関与することが明らかにされており,16) p-OHA誘発性PPI障害を改善させた定型及び非定型抗精神病薬は5-HT2A受容体に親和性を持つことから,23) p-OHA誘発性PPI障害に対する5-HT神経系作用薬の効果を検討したところ,5-HT2A/2C受容体拮抗薬及び選択的5-HT2A受容体拮抗薬で改善し,5-HT神経破壊薬や5-HT合成阻害薬でもPPI障害が軽減されたことから(Table 2),10,19) p-OHA誘発性PPI障害には5-HT遊離促進を介した5-HT2A受容体の刺激も関与することが示唆された.19)
本研究で得られた結果から予想されるDA神経終末におけるp-OHAの作用機序をFig. 4に示した.10)投与されたp-OHAはDAトランスポーターを介してDA神経終末に取り込まれ,シナプス小胞に貯蔵されているDAを細胞質に排出させる.また,p-OHAがMAO活性を阻害する作用なども知られており,24)それらの作用により,結果として細胞外DA濃度を上昇させ,D2及びD4受容体を介して自発運動量増加やPPI障害を起こすと予想される.p-OHAは5-HT神経に対しても,同様の作用機序によりPPI障害やHTRを起こすことが予想される.今後,前駆体としてのMETHやp-OHA投与後のマウス脳各部位におけるモノアミン神経伝達物質の変化を調べるなど,p-OHAの薬理学的特徴を更に検討し,覚醒剤精神病,精神依存や統合失調症の病因究明に役立てたいと考えている.

Bold texts and arrows indicate proposed mechanisms of p-OHA action.
本研究で得られた結果より,AMPHやMETHの代謝物であるp-OHAをげっ歯類の脳内投与によって,自発運動量増加及びPPI障害が誘発され,中枢DA神経系が関与することが明らかとなった.また,いずれの行動異常もp-OHAによるプレシナプス側からのDA遊離によって起こり,特にp-OHA誘発性自発運動量増加に係わる脳部位には側坐核が重要であることが示唆された.p-OHA誘発性PPI障害発現には中枢DA神経系及び5-HT神経系機能の亢進が関与することが示唆された.
本研究を遂行するにあたり,終始ご指導とご鞭撻を賜りました,東北医科薬科大学の故・只野 武名誉教授,東北医科薬科大学薬学部薬理学教室の丹野孝一教授,中川西修准教授,高崎健康福祉大学薬学部の三反崎聖講師に厚く御礼申し上げます.本研究の一部はJSPS科研費・若手研究(B)(20790309),基盤研究(C)(22600010)及び文部科学省の私立大学マッチングファンド補助金により実施されたものであり,併せて御礼申し上げます.
開示すべき利益相反はない.
本総説は,2022年度日本薬学会東北支部奨励賞の受賞を記念して記述したものである.