2023 Volume 143 Issue 11 Pages 931-940
2023 Volume 143 Issue 11 Pages 931-940
The purpose of this narrative review was to clarify the current status and issues of scientific evidence for functionality in the Foods with Function Claims system based on previous research. From the introduction of the system in April 2015 to January 1, 2023, there were 6606 notifications, of which 6297 (95.3) were systematic reviews (SRs) and 309 (4.7%) were clinical trials (CTs). SRs were identified the following problems: i) inadequate description based on the first version of PRISMA checklist, and ii) very low levels of quality assessment in the first version of AMSTAR checklist and AMSTAR 2. CT was reported to have the following problems: i) inconsistencies between the protocol and the content in the paper (non-compliance), ii) high risk of bias, and iii) not described based on the CONSORT 2010 checklist. Since SRs and randomized controlled trials (RCTs) often have low-quality notifications, it is necessary to correctly communicate this information to consumers in order to make appropriate purchasing decisions.
2013年6月21日に「食品表示法」が成立し,第2章(第4条・第5条)に基づく「食品表示基準」の施行によって従来は任意であった食品の栄養表示が原則として義務となった.また,同年6月14日に閣議決定された「日本再興戦略—JAPAN is BACK」では「食の有する健康増進機能の活用」として「規制改革実施計画」では,「いわゆる健康食品を始めとする保健機能を有する成分を含む加工食品及び農林水産物の機能性表示の容認」として,食品の3次機能(体調調節機能)に係わる新たな機能性表示制度の創設が組み入れられた.さらに,2014年7月30日に消費者庁依頼の有識者で議論されてきた「食品の新たな機能性表示制度に関する検討会報告書」が公表された.このようなプロセスを経て2015年4月1日に「機能性表示食品(Foods with Function Claims: FFC)」制度(本制度)が開始された(Fig. 1).
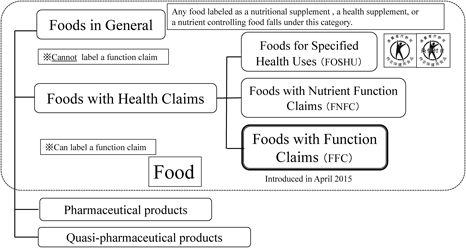
The new system (FFC) allows labelling which indicates that the food is expected to have a specific effect on health, except for reducing risk of diseases, through the process of submission to the Secretary-General of the Consumer Affairs Agency in Japan.
本制度は,食品関連事業者(食品表示法 第2条第3項第1号)の責任において,特定の保健の目的が期待できる旨の表示を行うことができるものである.機能性の表示においては,特定保健用食品(トクホ製品)と栄養機能食品(ビタミン,ミネラルなど)だけが可能だったが,本制度により機能性を表示できる商品が増えて,消費者が正しい情報を得たうえで選択できることが期待された.
本制度の大きな特徴は,「修正や撤回も含めて届出情報が消費者庁HPに公開される」という透明性の高さである.生鮮食品も含めたすべての食品(アルコールなど一部を除く)で,疾病に罹患していない成人(妊産婦及び授乳婦を除く)を対象としている.届出者は,少なくとも販売開始の60日前に,安全性・機能性・健康被害の情報収集体制などの必須情報を消費者庁長官に提出しなければならない.また,本制度は特定保健用食品と異なり,国は安全性や機能性を審査しない.あくまで,届出者(企業)責任においての表示,すなわち届出制であるという点も特徴的である.
本制度は2023年4月で9年目に入り,同年4月1日時点で,届出数の総計は6606件,そのうち機能性の科学的根拠資料として,研究レビューが6297件(95.3%),臨床試験(clinical trial: CT)が309件(4.7%)と膨大な届出件数となっている.この研究レビューだが,「機能性表示食品の届出等に関するガイドライン」1)にて,2009年に公表された初版のPRISMAチェックリスト2)に準拠するように求めていることから,事実上,システマティック・レビュー(systematic review: SR)を意味しているので以後はSRと称して論を進める.
一方,本制度は届出制であるため,ビジネスモード・販売促進が最優先となり,機能性があるとはいえない商品も販売されてしまうのではないか,すなわちエビデンスとして提出する資料の質に関して,消費者団体やマスコミ,アカデミア研究者などからその信憑性が疑問視されていた.
本制度の強みでもある届出された情報が誰でも閲覧できることから,SRとCTともにアカデミア研究者が評価することも可能であり,実際にいくつかの研究も行われている.また,消費者庁もSRとCTに関して独自の検証事業を行っている.
そこで本論は,本制度における機能性の科学的根拠(エビデンス)の現状と課題を先行研究に基づきまとめることを目的とした.それぞれの先行研究(調査報告)だが,SRとCTともに「報告の質」(記載内容の質)と「研究の質」(研究方法論として質のこと)との大きく2種類があり,相互関係はあるものの別なアウトカムであるので区別して論を展開することとする.
2016年7月7日に消費者庁から「機能性表示食品制度における機能性に関する科学的根拠の検証:届け出られた研究レビューの検証事業報告書」3)が公表された.SRの報告方法を中心として,その問題点や改善すべき事項が明確にされた.本制度開始直後の2015年4月1日から10月31日までの7ヵ月間に登録されたすべてのSR(51編)を対象としてPRISMAチェックリストを更に再分割・本制度のSRに適応させた「PRISMAチェックリスト:機能性表示食品のための拡張版(PRISMA機能性表示食品のための拡張版)」に基づき,記述の有無や不備のある点をチェック項目毎に示したものであった(Table 1, left side).
| Item number | Evaluation points based on the “PRISMA Checklist: Extended Version for SR of the Foods with Function Claims” | Verification project by the Consumer Affairs Agency in 2016 SR (N=51) | Kamioka et al.’s study in 2019 SR (N=104) | p Value | ||||
|---|---|---|---|---|---|---|---|---|
| Deficiency | Deficiency | |||||||
| N | % | Labela | N | % | Labela | |||
| #1 | Title | 0 | 0 | A | 1 | 1.0 | A | 1.00 |
| #2 | Structured summary | 33 | 64.7 | D | 98 | 94.2 | D | <0.01 |
| #3 | Rationale | 25 | 49.0 | C | 73 | 70.2 | D | 0.01 |
| #4a | Description related to participants | 6 | 11.8 | A | 29 | 27.9 | B | 0.02 |
| #4b | Description related to interventions | 6 | 11.8 | A | 19 | 18.3 | A | 0.36 |
| #4c | Description related to comparisons | 8 | 15.7 | A | 21 | 20.2 | B | 0.66 |
| #4d | Description related to outcomes | 6 | 11.8 | A | 33 | 31.7 | B | <0.01 |
| #5a | Presence or absence of a review/protocol | 26 | 51.0 | C | 40 | 38.5 | B | 0.14 |
| #5b | Accessibility to a protocol or not | 49 | 96.1 | D | 100 | 96.2 | D | 1.00 |
| #5c | Presence or absence of web address and registration number of a protocol | 49 | 96.1 | D | 102 | 98.1 | D | 0.60 |
| #6a | Description related to study characteristics | 17 | 33.3 | B | 56 | 53.8 | C | 0.02 |
| #6b | Description related to report characteristics | 22 | 43.1 | C | 46 | 44.2 | C | 0.90 |
| #7 | Information sources | 22 | 43.1 | C | 60 | 57.7 | C | 0.09 |
| #8 | Search | 8 | 15.7 | A | 13 | 12.5 | A | 0.62 |
| #9a | Description of screening method | 21 | 41.2 | C | 43 | 41.3 | C | 0.98 |
| #9b | Description of eligibility | 12 | 23.5 | B | 29 | 27.9 | B | 0.56 |
| #9c | Description of criteria for selection | 17 | 33.3 | B | 29 | 27.9 | B | 0.49 |
| #10 | Data collection process | 24 | 47.1 | C | 61 | 58.7 | C | 0.17 |
| #11 | Data items | 13 | 25.5 | B | 18 | 17.3 | A | 0.23 |
| #12a | Bias risks | 29 | 56.9 | C | 83 | 79.8 | D | <0.01 |
| #12b | Indirectness | 26 | 51.0 | C | 83 | 79.8 | D | <0.01 |
| #12c | Imprecision | 16 | 31.4 | B | 84 | 80.8 | D | <0.01 |
| #12d | Inconsistency | 22 | 43.1 | C | 85 | 81.7 | D | <0.01 |
| #13 | Summary measures | 16 | 31.4 | B | 30 | 28.8 | B | 0.75 |
| #14a | Description of method for synthesis of resultsb | 4 | 44.4 | C | 0 | 0.0 | A | 0.02 |
| #14b | Description of measures of consistencyb | 2 | 22.2 | B | 1 | 7.7 | A | 0.54 |
| #15a | Search for clinical trial registration | 40 | 78.4 | D | 72 | 69.2 | D | 0.23 |
| #15b | Inquiry to authors | 47 | 92.2 | D | 92 | 88.5 | D | 0.58 |
| #15c | (for post meta-analysis) Funnel plotb | 1 | 11.1 | A | 1 | 7.7 | A | 0.55 |
| #15d | Description of selective report within studies and others | 24 | 47.1 | C | 86 | 82.7 | D | <0.01 |
| #16 | Additional analysesb | 3 | 33.3 | B | 2 | 15.4 | A | 0.61 |
| #17 | Study selection | 1 | 2.0 | A | 5 | 4.8 | A | 0.66 |
| #18 | Study characteristics | 10 | 19.6 | A | 39 | 37.5 | B | 0.02 |
| #19 | Risk of bias within studies | 14 | 27.5 | B | 15 | 14.4 | A | 0.08 |
| #20a | Description of simple summary data on each intervention group | 24 | 47.1 | C | 26 | 25.0 | B | <0.01 |
| #20b | Forrest plotb | 2 | 22.2 | B | 1 | 7.7 | A | 0.54 |
| #21 | Synthesis of resultsb | 1 | 11.1 | A | 1 | 7.7 | A | 1.00 |
| #22 | Risk of bias across studies | 17 | 33.3 | B | 48 | 46.2 | C | 0.13 |
| #23 | Additional analysisb | 5 | 55.6 | C | 1 | 7.7 | A | 0.02 |
| #24 | Summary of evidence | 39 | 76.5 | D | 89 | 85.6 | D | 0.18 |
| #25a | Description of limitations at study and outcome levels | 33 | 64.7 | D | 70 | 67.3 | D | 0.75 |
| #25b | Description of limitations at review level | 30 | 58.8 | C | 49 | 47.1 | C | 0.17 |
| #26 | Conclusions | 39 | 76.5 | D | 86 | 82.7 | D | 0.39 |
| #27a | Source for funding of the SR and other support | 15 | 29.4 | B | 54 | 51.9 | C | <0.01 |
| #27b | Role of funders for the SR | 12 | 23.5 | B | 55 | 52.9 | C | <0.01 |
a Deficiency (%) A: 0–19.9%, B: 20–39.9%, C: 40–59.9, D: 60–100%. b Adapted to cases with meta-analysis. χ2 test or Fisher’s exact test for each item. Permission to reproduce from the following article “Jpn. Pharmacol. Ther., 47, 357–373 (2019)” in Life Sciene Publishing Co., Ltd.
45項目それぞれについて「不履行・記述なし」と「不十分又は不明瞭な記載」を「不備」とし,不備率のラベリングとして「A: 0から20%未満のSRで不備がある」,「B: 20%以上40%未満のSRで不備がある」,「C: 40%以上60%未満のSRで不備がある」,「D: 60%以上のSRで不備がある」とした.総じて不備の多いSRが多いことがわかる.とくにDと評価されたのが「構造化抄録の書き方」,「プロトコールへのアクセス」,「プロトコールの事前登録」,「臨床試験登録の探索」,「著者への問い合わせ」,「エビデンスの要約」,「研究レベルとアウトカムレベルの限界の記述」,「結論」であった.
不備に関しては,評価者にとって判定が難しい書きぶり,例えば,ある項目に関して「記載はあるものの,十分な情報とはいえない」とか「記載はあるが,焦点が合っていない」というようなSRが少なくないことが明らかにされた.報告書の中で,「不明瞭な記述は避け,必要な情報がすぐに把握できるSRでなければならない」と明記されている.更にこの報告書には付録として良好なSRづくりのために「PRISMA声明チェックリスト:機能性表示食品のための拡張版」に基づく適正な研究レビューの記述例が17ページにわたって示され,これに基づいて作成すれば確実に不備は少なくなり,良好なSRの報告がなされると期待された.本制度に興味関心のある企業をはじめ業界団体,SRの代行実施業者,アカデミア研究者などに食品としての適切なSR報告の方法が周知されたと考えられた.
Kamiokaらは,前述の検証事業実施後にSRの報告の質が向上したかどうかを全く同じツール「PRISMAチェックリスト:機能性表示食品のための拡張版」を用いて検証事業実施前後の比較研究を行った4)(Fig. 2).これは検証事業と同じく期間7ヵ月として2017年7月1日から2018年1月31日までに掲載されたすべてのSR104編(重複したSRは除外)を対象とし,「検証事業後SR」とした.その前後比較もTable 1は示している.表の右側が検証事業後SRである.有意確率は前後比較の検定で有意に向上したか悪化したかの判断指標となる.

Comparison in the PRISMA between A and B. Comparison in the AMSTAR between X and Y.
「#2 構造化抄録」において,背景・目的・検索で用いたデータ源・研究の適格基準・participant, intervention, comparison, and outcome (PICO)・研究の評価と統合法・結果・限界・結論重要な知見の意味合い・SRの登録番号を含めることが求められているが,ラベリングはDであり,検証事業後の方が不備率が有意に増加していた.
このように個々のチェック項目をみていくと,依然としてラベリングがCやDのものが多く,むしろ不備率が高まっていた.すなわち,報告の質の低いSRが多く,消費者庁の検証事業報告によって改善がなされているとはいえないという結果となっていた.
この理由を把握することが課題解決に向けて最も重要である.ガイドラインの記載内容が少し難しいという指摘もなされるかもしれない.しかし,報告書を読んでいない,理解できていないままでSR作成に着手していることが主たる原因だと考えられる.更に推測の域を出ないが,本制度の発足当初は食品業界の大企業の届出が中心である一定レベルのCTに関する知見があり,まずまずのSRであったが,以後2016年から2018年にかけて爆発的な数の届出が行われ,質の低いSRを模倣したり,使い回したSRが公開されていた可能性が否定できない.つまり質の低いSRをお手本にして,新しいSRがつくられているということが考えられる.
2-2. SRの研究の質SRの研究の質について,Fig. 2に示すように検証事業前後における比較研究のデザインでの研究5,6)がなされた.「SRの研究自体の質」を評価するツールに関しては,2007年に公表された初版のAMSTARチェックリスト7)を用いた.「#1 デザインは“あらかじめ”提示されたか?」,「#2 研究の選択とデータの抽出は複数で行われたか?」,「#3 包括的な文献検索がなされたか?」,「#4 出版形態(灰色文献など)組入れ基準に用いられたか?」,「#5 (組入れられた及び除外された)研究リストは提示されたか?」,「#6 組入れられた研究の特性は提示されたか?」,「#7 組入れられた研究の科学的な質は評価され,記録されていたか?」,「#8 組入れられた研究の科学的な質は,結論を導く際に適正に利用されたか?」,「#9 研究結果を併合するのに用いられた方法は適正だったか?」,「#10 出版バイアスの可能性は評価されたか?」,「#11 利益相反は明示されたか?」の11項目で構成され,良好であれば各項目1点ずつで合計11点満点にて評価する.
その結果,Fig. 3に示したように合計得点において検証事業前SRでは6.2±1.8(平均±標準偏差)点で,検証事業後SRでは5.0±1.9点で研究の質が有意に低下していた.PRISMAチェックリストと同様な傾向を示していた(個々の項目の結果は割愛).項目によって重要度は異なるものの,5点という極めて質の低いSRが多いことが明らかになった.これらのことは,「研究の質も報告の質も改善しておらず,質の低いSRが多く届出されている」ことを示している.

The higher the score, the higher the quality of the study. The quality of the verification project decreased significantly after the implementation of the verification project. Permission to reproduce from the following article “Kamioka H. et al., Nutrients, 11, 1583 (2019)” in MDPI.
さらに,筆者らは「日本の機能性表示食品において届出されたSRについての横断研究:AMSTAR 28,9)による質評価」という研究を実施した.10)これは,最新の届出されたSRの研究の質について,2017年にアップデートされたAMSTAR 2を用いて評価し,SRの不適切な方法となっているその特徴を明らかにすることを目的とした.2022年4月1日から2022年10月31日までに消費者庁HPに公表された記号番号HシリーズのSRで,具体的にはH1–H535の届出でSRの届出撤回を取り除いた519編のうち,ランダム抽出した40編のSRを評価した.このシリーズは2015年度に届出されたものがAシリーズで,以後,年度毎にアルファベット順になっている.2022年度なので8番目のアルファベットでHとなっている.
その結果,36編(90%)が定性的なレビューで,4編(10%)がメタアナリシスを実施したレビューであった(Fig. 4).全体の信頼性評価では,「高(High)」が0編(0%),「中(Moderate)」が0編(0%),「低(Low)」が2編(5%),「Critically low」が38編(95%)であった.とくに信頼性を下げていたのは,「プロトコールの事前登録の欠如」,「包括的な検索戦略の不備」,「RoB評価の結果を考察や結論に適切に反映していない」ことであった.このように2022年代という最近のSRにおいても質の向上がみられないことが明らかになっている.

The overall confidence ratings assigned to the 40 articles were “High” (N=0, 0%), “Moderate” (N=0, 0%), “Low” (N=2, 5%), and “Critically low” (N=38, 95%). The mean AMSTAR 2 percentage score was 51.1% (standard deviation: S.D. 12.1%) with a wide range of 19% to 73%. Among the 40 SRs, the number of critical domain deficiencies was four in 7.5% of the systematic reviews (SRs), three in 52.5% of SRs, two in 35% of SRs, and one in 5% of SRs. Permission to reproduce from the following article “Kamioka H. et al., Nutrients, 15, 2047 (2023)” in MDPI.
Tanemuraらは2018年に,届出されたCTに対してCONSORT 2010チェックリスト11,12)に基づいての記載がなされているかを調べた.13)ガイドラインにおいて,このチェックリストに準拠して報告することが示されているが,対象とした33編のランダム化比較試験(randomized controlled trial: RCT)において,29のチェック項目で適合していたのは,平均で13.8項目(47.6%)だったことを報告している.前述したSRと同じくチェック項目における要求内容をよく理解していないことが考えられる.CONSORT 2010における要求項目は必要最低限の情報なので,この記載がなければ当該CTの結果を解釈するのは困難である.
ただし,これも2019年以降の新しいCTについての評価はまだなされていないという時間的制限がある.
3-1-2. 一般記載事項の特徴2017年に消費者庁によるCTに関する検証・調査事業が行われ,34編の論文を対象として全33項目での評価がなされた.12)ガイドラインには,「臨床試験の実施方法(参加者の設定に係る考え方は除く.)は原則として,「特定保健用食品の表示許可などについて(平成26年10月30日付 消食表第259号)」の別添2「特定保健用食品申請に係る申請書作成上の留意事項」に示された特定保健用食品(トクホ)の試験方法に準拠することとする.」とされている.そのため,CTとして研究計画・実施・記述の適正性,試験方法がトクホに求められている方法に合致しているか,conflict of interest(COI)等,総合的に論文を解釈するために必要な記載事項が明記されているかを評価し,課題点を明らかにすることを目的に実施された.
特にCTとして重要な項目での不備があったもの(60%以上として)を列挙する.サンプルサイズの記載がなかった論文が30編(88.2%),ランダム化の記載がない論文(RCT28編中で)が22編(78.6%),ブラインディング(比較対照群のある32編中において)で誰に対してなのかの記載がない論文が24編(75.0%),主要アウトカムの明記がなされていない論文が25編(73.5%),アウトカム項目における検定の多重性(多重性を考慮していない)のある論文が29編(85.3%),クロスオーバー試験の場合(10編中)に持ち越し効果に関する記載のない論文が6編(60.0%),著者のCOIに関する記載がない論文が26編(76.5%)となっていた.このようにCTとして信頼性に深刻なダメージを与える論文が多いことがこの検証事業により明らかにされた.
報告書のまとめでは,CTの研究計画,すなわちプロトコールのための「SPIRIT 2013」15,16)やCONSORT 2010と重複する項目もあるとしたうえで,とくに重要な事項を提示している.要約すると,「研究デザイン」,「参加者に関する情報の詳細」,「解析方法の詳細」,「ランダム化情報の詳細」,「ブラインディングの詳細」,「試験食品・プラセボの成分と識別不能性」,「背景因子の詳細情報」,「明確なアウトカム」,「検定方法」,「倫理面への配慮と事前登録」,「クロスオーバー試験の解析」,「利益相反に関する詳細」での適正で明確な記載が必要であるとしている.
3-2. CTの研究の質3-2-1. プロトコールのコンプライアンスCTでは,「出版バイアスの防止」,「倫理的義務」,「臨床試験参加者募集の促進」を主たる目的として臨床試験登録(clinical trial registration: CTR)が義務づけられている.Kamiokaらは,CTにおけるCTRの内容が論文の中で記載されている内容と一致しているかを明らかにするために,2018年6月1日から2021年6月30日までに公表された届出論文103編を対象とした研究を行った.17)
プロトコールにおいて,タイトルに介入内容(試験食名)が記載されていない論文が49編(48%),方法において試験食についての記載がない論文が87編(75%),比較対照が不明確な論文が89編(87%),主要アウトカムを明確にしていない論文が32編(31%),倫理審査委員会の記載がない論文が75編(73%)あった(Table 2).さらにはタイトルと方法ともに介入内容が記載されていない論文が44編(43%)あった.プロトコールを見てもどのようなCTかわからない論文が少なくないことが示された.しかし,論文中には試験食に関する詳細な情報の記載がなされていた.アカデミア研究者によるCTではなく,機能性が認められた場合にはその後に販売へとつなげるビジネスが主たるねらいであるために,競合他社に新商品がわからないようにする恣意性が推察される.更には当該関与成分における特許申請も控えている中で意図的に記載していない可能性もある.
| Name of clinical trial registration | |
|---|---|
| UMIN-CTR | 101 (98%) |
| ANZCTR | 1 (1%) |
| ClinicalTrials.gov | 1 (1%) |
| Protocol item (Number of articles with a good quality with percentage) | |
| Title | 54 (52%)a |
| Participant | 99 (96%) |
| Intervention | 16 (15%)a |
| Comparison | 14 (13%) |
| Outcome | 71 (69%) |
| Study design | 101 (98%) |
| Institutional Review Board | 28 (27%) |
| Quality score (pts)b | 3.7±1.1 [2–7] |
Value: n (%). a No. (%) of papers with insufficient description for both title and intervention: 44 (43%). b Mean±S.D. [range]. Permission to reproduce from the following article “Kamioka H. et al., Nutrients, 14, 81 (2021)” in MDPI.
更にはプロトコール中には多数のアウトカムがあり,どれが主要アウトカムなのかを示しておらず,有意だったものを後で主要アウトカムとするといった選択的アウトカムが生じている可能性もある.
ガイドラインにおける「(V)機能性に係る事項,第2 最終製品を用いた臨床試験(ヒト試験)の実施及び資料の届出,1 最終製品を用いた臨床試験(ヒト試験)の実施に当たっての留意事項,研究計画の事前登録」の中で,「国内で実施する臨床試験については,その計画についてUMIN臨床試験登録システムに事前登録が行われる必要がある.…〈中略〉特に,試験名,主要アウトカム評価項目,(設定する場合は)副次アウトカム評価項目,試験デザイン,介入,適格性,目標参加者数…〈中略〉…事前登録時の詳細な登録を必須とし,機能性の実証に係る項目(主要アウトカム項目,副次アウトカム評価項目,試験デザイン,介入,適格性等)に関しての事前登録後に実質的な変更を行った研究については,機能性表示食品の機能性に係る科学的根拠とすることはできない.」と明記されており,プロトコールの不明確な記載や重要な情報の欠如は深刻な問題である.
3-2-2. バイアスリスク最近,CTにおけるバイアスリスクの特徴を明らかにする研究がKamiokaらによって行われた.18)前述と同じ103編が対象で,Cochrane risk-of-bias toolの改変版11項目に更に3項目を追加した14項目で評価された.バイアススコアとして,各項目でバイアスがある場合には1点で,すべての項目であると14点となる.その結果,平均±標準偏差として5.7±2.5点,レンジが0–11点であった(Table 3).バイアスリスクの高い順として,intention-to-treatment(ITT)解析が84編(81.6%),試験食摂取のコンプライアンスが70編(68.0%),多重検定(アウトカム)が69編(67.0%),多重検定(時点)が54編(52.4%),介入者へのブラインディングが51編(49.5%),ドロップアウトの理由が50編(48.5%),主要アウトカムにおけるベースラインでの均衡性が48編(46.6%)などとなっていた.いずれにしても,CTではバイアスリスクが高い論文が多いことがわかる.ここでいうバイアスは「機能性あり」という方向への向きと大きさを持つことを意味するだろう.
| # | RoB item | Number of articles with each RoB item |
|---|---|---|
| n=103 | ||
| 1 | Was the method of randomization adequate? | 44 (42.7%) |
| 2 | Was the treatment allocation concealed? | 23 (22.3%) |
| 3 | Were the groups similar at baseline regarding the most important prognostic indicators? | 48 (46.6%) |
| 4 | Was the patient (participant) blinded to the intervention? | 17 (16.5%) |
| 5 | Was the care provider (intervener) blinded to the intervention? | 51 (49.5%) |
| 6 | Was the outcome assessor blinded to the intervention? | 46 (44.7%) |
| 7 | Were cointerventions avoided or similar? | 0 (0%) |
| 8 | Was the compliance acceptable in all groups? | 70 (68.0%) |
| 9 | Was the drop-out rate described and acceptable? | 50 (48.5%) |
| 10 | Did the analysis include an intention-to-treat analysis? | 84 (81.6%) |
| 11 | Was the timing of the outcome assessment similar in all groups? | 2 (1.9%) |
| 12 | Was the main outcome clear? | 34 (33.0%) |
| 13 | Was the problem of multiple tests (outcomes) avoided? | 69 (67.0%) |
| 14 | Was the problem of multiple tests (time points) avoided? | 54 (52.4%) |
| — | RoB score (pts)a | 5.7±2.5 [0–11] |
Value: n (%). Mean±S.D. [range]. a 0 pt indicates no bias in an article. and 14 pts indicates all biases present in an article. Permission to reproduce from the following article “Kamioka H. et al., J. Clin. Trials, 12, 1000503 (2022)” in Longdom Group SA.
SRとCTともに報告の質,研究の質において不備が多いことが明らかになった.SRについては,2021年に公表された報告方法に関してPRISMA 202019,20)に従う必要がある.ガイドラインも改正され,届出はこの新版に準拠するように求めており,この正しい理解をすることが大事である.とくにポイントになるのが,「エビデンス総体の確実性(certainty)・信頼性(reliability)の評価方法と結果を明記すること」である.どれだけ厳格に当該SRの信頼性を示せるかを問うものであり,これまで「機能性ありき」の論理展開をしてきた届出者においては厳しい選択(すなわち効果推定量の信頼性は低いと自ら書けるのか)に迫られるだろう.また,研究の質においては,AMSTAR 2の評価項目を意識してのプロトコールの設えが不可欠である.そして繰り返しになるが,事前登録がSRの信頼性を高める基盤であることを強調する.PRISMA-P21,22)というプロトコールのチェックリストも出ているのでそれも参照して詳細な記載が必要である.
CTにおいては,CONSORT 2010に完全準拠するとともに,極力バイアスを回避することを考慮し,試験食を隠すことなく正確で詳細なプロトコール作成が必要である.当然,CTのプロトコールでは,SIPRITの活用が不可欠である.
ところで,CTに関連する最新情報として,CONSORTグループが中心となってCONSORT 2010, SPIRITグループが中心となってプロトコールのガイドラインSPIRTの更新のための研究が進められている.近い将来,これらもアップデートされ本制度にも反映されることになるだろう.記載内容はより厳格化されることは間違いないため,更にCTに対する届出者への教育啓発が必要になると考えられる.
筆者らは,「社会経済とくに食品業界においては,本制度の利用により販売促進がなされ収益を高めることが成長戦略,規制緩和の実質的な果実となるだろう.一方,消費者側からすれば,安全なことは当然ながら,機能性が人で本当に存在するのか,効果はあるのか,が最も大切である.本制度はCTに加えてSRというエビデンス・グレーディングが最上位の研究デザインを採用している.結論はより真実を示す可能性が高いともいわれる研究デザインである.アカデミア研究者によるSRも営利目的の組織団体企業等におけるSRも違いはなく,実施者はその機能性をバイアスなく適正に伝える義務がある」23)と述べている.2025年で本制度発足10年の節目を迎えるにあたり,質の高いSRとCTが届出されることを期待したい.
SRとCTの報告と研究の質を示してきたように,機能性のエビデンスにおいては注意を要する届出が多い.SRやCTの内容やその解釈は一般消費者には理解し難いことも事実である.アカデミア研究者や担当当局,また関連する行政機関などが連携しながら,購入における適切な意思決定のために,こうした情報を消費者に正しく伝える必要があると考える.それには,更に届出内容を平易な内容や図表で示すとともに,科学的な解釈の仕方を研究者と消費者の中間の立場で指導する役割の人が必要かもしれない.
本論文の基礎となる個々の研究においては,研究グループ名「FFC-SR2」のメンバーである津谷喜一郎氏,折笠秀樹氏,大室弘美氏,島田美樹子氏,北湯口純氏,和田安代氏,吉﨑貴大氏,眞喜志まり氏,佐山暁子氏の多大なご協力を頂きました.また,日本薬学会第143年会において機能性表示食品をシンポジウムテーマとして開催の中でオーガナイザーの山本美智子氏と大室弘美氏,そして山本健氏にもご支援を頂きました.ここに深謝致します.また,膨大な届出資料・データの収集・整理等を行って頂いた研究アシスタントの石田美千子氏に感謝の意を表します.
本論の資金源は,2021–2023年度日本学術振興会科学研究費基盤C(課題番号21K11604):研究題目「機能性表示食品における臨床試験とシステマティック・レビューの内的妥当性評価研究」代表研究者:上岡洋晴)」であった.主宰者は上岡洋晴である.
筆者は,ファンケル株式会社,カゴメ株式会社,森下仁丹株式会社,サントリー・ウエルネス株式会社,丸善製薬株式会社におけるSRの論文指導を行い,謝金を得た.