2023 年 143 巻 12 号 p. 1039-1046
2023 年 143 巻 12 号 p. 1039-1046
Selenium is an essential trace element and its deficiency causes myositis, myocardial damage, and other symptoms. Patients receiving long-term intravenous nutrition or tube-feeding in particular are deficient in essential trace elements, including selenium, and require regular supplementation. In Japan, injectable selenium-containing products are listed on the National Health Insurance drug price list, and oral solutions are prepared and used in hospitals. However, these formulations have problems related to preservation and require complicated administration procedures. In this study, we developed a new fast-disintegrating tablet formulation of selenium, using SmartEx® (D-mannitol·low substituted hydroxypropylcellulose (L-HPC)·fully hydrolyzed polyvinyl alcohol (PVA) mixture) as a coprocessing additive, that can be administered orally or by feeding tube. The tablet formulation had excellent disintegrable capability, sufficient hardness, and did not cause tube blockage when administered in the simple suspension method. In addition, the tablet formulation showed no changes in properties in an accelerated test without packaging for 42 d, indicating that it could be stored for a long period. Fast-disintegrating tablets prepared with SmartEx® are expected to improve the adherence and quality of life of patients who require selenium supplementation.
セレンは必須微量元素の一つであり,生体内では抗酸化作用1,2)や甲状腺ホルモンの代謝3)などに関与し,正常な生理機能を保つために重要な役割を果たしている.これらが不足しセレン欠乏症となると爪の異常や毛髪の異常,4)赤血球の大球性変化,5)発育遅延,6)筋炎7)が生じ,重篤な場合は不整脈や頻脈といった心筋障害を引き起こすことが報告されている.8)特に,クローン病等の炎症性腸炎,短腸症候群,重症心身障害などの原疾患により長期の静脈栄養や経管栄養を行っている患者ではセレンを含む微量元素が不足することが多く,9,10)定期的な補充が必要になる.セレン欠乏症を予防するにはセレンを含む経腸栄養剤を用いた栄養療法を実施することが望ましい.しかし,重症心身障害,炎症性腸炎等の疾患では,その病態に応じて適当な栄養剤を選択して治療を行うが,11,12)これらの栄養剤にはセレンが十分に含まれていないことがあるため,別途でセレンの補充が必要になる.13)それ以外の疾患でも,経腸栄養に伴う消化器症状等の副作用のため経腸栄養剤を必要量摂取できないなどの理由により,セレンを単独で投与する場合もある.
現在,わが国ではセレンを単独で含む製剤として,注射剤が薬価収載されており使用されているが,注射剤は在宅医療等の現場において,患者自身や介護者による使用が困難であることが推察される.また,このような観点から,院内製剤として経口液剤が調製されているが,14)院内製剤で調製する経口液剤では,防腐剤の添加や,安定性の検討が十分されていない可能性があるため,薬液の汚染等の懸念があり,長期保存が難しいなどの問題がある.15)セレン製剤は,長期にわたり栄養療法を続ける患者に継続的に使用することが想定されるため,長期保存が可能である利便性の高い剤形が求められる.
本研究では,このような問題を解決する剤形として経口及び経管投与可能で長期保存が可能な速崩錠を調製することを試みた.そこで,コプロセス型添加物に着目し,複数ある添加剤のうち,過去の報告から硬度・摩損度が十分であり,崩壊性に優れていたSmartEx®[D(−)-マンニトール・低置換度ヒドロキシプロピルセルロース・ポリビニルアルコール(完全けん化物)造粒物(D-mannitol·low substituted hydroxypropylcellulose(L-HPC)·fully hydrolyzed polyvinyl alcohol(PVA)mixture)]を用いて,院内製剤として簡便に調製可能なセレン速崩錠の開発を行った.
主薬として亜セレン酸ナトリウム(富士フイルム和光純薬,大阪)を使用した.賦形剤として,D(−)-マンニトール(富士フイルム和光純薬),スクロース(富士フイルム和光純薬),SmartEx®50, SmartEx®100(信越化学工業,東京)をそれぞれ使用した.また,滑沢剤としてステアリン酸マグネシウム(富士フイルム和光純薬),二酸化ケイ素(富士フイルム和光純薬)を使用した.作製のために使用した添加剤は,「医薬品添加物規格2018」の収載品,また,その他試薬は,特級品を使用した.
2. セレン速崩錠及び内用液剤の調製方法2-1. 速崩錠亜セレン酸ナトリウム657 mg(セレンとして300 mg)をとり,精製水20 mLに溶解し,そのうち2 mLをD(−)-マンニトール10 gに混合し,乾熱乾燥機(MOV-212F,三洋電機,大阪)を用いて60°C条件下で12時間乾燥してセレン散(0.3%)を調製した.その後,Table 1に示す錠剤の基本処方に従い,セレン含有量が1錠あたり30 µgになる重量200 mg,直径8 mmの平板錠を,直接打錠法により油圧プレス(PCH-20,NPaシステム)を用いて,打錠圧7 kN,20 sで圧縮することで調製した.16)
| Material (mg/tablet) | Rp.1 | Rp.2 | Rp.3 | Rp.4 |
|---|---|---|---|---|
| SmartEx® 50 | 187 | 0 | 0 | 0 |
| SmartEx® 100 | 0 | 187 | 0 | 0 |
| D(−)-mannitol | 0 | 0 | 187 | 0 |
| Sucrose | 0 | 0 | 0 | 187 |
| Selenium scattering (0.3%) | 10 | 10 | 10 | 10 |
| Silicon dioxide | 2 | 2 | 2 | 2 |
| Magnesium stearate | 1 | 1 | 1 | 1 |
| Total | 200 | |||
亜セレン酸ナトリウム219 mg(セレンとして100 mg)を秤量して精製水で溶解し,全量500 mL(セレン含有量200 µg/mL)に調製した.さらに調製した溶解液を,セレン含有量10 µg/mLになるように精製水で希釈し,高圧蒸気滅菌処理(120°C,20分)を行った.
3. 硬度試験錠剤の性状として重さは,電子天秤TE214S(Sartorius,東京)を用いて測定した.錠剤の直径,厚みは,デジマチッククインジケータ(ミツトヨ,川崎)を用いて測定した.
錠剤の硬度の測定は,ロードセル式錠剤硬度計ポータブルチェッカー(PC-30,岡田精工,東京)を用いて測定した.各製剤はロット毎に6回測定し,その平均値を算出してデータとし,各製剤は3ロットずつ試験を行った.
4. 摩損度試験第18改正日本薬局方の崩壊試験法に従い,17)錠剤摩損度試験器(萱垣医理科工業,東京)を用いて実施した.各製剤とも質量6.5 gに相当する錠剤(33錠)を試験試料とし,ドラムを25 rpmで100回転させた後に,摩損度(初期質量に対する質量百分率)を算出した.
5. 崩壊試験5-1. 崩壊時間の測定第18改正日本薬局方の崩壊試験法に従い,17)崩壊試験器(富山産業,大阪)を用いて,崩壊時間を測定した.測定条件は,37±1°Cの精製水を試験器をビーカー内に入れ,試験器を1分間に33往復,振幅55 mmで滑らかに上下運動するように調節した.各製剤は,6回測定し,その平均値を算出してデータとし,各製剤は3ロットずつ試験を行った.
5-2. 口腔内崩壊時間の測定口腔内崩壊試験器ODT-101(富山産業)を用いて,崩壊時間を測定した.測定条件は,試験液に37±1°Cの精製水を用い,おもりは15 gとし回転数は25 rpmとした.18)各製剤は,6回測定し,その平均値を算出してデータとし,各製剤は3ロットずつ試験を行った.
6. 経鼻経管チューブ通過試験過去に報告されている方法を参考に実施した.18)セレン錠30 µgを2錠とり,精製水15 mL(55°C)に投入し,10分間放置した後スパーテルで20回撹拌した.懸濁液を5 Fr規格のジェイフィード栄養カテーテル®120 cm(JMS,広島)に通過させ,更に精製水15 mL(55°C)を追加で通過させた液を回収した.18)その後,孔径0.45 µmのメンブランフィルターでろ過したものを測定試料とした.測定試料は吸光光度法を用いて,通過前後の含量の変動割合(%)を確認した.
7. セレン含量の定量セレン速崩錠を精製水4.8 mLで懸濁し,マイクロ冷却遠心機1700(久保田,東京)を用いて遠心分離(5000 rpm,1分間)を行った後,懸濁液の上清を回収し,検体試料とした.この検体試料200 µLに2.5 Mギ酸8 µLと18.5 mM O-フェニレンジアミン水溶液8 µLを混合し,室温で反応させた後,333 nmにおける吸光度を分光光度計を用いて測定した.19)またベースライン補正のためのブランクの測定には精製水を試料として用いた.
8. 含量均一性試験当該試験は,錠剤の割れ・欠けが生じ難いとされる指標として錠剤硬度(N)/質量(mg)が0.30以上であり,20)摩損度試験の結果が第18改正日本薬局方の基準に適合したうえで,17)他の製剤と比較して崩壊試験機及び口腔内崩壊試験器を用いて測定した崩壊時間が有意に短く,崩壊性に優れていたRp.1の製剤を用いて行った.当院で調製した錠剤から,無作為に10個を選び,各々のセレン含有量を測定し,その後,第18改正日本薬局方収載の含量均一性試験判定式Eq.(1)に基づき,21)日本薬局方収載の判定係数と製剤中の主薬含有量の標準偏差により判定値を算出し,判定値が15.0%を超えないときに適合とした.
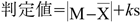 | (1) |
当該試験は特に崩壊性に優れていた製剤を用いて行った.卓上型恒温恒湿槽NST-80(ナガノサイエンス,大阪)内で,温度40.0±2.0°C,湿度75±5%RHの条件で保管し,その後,各種製剤試験(硬度試験,崩壊試験,セレン含量の定量)を実施した.保管期間は14日間,42日間とした.
10. 臨床試験当該試験は特に崩壊性に優れていた製剤を用いて行った.本研究におけるセレン速崩錠投与時の血中セレン濃度に関する評価は後方視的に実施し,対象患者は高知大学医学部附属病院において2018年1月–2022年7月の期間に,セレン内用液を1年以上連日服用してから,同じ用量のセレン速崩錠に服用薬剤を切り替えた重症心身症患者とした.当該患者について,年齢,性別,身長,体重,body mass index(BMI),原疾患,血中セレン濃度,栄養療法に関する情報を電子カルテより後方視的に抽出した.切り替え前の血中濃度は内用液から速崩錠に切り替えた日,切り替え後の血中濃度は速崩錠に切り替えた日から2ヵ月後の血中セレン濃度を用いて比較した.
セレン速崩錠の投与は,高知大学医学部附属病院医療安全管理部における未承認・適応外の医薬品及び医療機器を用いた医療として承認を受けたうえで実施し(承認番号I-15-005),投与に当たって,患者の家族に対して投与目的等を十分に説明し,同意書を得たうえで行っている.本研究については高知大学医学部倫理委員会の承認を得ている(承認番号2022-98).
11. 統計方法複数群からなるデータについて一元配置分散分析を行った後に,Tukeyの多重比較検定により統計処理を行った.また,セレン内用液から速崩錠に服用薬剤を切り替えた際の血中セレン濃度は,対応のあるt検定を用いて評価した.本研究における,すべての検討についてp<0.05を有意水準とした.
Table 2に各製剤毎の錠剤の性状の結果を示す.硬度は,各製剤で有意な差を認め,中でもRp.1のSmartEx®50を主な賦形剤とする製剤及びRp.2のSmartEx®100を主な賦形剤とする製剤がそれぞれ68.8±9.3 N, 69.2±6.1 Nであり,他の処方と比べて有意に硬度が高かった.摩損度に関して,第18改正日本薬局方において1%以下であることが望ましいとされている.Rp.1及びRp.2の摩損度はそれぞれ0.36±0.1%,0.30±0.1%であり,他の処方と比べて有意に低く,これらの製剤は日本薬局方の基準に適合していた.崩壊試験機を用いて測定した崩壊時間はRp.1の製剤において25±1 sであり,他の製剤と比べて有意に短かった.口腔内崩壊試験機を用いて測定した崩壊時間もRp.1の製剤において26±1 sであり,他の製剤に比べて有意に短かった.この結果から,特に崩壊性に優れていたRp.1の製剤を用いて含量均一性試験,加速試験及び臨床試験を実施した.
| Main excipient | Hardness (N) | Friction loss ratio (%) | Decay time (s) | Oral disintegration time (s) | |
|---|---|---|---|---|---|
| Rp.1 | SmartEx® 50 | 68.8±9.3 | 0.36±0.1 | 25±1 | 26±1 |
| Rp.2 | SmartEx® 100 | 69.2±6.1 | 0.30±0.1 | 31±1** | 32±2** |
| Rp.3 | D(−)-mannitol | 19.6±1.3** | 4.4±1.8** | 240±3** | 520±49** |
| Rp.4 | Sucrose | 39.8±3.1** | 1.01±0.3** | 559±35** | 633±95** |
Values are expressed as mean±S.D. (3 Lot, n=3). ** p<0.01 vs. Rp.1, evaluated using the one-way ANOVA followed by Tukey’s test.
各製剤のチューブ通過試験の結果をFig. 1に示す.すべての製剤においても,経管チューブの通過液のセレン含量の有意な低下はみられなかった.また,試験中におけるチューブの閉塞も確認されなかった.
Percentage change (%) in selenium content before and after passage of a selenium tablet in a simple suspension through a 120 cm 5 Fr standard Jayfeed® nutritional catheter. Results are presented as the mean±S.D. (3 Lot, n=3). Statistical analysis was performed using one-way analysis of variance (ANOVA) and Tukey’s multiple comparison test, with the significance level set at p<0.05.
当院で調製したRp.1のセレン速崩錠10試料について,それぞれ測定したところ,1錠あたりの含量平均値が29.7 µg/錠であった.判定値は8.12であり,第18改正日本薬局方の基準値(15%以下)に適合していた.
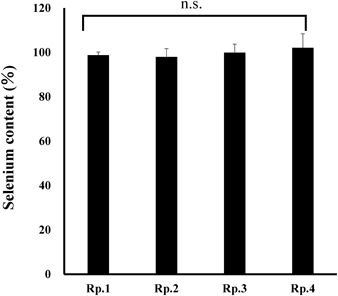
4. 加速試験Rp.1のセレン速崩錠を無包装,温度40.0±2.0°C,湿度75±5%RHで14及び42日間保存し,セレン含量,硬度,崩壊時間の変化を確認した.その結果,すべての評価項目において有意な変化はなかった(Fig. 2).
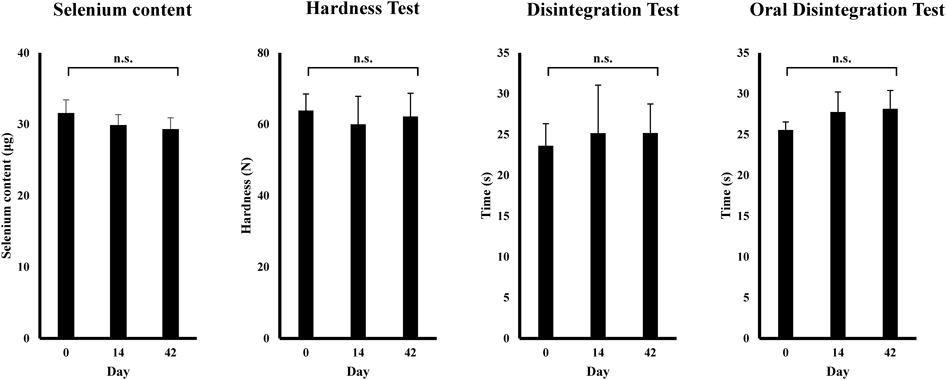
Fast-disintegrating selenium tablets (Rp.1; Table 1) were prepared and stored for 14 and 42 d at a temperature of 40.0±2.0°C and a relative humidity of 75±5% without packaging. Changes in selenium content, hardness, and disintegration time were measured. Results are presented as the mean±standard deviation (3 Lot, n=3). Statistical analysis was performed using one-way analysis of variance (ANOVA) and Tukey’s multiple comparison test, with the significance level set at p<0.05.
セレン内用液から速崩錠に服用薬剤を切り替えた重症心身症患者5名の患者背景をTable 3に示した.切り替え前の血中セレン濃度は76–123 µg/mL(平均101 µg/mL),切り替え後の血中セレン濃度は67–138 µg/mL(平均105 µg/mL)であり,切り替え前後で血中セレン濃度に有意な変化はなかった(p=0.46)(Fig. 3).また,すべての患者について,速崩錠へ切り替え後2ヵ月間に,爪白色化,心筋症,血液症状等のセレン欠乏症における臨床症状は確認されなかった.
| Patient | Age (years) | Gender | Height (cm) | Weight (kg) | Primary illness | Nutritional therapy | Route of drug administration | Selenium dosage (µg) |
|---|---|---|---|---|---|---|---|---|
| A | 38 | female | 148 | 55.6 | Congenital muscular dystrophy | Oral feeding | Oral (simple suspension) | 150 |
| B | 17 | female | 110 | 28.0 | Goltz syndrome | Racol®-NF combination enteral solution 600 mL/d | Oral (simple suspension) | 30 |
| C | 17 | male | 163 | 27.7 | Cerebral palsy, periventricular leukomalacia | ELENTAL® P infant formula for oral use 40 g/d | Oral (simple suspension) | 60 |
| ELNEOPA®-NF 2 infusion 1000 mL/d | ||||||||
| D | 9 | male | 111 | 16.3 | Preterm and very low birth weight infants, periventricular leukomalacia | Twinline®-NF combination enteral solution 1600 mL/d | Tube (gastrostomy) | 30 |
| E | 36 | male | 132 | 20.3 | Cerebral palsy, periventricular leukomalacia | Twinline®-NF combination enteral solution 1200 mL/d | Tube (gastrostomy) | 30 |
Racol®-NF formula enteral solution contains 2.5 µg of selenium in 100 mL and Twinline®-NF formula enteral solution contains 1.2 µg of selenium in 100 mL. The other enteral formulations do not contain selenium.

Blood selenium levels before and two months after switching from an oral selenium solution to the fast-disintegrating selenium tablets in patients with severe psychosomatic disorders who had been taking oral selenium solution for at least one year (n=5). Statistical analysis was performed using a paired t-test, with the significance level set at p<0.05.
本研究では,コプロセス製剤であるSmartEx®を用いることにより,崩壊性に優れ,十分な硬度を有する錠剤のセレン速崩錠が調製できた.さらに,当該製剤は,42日間の無包装状態における加速試験においても性状の変化がなく,長期保存が可能であった.また,セレン内用液から切り替えた際にも血中セレン濃度に有意な変化がなかった.
セレンは必須微量元素の一つであり,生体内では抗酸化酵素であるグルタチオンペルオキシダーゼや甲状腺ホルモンの代謝などに関与するヨードチロニン脱ヨウ素化酵素のようなセレノプロテインの活性中心としての役割を担っている.3,22,23)これらセレノプロテインは抗酸化作用,甲状腺ホルモン代謝,グルコース代謝などに関与している.1,24,25)また,セレンは炎症に関連する転写因子である核内因子nuclear factor-kappa B(NF-κB)の活性化を抑制することも知られている.26)以上のことから体内のセレンが不足すると,セレノプロテインの発現量の低下や炎症の惹起により,生体内に爪,毛髪の異常,4)赤血球の大球性変化,5)発育遅延,6)甲状腺機能低下,27)血糖異常28)など様々な生理的異常が生じる.そのため,セレン欠乏に陥らないように定期的な摂取が必要である.
セレンの補充用製剤として,わが国では注射剤が承認されているが,在宅医療等の現場において患者自身や介護者の使用が困難であるなどの,管理上の問題があった.一方で,セレンは経口でも良好に吸収されることがわかっており,29)注射剤と比べて患者自身の使用が容易であることから,院内製剤として経口液剤が調製され,使用されている.14)しかし液剤は,薬液の汚染等の問題があり長期保存が難しく,15)更に,患者に服用毎の秤量などの管理が求められるため,アドヒアランスの観点から適切な管理及び摂取量の過不足の懸念があった.このような問題点を解決する新規剤形として,本研究では,成形性・崩壊性に優れた直打用コプロセス製剤であるSmartEx®を用いてセレン速崩錠の調製を試みた.30)長期の静脈栄養や経管栄養を行っているなど,経口摂取で十分に栄養が取れない患者では嚥下が困難な症例が多いことが想定される.そのため,経口投与した際に崩壊し易く,容易に嚥下できる剤型が求められる.SmartEx®は,D(−)-マンニトール・L-HPC・PVAを混合した崩壊性に優れたコプロセス製剤である.平均粒子径の違いからSmartEx®50と,SmartEx®100の2規格の製剤が存在する.31)両製剤に含まれるL-HPCは水に触れると膨張する性質があり,32) PVAは多孔質な形態をしており,毛管現象によって水を引きこむ働きがある.32)これらの成分は錠剤の崩壊性を向上させる.本研究において,SmartEx®を用いて調製したセレン速崩錠の口腔内崩壊試験機での崩壊時間はSmartEx®50で26±1 s,SmartEx®100では32±2 sであった.SmartEx®50はSmartEx®100と比べて粉体の粒子径が小さく,水に触れる際の表面積が大きいため,崩壊時間が短かったと考察される.30)また,過去の報告では市販される口腔内崩壊錠の崩壊時間は20–40 s程度であり,33,34)セレン速崩錠は上市されている口腔内崩壊錠と同等の崩壊性を有していることがわかった.また,わが国における口腔内崩壊錠の崩壊時間に関する明確な基準は定められておらず,日本薬局方第18改正では,「口腔内崩壊錠は,口腔内で速やかに溶解又は崩壊させて服用できる錠剤である」と記載されている.21)これに対して米国では米国薬局方の崩壊試験法における崩壊時間が30 s以内であることを推奨している.35)本研究の結果から,SmartEx®50で調製したセレン速崩錠の崩壊時間のみこの基準を満たしていた.そのため,含量均一性試験,加速試験及び臨床試験については当該製剤を用いて実施した.
また,経口摂取できない患者では,経口製剤を経管投与することも想定される.特にセレンは小児領域でも使用されることが多いため,成人に使用するよりも口径の細い経管チューブを通過することが求められる.本研究では5 Fr規格のチューブを用いた通過試験において,セレン速崩錠の懸濁液がチューブの閉塞なく通過することが確認できた.セレン速崩錠は小児領域の細い経管チューブにおいても,投与する際に閉塞することなく投与できる製剤であることが考えられた.
さらに,錠剤は製造過程から患者が服用するまでその形態を保持する必要がある.その指標として,錠剤硬度(N)/質量(mg)の値が小さいほど錠剤の割れ,欠けが生じ難いことが報告されている.また,錠剤自動分包機を用いた際に,割れ,欠けが生じ難い錠剤硬度(N)/質量(mg)の基準値は0.30以上とされている.20)本研究において錠剤硬度(N)/質量(mg)の値は主にSmartEx®50で調製したセレン速崩錠で0.34±0.04, SmartEx®100では0.35±0.03であり,本研究で調製したセレン速崩錠は割れ,欠けが生じ難い製剤と考えられる.
また,錠剤は吸湿することで硬度が低下することや,崩壊性が低下し,崩壊時間が延長することが知られている.36,37) SmartEx®50で調製したセレン速崩錠について無包装状態で加速試験を行ったところ,硬度,崩壊性及びセレン含量に有意な変化はみられなかった.SmartEx®の構成成分である低置換度ヒドロキシプロピルセルロースは非イオン性であり,低吸湿性の崩壊剤である.30)そのため,無包装状態においてもあまり吸湿せず,硬度,崩壊時間の変化がなかったと考えられる.以上のことから,セレン速崩錠は,無包装状態で,少なくとも42日間までの保存が可能であることがわかった.
亜セレン酸は,経口摂取した際に回腸より良好に吸収され,その消化管吸収率は90%程度であることが知られている.29)そのため,注射剤をかならずしも用いる必要はなく,経口摂取により十分補充が可能と考えられる.しかし,経口摂取される際の剤型による吸収性及び薬効の違いについて検証された報告はなかった.そこで本研究では,セレン内用液を1年以上継続服用した重症心身症患者を対象として,セレン速崩錠へ切り替えた際の血中セレン濃度の変化について後ろ向きに調査を行った.その結果,切り替え前後での血中セレン濃度に有意な差はなかった.このことから,セレン速崩錠は従来使用されてきた内用液と著しい効果の違いがないことが推察された.また,本研究ではセレン血中濃度がセレン製剤の投与量に比例していなかった.これは,経腸栄養剤に含まれるセレン含量が個々で異なることや,体格及び病態の重症度によりセレン必要量が異なることが要因と考えられる.38)
本研究にはいくつかの研究限界が存在する.まず,セレン速崩錠の崩壊性について臨床評価ができていない.そのため,臨床試験を実施して実際の崩壊時間及び服用感などの評価を行う必要がある.さらに,本研究ではセレン速崩錠の有効性について重症心身症患者を対象として検討を行ったが,セレン補充を必要とする病態として悪性腫瘍や中心静脈による長期栄養療法実施患者などがある.39,40)これらの病態に対する評価は実施できていないため,今後検討する必要がある.また,本研究の臨床試験は,単一群で5症例の評価である.本来,医薬品の生物学的同等性を評価するためには,より多くの症例を用いてクロスオーバー試験などの研究デザインを用いて比較試験を行う必要があるため,更なる研究を行い,セレン製剤の同等性について十分に検証する必要がある.さらに,本研究ではセレン内用液から切り替えた2ヵ月間の臨床評価しか実施できていない.そのため,今後,長期的に使用した際の評価を行う必要がある.本研究では,過去の報告から,成形性・崩壊性に優れた直打用コプロセス製剤であるSmartEx®を用いてセレン速崩錠の調製を試みた.31)しかし,SmartEx®以外にも速崩錠の賦形剤として候補となるコプロセス製剤が存在するため,今後,これらの製剤を用いた調製方法の検討をする必要がある.
SmartEx®を用いて調製したセレン速崩錠は崩壊性に優れ,経管投与も可能であり,嚥下困難な患者であっても使用し易い製剤である.十分な硬度を有し,長期保存も可能なことから,長期にわたりセレンの補充が必要な患者のアドヒアランス及びQOLの向上に貢献する製剤として期待される.
開示すべき利益相反はない.