2023 年 143 巻 12 号 p. 989-995
2023 年 143 巻 12 号 p. 989-995
Disulfide bonds in peptides contribute to the immobilization and rigidity of their structures, leading to the expression of biological activity and resistance to metabolic enzymes. In addition, disulfide bonds are important in the construction of conjugates comprising two bioactive molecules such as peptides, sugars and drugs. Therefore, new methods of disulfide bond formation contribute to a more efficient construction of disulfide products. This article reviews studies on development of synthetic methodology for disulfide bond formation by using 3-nitro-2-pyridinesulfenyl (Npys) compounds. We have developed a one-pot solid-phase disulfide ligation (SPDSL) method by using an Npys resin, which can easily afford an asymmetric disulfide bond that is generated using two types of thiol-containing components such as peptides and small molecules. The disulfide-linked conjugation between a hydrophobic molecule and a hydrophilic peptide can be easily prepared. Based on the SPDSL strategy, we also developed a disulfide-driven cyclic peptide synthesis, which represents a new strategy to prepare cyclic peptides from two different fragments. By generating a disulfide bond between two fragments, the entropically favorable intramolecular amide bond formation can be achieved, resulting in the reduction of racemization at the coupling site. We found that methyl 3-nitro-2-pyridinesulfenate (Npys-OMe) functions as a disulfide bond-forming reagent possessing mildly oxidative activity. This reagent enhances intramolecular disulfide bond formation between two thiols for the synthesis of cyclic peptides under mildly acidic conditions. As the applications of Npys-OMe, we demonstrated the disulfide bond formation on thiols-containing peptidyl resin.
近年,医薬品や生体機能分子として,低分子と高分子の間をつなぐ中分子やペプチド–薬物複合体の様な架橋分子が新規機能分子として世界的に注目されている.このような中分子の実用化にはその効率的な合成手法の確立が重要となる.この課題に対し,筆者は3-ニトロ-2-ピリジンスルフェニル(3-nitro-2-pyridinesulfenyl: Npys)基の化学を基盤とした新規かつ独自な中分子ジスルフィドペプチド合成法の開発研究を展開している.Npys基はMatsuedaらによって開発された保護基であり,その導入には3-ニトロ-2-ピリジンスルフェニルクロリド[Npys-chloride(Cl)]1)が用いられる.Npys基は,システイン(Cys)側鎖チオール基の保護においては活性ジスルフィドとしても機能する.そのため,無保護チオール基が存在すると当該活性ジスルフィドとのジスルフィド交換反応が選択的に進行し,新たなジスルフィド結合を構築することができる(Scheme 1).2)本総説では,筆者がこれまでに開発したジスルフィド結合形成試薬及びジスルフィドペプチドの新規合成法について概説する.
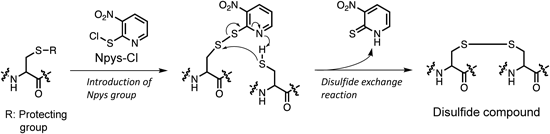
筆者は,固相担持型Npys化合物を用いたワンポット固相ジスルフィドライゲーション法(solid-phase disulfide ligation: SPDSL)を開発した(Fig. 1).3–6)本法により,2つの異なるチオール基含有分子から成るジスルフィド架橋体の効率的合成が可能となる.本法は,まず保護チオール基を有する分子(Component A)を活性ジスルフィド形成を介して樹脂上に担持させる.次に,ろ別した樹脂を洗浄した後,無保護チオール基を有する分子(Component B)を添加することで,樹脂上の活性ジスルフィドとのジスルフィド交換反応により,反応溶液中に非対称ジスルフィド架橋体が生成する.反応後,反応溶液をろ過するだけで,所望の架橋体を高純度で回収することができる.また,固相担体として水系及び有機溶媒で膨潤可能な両親媒性のChemMatrix樹脂7)を用いているため,SPDSL法は様々なチオール基含有分子との架橋体合成に適用できる.実際に,従来の液相法では合成困難な溶解性の異なる分子から成る,難水溶性抗がん剤–水溶性ペプチド架橋体4,5)や,煩雑な精製工程を要していた糖–ペプチドジスルフィド架橋体6)の効率的合成に成功している.また,複数のペプチドフラグメントを順次ジスルフィド結合で連結することで,人工ジスルフィドタンパク質の合成にも応用可能であることが示された.8) SPDSL法は,固相法を利用しているため精製が簡便なことから実用的な手法であり,新たな機能性分子創製の基盤技術となる可能性がある.

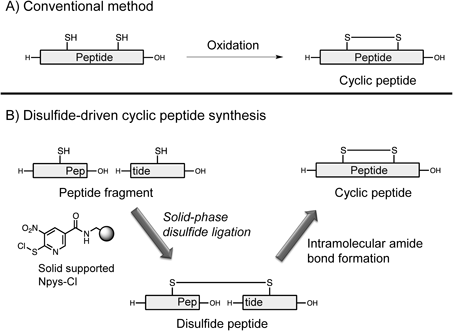
筆者はSPDSL法を利用することで,新たな環状ペプチド合成法としてジスルフィド駆動型環状ペプチド合成法(disulfide-driven cyclic peptide synthesis: DdCPS法)を開発した.3,9)一般的に環状ジスルフィドペプチドは,チオール基を有する直鎖ペプチドをペプチド固相合成法やフラグメント縮合などで構築した後,分子内ジスルフィド結合形成により合成される.一方で本法は,まずSPDSL法を用いることで2つのペプチドフラグメント間を連結し,ジスルフィドペプチドを調製する.ついで,得られたペプチドを分子内アミド結合形成に付すことで環状ペプチドへと導く手法である.本法は,先にフラグメント間のジスルフィド結合を構築することで,後のアミド結合における反応点が空間的に近づくため,効率的であると考えられる(Fig. 2).
筆者は本概念を実証すべく,オキシトシンのジスルフィド駆動型合成を実施した.すなわち,オキシトシンの一次配列をN末端Fmoc保護テトラペプチドと,側鎖保護Cys残基を含むC末端ペンタペプチドの2つのペプチドフラグメントに分割した.SPDSLによりフラグメント間のジスルフィド結合を構築後,得られた非対称ジスルフィドペプチドを分子内アミド形成により環状ペプチドへと導いた.本環化には一般的に用いられる縮合剤や優れたアミド結合形成法であるチオエステル法10–12)が適用可能であることがわかった.最後に保護基を外すことでオキシトシンのジスルフィド駆動型合成に成功した[Scheme 2A)].3)さらにDdCPS法の有用性を示すために,より複雑な環状ペプチドであるジスルフィド結合を2組有するヒトエンドセリン-2の合成に着手した.本合成ではエンドセリン配列をアリール及びアルキルチオエステルを有するフラグメントA及びBと,フラグメントCに分割し,SPDSLによるジスルフィドペプチドの構築と分子内アミド形成を2回行うことで,エンドセリンが合成可能と考えた[Scheme 2B)].すなわち,最初のジスルフィド駆動型合成において,フラグメントAとBの間のジスルフィドライゲーションと,その後のAgイオン非存在下でのチオエステル法により環化させた.得られた環状ペプチドとフラグメントCの間のジスルフィド形成とAgイオン存在下でのチオエステル法によるジスルフィド駆動型合成を行い,保護エンドセリンを構築した.その後,最終脱保護によりエンドセリンの実践的合成を達成した.9)また,本合成では従来法で問題とされるペプチドフラグメント間(分子間)のアミド形成時のラセミ化を抑制できることがわかった.最近,保護Cys残基含有ペプチド–樹脂と無保護Cys残基含有ペプチドフラグメントを用い,固相上で環状ペプチドを構築できる固相ワンポットDdCPS法13)の構築にも至っている.これより,DdCPS法は有用な環状ペプチド合成法として,ジスルフィド結合を複数有するペプチド合成への応用も期待される.

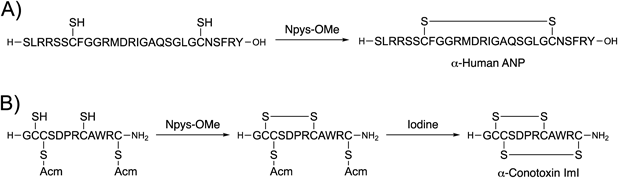
Figure 2A)に示すように環状ジスルフィドペプチドは,直鎖ペプチドに対し適切な酸化剤を用いることで合成できる.しかし,これら酸化剤の課題として腐食性及び毒性,副生成物の悪臭,メチオニン残基側鎖の酸化,トリプトファン残基側鎖の修飾などが挙げられる.したがって,これらを解決し得る有用性の高い酸化剤の開発は,環状ペプチドの効率的合成につながり,ペプチド合成化学,有機化学のみならず創薬化学の学術的発展に大きく貢献できると考えられる.筆者はNpys誘導体の1種である3-ニトロ-2-ピリジンスルフェン酸エステルに注目した.当該化合物の合成法は既に報告されていたが,そのジスルフィド形成能については未報告であった.14,15)そこで,還元型オキシトシンの酸化反応をモデルにスルフェン酸エステルのジスルフィド形成能を評価したところ,3-ニトロ-2-ピリジンスルフェン酸メチルエステル(methyl 3-nitro-2-pyridinesulfenate: Npys-OMe)が温和な酸化剤として機能することを見い出した(Fig. 3).16)また,当該化合物の特性として,1)弱酸性条件下,直鎖ペプチド中の側鎖無保護Cys残基間の選択的なジスルフィド結合形成により,環状ペプチドの合成が可能,2)メチオニン,トリプトファン残基に対して影響を及ぼさない温和な反応,3)従来の空気酸化法で用いるペプチド濃度よりも高濃度(1 mMペプチド溶液)でも分子内ジスルフィド結合が可能であることがわかった.筆者は,Npys-OMeを用いることでアミノ酸29残基のヒト心房性ナトリウム利尿ペプチド(α-human atrial natriuretic peptide: ANP)の合成を達成した.また,Npys-OMeとヨウ素酸化を組み合わせることで,α-コノトキシンImIのジスルフィド結合を位置選択的に構築することができた(Scheme 3).さらに,Npys-OMeを固相担体に搭載した化合物の創製にも成功している.本樹脂化合物を用いたジスルフィド形成反応では,反応溶液をろ過するのみで高純度の環状ペプチドが回収できる.これよりNpys-OMeは中分子ペプチドのジスルフィド結合構築に有用な化合物であることが示された.
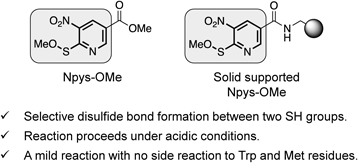
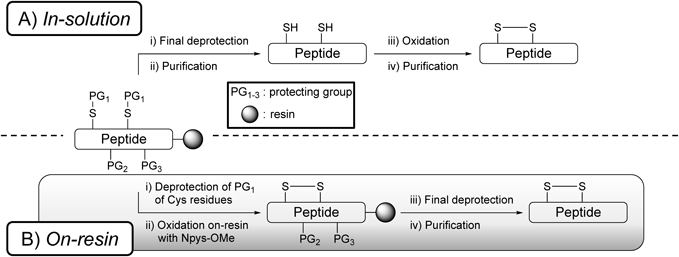
さらに,Npys-OMeによる「固相上」ジスルフィド形成法を鍵とした環状ペプチド合成法の開発に着手した.17)一般的な「液相法」におけるジスルフィド結合は,分子間反応を抑制するため,高希釈条件を要する.また,液相法は溶媒に難容性なペプチドには不向きであり,煩雑な溶媒留去などの課題もある[Fig. 4A)].一方で,本手法はペプチド鎖伸長からジスルフィド結合の構築を固相担体上で行うため,各反応での精製は必要なく,最終工程の脱保護及び脱樹脂により一挙に純度よく環状ペプチドが得られる手法である[Fig. 4B)].また,本手法の利点として,樹脂にペプチドが担持されているため,樹脂上の反応では「擬希釈効果」18)が働き,分子内反応が優位になること,高希釈条件やペプチドの溶媒への溶解性の問題も回避できることが挙げられる.
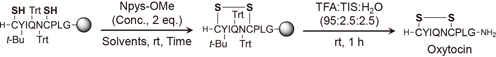
筆者は本手法を確立すべく,モデルとして無保護チオール基を有するオキシトシン–樹脂におけるジスルフィド形成反応を検討した(Table 1).まず,N,N-dimethylformamide(DMF)を反応溶媒として用いNpys-OMeの酸化反応を実施した結果,所望のオキシトシンは69%と中程度の純度で得られた.また,分子間反応に由来するオキシトシンのオリゴマー形成は27%であった(Entry 1).本結果は,擬希釈効果が働いたことで分子内反応が優位に進行したと考えられるが,副生するオリゴマー形成の抑制は当該効果だけでは不十分であることがわかった.次に本反応を改善すべく,添加剤として塩化リチウム(lithium chloride: LiCl)を採用した.リチウムイオンがペプチド主鎖アミド結合のカルボニル基と相互作用し,アミド結合のC–N結合の回転を抑制することでペプチド構造を変化させること,19,20)また,リチウムイオンはペプチド–樹脂の膨潤性を改善することで擬希釈効果を高める報告21)があったため,分子間反応が抑制できると期待した.LiCl存在下,酸化反応を実施したところ,望み通りオキシトシンの純度は88%と改善された(Entry 2).さらに,本反応におけるオリゴマー形成は3%と大幅に抑制された.次に,Npys-OMeの濃度を20 mMから5 mMへ低下させ,反応時間を更に3時間へ延長したところ,オキシトシンを91%の高純度で合成できた(Entry 3).確立した固相環状ジスルフィドペプチド合成法の更なる応用として,α-コノトキシンImIの固相上合成に着手した.前述と同様にNpys-OMeによる酸化反応とヨウ素酸化を用い,ジスルフィド結合を固相担体上で順次構築することで,位置選択的なジスルフィド結合形成を達成した.さらに,筆者は本手法をペプチド自動合成機でプロトコール化することで,オキシトシン及びα-コノトキシンの完全自動合成にも成功した.実際に本自動合成で得られた粗生成物の純度は,手動合成のものと遜色ないものであり,有用性の高い合成法であることが示された.これより,筆者により確立された固相環状ジスルフィドペプチド合成法は,ペプチド創薬における誘導体合成やペプチド医薬品などのプロセス合成への展開が期待される.
 | |||||
|---|---|---|---|---|---|
| Entry | Solvents | Conc. of Npys-OMe (mM) | Time (h) | Oxytocin (%)a) | Oligomers (%)a) |
| 1 | DMF | 20 | 1 | 69 | 27 |
| 2 | 0.4 M LiCl/DMF | 20 | 1 | 88 | 3 |
| 3 | 0.4 M LiCl/DMF | 5 | 3 | 91 | 2 |
a)Purity of the peptide and oligomers was determined by HPLC analysis of crude products after the treatment of peptidyl resin with trifluoroacetic acid (TFA) : triisopropylsilane (TIS) : H2O (95 : 2.5 : 2.5, v/v/v) at rt for 1 h.
筆者は中分子ペプチドの新規合成法として,固相担持型Npys化合物によるSPDSLとDdCPSの開発に成功した.本合成法を利用することで,生体分子の機能探索,創薬等,広範な研究領域において有用な多機能人工ジスルフィド分子の創製につながることが期待される.一方で,筆者はNpys-OMeが温和な酸化剤として機能することを見い出し,当該化合物の酸化反応に基づく固相環状ペプチドの自動合成法確立にも成功した.今後,3-ニトロ-2-ピリジンスルフェン酸エステルの更なる分子機能解明により,新たな化学特性や機能性を有する誘導体の創製を行っていきたい.
本研究を遂行するにあたり,終始御指導,御鞭撻を賜りました東京薬科大学薬学部薬品化学教室 林 良雄教授(現 同大学生命科学部創薬化学研究室 教授)に厚く御礼申し上げます.また,共同研究者の先生方,本研究においてご協力頂きました東京薬科大学薬学部薬品化学教室の先生方,大学院生,学生の皆様に感謝申し上げます.なお,本研究の一部は,日本学術振興会の科学研究費補助金(19K16324, 19H03356及び16K18914)の支援を受けて行われました.この場を借りて,御礼申し上げます.
開示すべき利益相反はない.
本総説は,2022年度日本薬学会関東支部奨励賞の受賞を記念して記述したものである.