2023 年 143 巻 12 号 p. 1005-1012
2023 年 143 巻 12 号 p. 1005-1012
Cleavage of unactivated bonds, such as amides, often requires challenging reaction conditions with strong acids and bases, and the tolerance of functional groups is limited. Therefore, the development of cleavage reactions for unactivated bonds under mild reaction conditions is essential. Herein, I report our recent developments in the cleavage of unactivated bonds under mild conditions. We achieved cleavage of unactivated amides, carbamates, ureas, and esters, as well as chemoselective cleavage of directing groups. Furthermore, we conducted mechanistic studies and found that these reactions proceed through the stabilization of addition intermediates.
アミドに代表されるカルボン酸誘導体は,安定な結合を有することから,医薬品やタンパク質,高分子などの様々な分野における重要な化学構造の1つとして利用されている.また,近年では有機化合物合成分野における保護基1,2)や配向基3–5)としての利用も進んでおり,その需要は高まっている.一方,その安定性ゆえ,これらの結合の切断には一般に強酸や強塩基などの厳しい反応条件が必要であり,官能基共存性の面で改善の余地を残していた.
この課題に対し,本研究では付加中間体の安定化を基盤とする戦略に基づき,通常安定で切断が困難な不活性結合を,温和な条件下で切断可能とする新規変換反応を見い出した.これにより,安定なアミド結合やエステル結合などが,事前の活性化を経ずに直接切断できるようになった.また,実験と計算化学を活用した反応機構解析により,付加中間体の安定化が反応の進行に重要であることも確認した.本総説では,以下それぞれの反応の開発の経緯や基質適用範囲,反応機構の詳細などについて解説する.
アミド結合の切断に用いられている加水分解反応は,求核性の低い水を求核剤として用いるため,通常強酸や強塩基存在下で加熱する過酷な条件が必要であり,基質適用範囲に改善の余地を残していた.一方,より求核性の高いアミンなどの窒素求核剤を用いれば,より温和な条件下でのアミド結合切断が可能になる.しかし,従来見い出されていた反応条件6,7)では,アルコールやカルボン酸などの酸性官能基が共存できない点に問題があった.
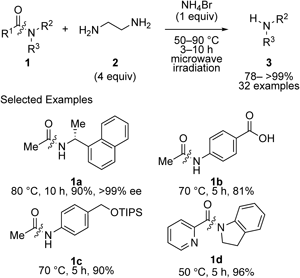
以上の背景を踏まえ,以前の研究8)で見い出された副反応から着想を得て,窒素求核剤を用いるアミド結合切断反応の反応条件を精査した.その結果,最終的に安価で容易に入手可能な臭化アンモニウム及びエチレンジアミン(2)を活性化剤及び求核剤として用いることで,マイクロ波照射9)条件下,アミド結合の切断反応が進行することを見い出した(Scheme 1).10)本反応条件は,加水分解反応のような強酸や強塩基を必要としないことから,高い官能基共存性を有しており,強酸性や強塩基性条件に不安定な保護基を含む,様々な官能基が共存可能であった.また,不斉水素化反応の生成物や,炭素–水素結合官能基化反応生成物のアミド結合も問題なく切断できた.さらに,本反応は空気や水存在下でも問題なく進行し,副生成物が水溶性であることから,反応後に分液操作をするのみで目的物のアミンを単離することが可能であった.
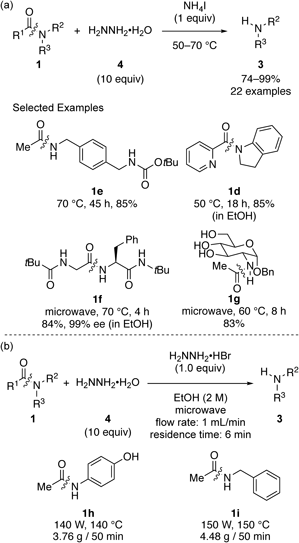
以上のように,アンモニウム塩を用いることでアミド結合が温和な条件下切断可能であることが判明したが,反応の促進にマイクロ波照射が必要であるという制限があった.そこで,次に本反応の反応性の改善を目的として,より求核性が高いヒドラジンを求核剤とする反応の開発を行った.その結果,市販のヨウ化アンモニウムとヒドラジン一水和物(4)を用いることで,オイルバスのような通常の加熱条件下でも,活性化されていないアミド結合が切断できることがわかった[Scheme 2(a)].11)本反応条件では,上記のエチレンジアミンを求核剤とする反応条件よりも幅広い基質一般性が達成でき,ペプチド結合の位置選択的な切断や,アミノ糖合成への応用も実現できた.さらに,本条件はフロー反応への適用も可能であり,1時間以内にマルチグラムスケールのアミンを合成できた[Scheme 2(b)].12)
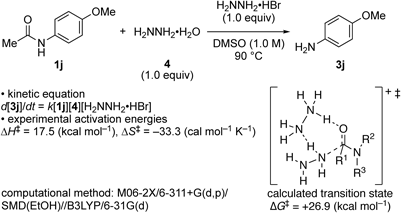
以上で開発した反応が温和な条件下で進行する理由を明らかにするために,実験及び計算化学に基づく反応機構解析を行った(Scheme 3).その結果,本反応はヒドラジニウム塩,ヒドラジン及びアミドの濃度に対して1次であり,活性化エントロピー∆S‡が大きな負の値を示したことから,これら3つの化学種が反応の律速段階に関与していることが明らかになった.この実験結果を踏まえ,計算化学によって想定される反応経路を探索したところ,ヒドラジニウム塩がアミド結合を活性化しつつ,ヒドラジンがアミドのカルボニル炭素を求核攻撃する反応経路が妥当であることが判明した.また,正四面体中間体の形成及び乖離段階がアンモニウム塩によって安定化されることが,本反応が温和な条件下で進行する要因であることも明らかとなった.
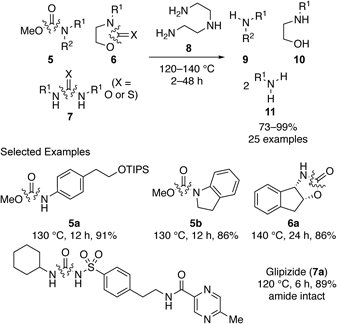
以上のように,安定なアミド結合が温和な条件下切断可能であることを見い出したので,次にアミドと類似した構造であるカーバメートやウレアの切断反応の開発を行った.種々条件検討の結果,ジエチレントリアミン(8)13)を求核剤とすることで,活性化されていないカーバメート5, 6やウレア7が切断可能であることを見い出した(Scheme 4).14)興味深いことに,本反応ではアミド結合の切断とは異なり,アンモニウム塩非添加の条件でも同等の反応性で反応が進行することが明らかになった.そこで,アミド存在下でのカーバメートやウレアの切断反応を検討したところ,通常の強酸や強塩基を用いる反応条件とは異なり,カーバメートやウレアが化学選択的に切断される特徴的な反応性を見い出した.
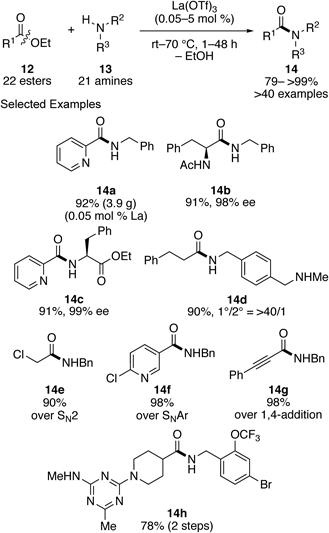
以上のように,活性化されていない安定なアミド結合が,アミン類を求核剤とすることで温和な条件下切断できることがわかった.そこで次に,エステル結合も同様の活性化機構で切断できれば,酸触媒によるエステルの直接アミド化反応15,16)を実現できると考え,種々ブレンステッド酸及びルイス酸触媒の検討を行った.その結果,希土類塩の一種であるトリフルオロメタンスルホン酸ランタン(III)を触媒として用いることで,本反応が温和な条件下円滑に進行することを見い出した(Scheme 5).17)本反応条件は様々なエステル12及びアミン13に適用可能であり,目的のアミド14を高い収率で与えた.また,本反応は高い選択性を有しており,2級アミン存在下での1級アミン選択的なアミド化(14d)や,化学選択性の逆転によるアミド化(14e–g)などが実現できた.本反応のこれらの特徴を活用することで,生物活性物質14hの簡便な合成経路の開拓にも成功した.
以上のように,アミンを求核剤とすることで,アミドなどの安定な結合が温和な条件下切断できることを見い出した.一方,アルコールを求核剤とする加アルコール分解反応は,エステルを生成物として与えることから,カルボン酸側のより有効な利用が可能となる.しかし,アミドの加アルコール分解反応では,通常エステルよりもアミドの方が安定なため,平衡が原系のアミド側に偏ることが予想され,既存の報告例は限られていた.18)一方,炭素–水素結合官能基化反応の配向基の1つである8-アミノキノリンアミド19)は,汎用性の高さから様々な反応に用いられているものの,その加アルコール分解反応には強酸20)や強塩基21)を用いた条件が用いられており,官能基共存性に改善の余地を残していた.
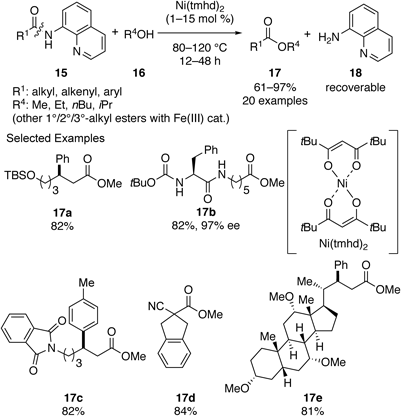
以上の背景を踏まえ,8-アミノキノリンアミドの炭素–水素結合官能基化反応に利用されている金属触媒を用いれば,金属触媒が8-アミノキノリンアミドに近接することで,より温和な条件下で化学選択的な加アルコール分解反応が実現可能であると考え,検討を行った.メタノールを溶媒として検討した結果,ニッケル(II)触媒を用いることで本反応が進行することが判明し,種々最適化の結果,Ni(tmhd)2(tmhd=2,2,6,6-tetramethylheptane-1,3-dionate)を触媒とすることで,最も良好な反応性で目的物のエステル17が得られた(Scheme 6).22)本反応条件は,実際の炭素–水素結合官能基化反応の生成物を含めた様々な構造を有する8-アミノキノリンアミド15に適用可能であり,強酸性や強塩基性条件で不安定な官能基も共存可能であった.また,触媒的エステル交換反応23)と組み合わせることで,ワンポットで様々なエステルへと誘導することも実現できた.
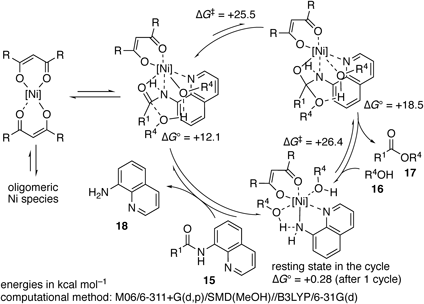
続いて,本触媒反応の活性化機構の解明を目的として,実験及び計算化学による反応機構解析を行った(Scheme 7).22,24)種々の対照実験の結果,本反応は単純な酸触媒では低収率に留まること,キノリン環の窒素原子が必須である一方でアミドのN–H結合は必須ではないこと,8-アミノキノリンやジケトンの添加で反応の進行が阻害されることが判明した.また,反応速度論解析の結果から,ニッケル(II)触媒が反応系中では主にオリゴマー状態で存在し,それが乖離して本反応を触媒していることも明らかになった.これらの実験結果を踏まえ,計算化学により反応経路を探索した結果,ニッケル(II)触媒が8-アミノキノリンのアミド結合及び求核剤であるアルコールを協奏的に活性化することで,本反応が温和な条件下で円滑に進行していることを明らかにすることができた.
前節において,活性化されていない配向基が直接切断可能であることを見い出したので,次に同様の配向基である2-アシルイミダゾール類25)の炭素–炭素結合直接切断反応の開発を行った.2-アシルイミダゾール類は,近年様々な触媒反応26–28)に活用されている重要な配向基の1つである.一方,その配向基の除去には安定な炭素–炭素結合の切断が必要になるため,通常はメチル化剤でイミダゾール部位を活性化した後,求核剤と反応させることで実現されており,29,30)事前の活性化を経ずに直接炭素–炭素結合を切断した例は,分子内反応の一例31)を除いて報告がなかった.
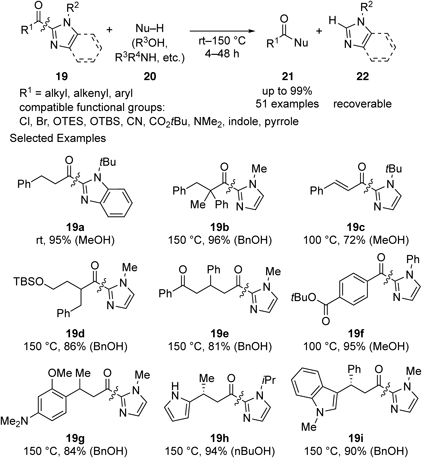
そこで,上述の8-アミノキノリンアミドの場合と同様に,適切な触媒を用いることで2-アシルイミダゾール類の炭素–炭素結合切断反応が実現可能であると考え,検討を行った.しかし,当初の予想に反して,アルコールのみを求核剤として用いることで,触媒を用いずとも直接2-アシルイミダゾール類19の炭素–炭素結合が切断されることがわかった(Scheme 8).32)本反応は様々な2-アシルイミダゾール類19に適用可能であり,イミダゾール部位の構造によっては室温でも反応が進行した.また,本反応は中性条件下で進行するため高い基質一般性を示し,メチル化剤と反応してしまう官能基も共存可能であった.さらに,アルコール以外にもアミンやチオール,水なども求核剤20として適用可能であり,様々なカルボン酸誘導体21が合成できた.
最後に,本反応の反応経路を明らかにすべく,実験及び計算化学による反応機構解析を行った.まず,ケトンから誘導される付加中間体23を別途合成して本反応条件に付したところ,本反応と同様に事前活性化を経ずに直接炭素–炭素結合が切断可能であることがわかった[Scheme 9(a)].また,その炭素–炭素結合切断に必要な活性化エネルギーを実験値と計算値で比較したところ,よい一致を示すことがわかった.さらに,加アルコール分解反応においても同様の付加中間体構造を想定した反応経路について計算したところ,計算された活性化エネルギーと実際の反応性によい相関が見られた[Scheme 9(b)].以上の結果から,本反応においては,2-アシルイミダゾール19のカルボニル基炭素に求核剤20が攻撃して分子内水素結合により安定化された付加中間体25を与え,その付加中間体25の水酸基から分子内でイミダゾール部位へのプロトン移動が進行し,イミダゾール部位が活性化されながら協奏的に炭素–炭素結合が切断される反応経路が妥当であることが示唆された[Scheme 9(c)].

以上,本総説ではアミドに代表されるカルボン酸誘導体の安定な結合を,温和な条件下切断可能な反応の開発について紹介した.本研究で開発した反応は,容易に入手可能な試薬や触媒によって実施できる点,様々な官能基を有する幅広い基質に適用可能である点,大量スケールやフロー反応への適用も可能な点に特色があり,いずれも実用性の高い手法である.実際,本総説で紹介した反応は,論文発表後に実際の化合物変換で活用されており,33–36)その汎用性の高さが実証されている.今後,このような反応が様々な場面で活用されることにより,これまで適用が困難であった官能基化された複雑な化合物も含む,様々な化合物の効率的な変換が実現可能となることを期待したい.
本稿で紹介した研究は,九州大学大学院薬学研究院環境調和創薬化学分野において行われました.本研究を遂行するにあたり,ご指導ご鞭撻頂きました大嶋孝志教授に深く感謝申し上げます.また,本研究成果は,引用論文に記載された学生諸氏の日々の努力の賜物であり,共同研究者である彼らの貢献に心より感謝いたします.本研究の一部は,生命科学・創薬研究支援基盤事業(BINDS),有機合成化学協会研究企画賞などの支援により行われたものであり,感謝申し上げます.本稿で述べた計算結果は,九州大学情報基盤研究開発センター研究用計算機システムの一般利用を利用して行われましたので,併せて感謝いたします.
開示すべき利益相反はない.
本総説は,2022年度日本薬学会九州山口支部学術奨励賞の受賞を記念して記述したものである.