2023 年 143 巻 12 号 p. 1013-1025
2023 年 143 巻 12 号 p. 1013-1025
Since commencing my role as a professor in a newly established Department of Pharmacodynamics and Molecular Genetics at the School of Pharmacy, Iwate Medical University, on April 1, 2007, my research has focused on modifying gene expression of cytochrome P-450 (CYP) in established human colon cancer cells. Additionally, I have been investigating methods to enhance the anti-tumor effects of irinotecan (CPT-11) and 5-fluorouracil (5-FU) using epigenetic modifying inhibitors of DNA methyltransferase and histone deacetylase. Treating colon cancer cells with a DNA methyltransferase inhibitor, 5-aza-2′-deoxycytidine (DAC), led to elevated expression levels of CYP1B1 and CYP3A4 through demethylation of the promoter regions of related genes. Furthermore, the administration of DAC and the histone deacetylase inhibitor depsipeptide [(DEP), an anti-cancer drug romidepsin] significantly increased the cellular sensitivities of human colon cancer cells to CPT-11 and 5-FU, respectively. Remarkably, DAC treatment also increased colon cancer cell sensitivity to SN-38, an active metabolite of CPT-11, through the suppression of the anti-apoptotic protein Bcl-2. DEP increased colon cancer cell sensitivity to 5-FU in association with increased expressions of tumor-suppressor p21 and major histocompatibility complex class II genes. Another facet of my research is centered around understanding the gene regulatory mechanisms of the CYP1 family through aryl hydrocarbon receptors (AhR)s under glucose-deprivation stress and in three-dimensional (3D) culture systems of human solid tumor cells. In the 3D culture of human liver cancer cells, I found Pregnane X Receptor being implicated in the regulation of CYP1A2, which aligns with the in vivo mode of CYP1A2 expression.
一般に,「薬物代謝」という術語は,医薬品を含めた生体外異物の代謝を指すことが多い.薬物代謝の中心的な組織は肝臓であるが,薬物代謝は,小腸を始めとする肝外組織でも認められる.
薬物代謝でしばしば問題になる事象は,薬物代謝の能力に顕著な個体差がみられることである.個体差要因の一つとして,薬物代謝反応を触媒する酵素の欠損等にもつながる遺伝子多型があげられる.遺伝子多型は重要な薬物代謝の個体差要因ではあるが,かならずしも現在までに知られている遺伝子多型で薬物代謝の個体差のすべてを説明することはできない.このことが,個々の患者に最適な薬物療法を選択することを難しくしている.個体差要因として最初にあげられるものは,薬物代謝酵素の発現レベルを規定する個人個人の体質としか表現しようがない要因である.具体的な事象としてとらえることができるものは,薬物代謝酵素が併用薬,食物成分,喫煙,飲酒などにより阻害されたり誘導されたりすることである.このため,個人の薬物代謝活性は,刻一刻と変動していることになる.化学物質による薬物代謝酵素の阻害や誘導は,例えばヒト肝初代培養細胞を用いて個別に薬物代謝酵素活性の変動を測定するなどして調べてデータが蓄積されていく.
筆者は2007年4月1日に新しく開設された岩手医科大学薬学部・薬物代謝動態学講座(現・医療薬科学講座・薬物代謝動態学分野)に着任した.岩手医科大学に着任する前は,国立医薬品食品衛生研究所において,薬物動態に関連する日本人の遺伝子多型の発見や機能解析に従事していた.したがって,岩手医科大学において薬物代謝動態学講座を主宰するようになってからは,当室の研究チームに加わってくれた教員の専門性に基づき,遺伝子多型以外のシトクロムP-450の遺伝子発現変動要因を念頭に置き,大別して,以下の4つの研究に従事することとなった.
筆者は,2023年3月31日付で岩手医科大学を定年退職した.この度,定年退職という節目にあたり日本薬学会の学会誌である薬学雑誌に総説執筆の機会を頂いた.そこで,岩手医科大学薬学部において筆者の研究グループで行われた研究を振り返り,本総説にまとめてみたい.
ヒト大腸がん細胞HT29, HCT116, DLD-1, LoVo, SW48, SW620, Caco-2細胞はDS Pharma Biomedical Co., Ltd.(Osaka)より購入した.HT29, HCT116, SW48は,McCoy’s 5A培地,DLD-1, LoVo細胞は,Ham’s F12培地,SW620細胞はE-MEM培地,Caco-2細胞はE-MEM培地に10%ウシ胎児血清(fetal bovine serum: FBS)を加え,5%CO2,37°Cで培養した.ヒト肝がん細胞は,JHH1(JCRB cell bank: JCRB1062),Huh7(Health Science Research Resources Bank, Osaka),HepG2(ATCC number: HB-8065)をカッコ内に付記した細胞バンクから入手した.大腸がんの患者40名のがん切除術後のがんの部位と周囲の間質の混入がない正常上皮組織とを全患者から書面による同意と,岩手医科大学の倫理委員会の審査を経て入手し,DNAメチル化の解析に供した.
実験研究の方法1. エピジェネティクスによる薬物代謝酵素遺伝子の発現調節主にDNAメチル化/脱メチル化やヒストンアセチル化/脱アセチル化によっておこる.そこで,筆者の所属する研究グループでは,ヒト大腸がん細胞株等の培養系に,DNAメチル転移酵素阻害剤の一つである5-aza 2′-deoxycytidine(DAC)や,ヒストン脱アセチル化阻害剤の一つであるdepsipeptide(DEP)を曝露させて生じる様々な変化をとらえる実験を行った.DEPにはromidepsinという別名があり,現在では,販売名「イストダックス点滴静注用10 mg」で再発又は難治性の末梢T細胞リンパ腫に効能・効果を認められた承認薬である.DACやDEPによるがん細胞内の薬物代謝酵素等の遺伝子発現の変動を調べるためには,1×105個の細胞を直径100 mmのプラスチックディッシュに播種し,これら薬物を培養液に添加し,5%CO2,37°Cの条件で4日間培養した.1)
2. DACやDEPを抗がん薬と併用し,抗がん薬の殺細胞作用の変化を調べる上述したヒト大腸がん細胞株を用いたコロニー形成阻害率を以下に述べる方法で測定した.2)すなわち,3000–6000個の細胞を直径60–100 mmのディッシュに播種し,薬物を培養液に添加し,5%CO2,37°Cの条件で7–10日間培養し,形成されてきたコロニー数を計数した.このとき,対照群で最低でも200–300個のコロニーを計数できるよう,播種する細胞数を調整した.
3. HCT116細胞(4000個の細胞)のアポトーシスの測定5-FU(1.75 µM)のみ,DEP(1 nM)のみ,及び5-FUとDEP併用後,アポトーシスに陥った細胞数の増加を,その指標の1つであるcaspase3/7の活性化によって測定した.測定にはCaspase-Glo™ 3/7 assay(Promega, Madison)を用い,Promega社の指示書に従って行った.薬剤曝露から24時間,48時間経過後のcaspase3/7の活性化をrelative light unitsとして測定し,数値化した.
4. DNAのCpGアイランドのメチル化Combined bisulfite restriction analysis法3)により解析した.
5. ヒト肝がん細胞JHH1, Huh7, HepG2の高低グルコース濃度下での培養通常10%ウシ胎児血清並びに1%antibiotic-antimycotic(Sigma, St. Louis)を加えたWilliam’s E mediumに4.5 g/Lのグルコース存在下で培養した.培養液中のグルコース濃度により,2つの培養条件を設定した.すなわち,4.5 g/Lのグルコース存在下の培養条件を“High glucose”の培養条件とし,1.0 g/Lのグルコース存在下の培養条件を“Low glucose”の培養条件とした.各グルコース濃度の条件下,37°C, 5%CO2で,12時間から24時間,あるいは実験研究の目的に応じた作用時間を決定して細胞培養を行い,種々の測定を行った.4)
6. 前項のヒト肝がん由来細胞JHH1, Huh7, HepG2を三次元培養する場合上記の培養条件で,48時間の前培養を行った.その後,細胞の懸濁液(1.0×104 cells/mL)を0.1 mLずつ低接着性のPrime Surface 96U(Sumitomo Bakelite, Tokyo)の各ウェルに加えて培養した.すなわち,1ウェルに1000個の細胞から成る細胞塊を形成させた条件で三次元培養を行った.比較のために行った二次元培養は,底面が平らで接着性が高い96ウェルプレート(Corning, Glendale)の1ウェルに1000個の細胞を播種することにより行った.5)
筆者は,岩手医科大学薬学部設立当初,当研究室教員の幅野准教授(現・教授)とともに,シトクロムP-450のエピジェネティクス機構による発現調節を調べる研究に着手した.各種大腸がん細胞株や患者検体のDNAを抽出し,CYP1B1遺伝子の転写開始点より5′-上流1.5 kb以内の4つの領域におおよそ20–40ヵ所存在するCpGアイランド領域のDNAメチル化の解析を行った.その結果,SW48とCaco-2細胞では高度にメチル化されているが,HT29とHCT116細胞ではメチル化の度合いが低いことがわかった.また,大腸がん患者(n=40)の正常組織の部分は,メチル化されていないが,正常組織に隣接するがん組織のDNAがメチル化されている検体が2検体あることが示された.大腸がん患者のCYP1B1遺伝子のDNAメチル化の意義は不明であるが,ごく一部の大腸がんについてDNAメチル化がおこっていることは,例えば個々の患者毎に化学療法薬に対する応答性が個体毎に異なるものとしてとらえられる可能性がある.無論,この命題への答えを知るためには臨床研究が必要であるが,研究対象となる化学療法薬の代謝にCYP1B1の寄与が大きいことが前提条件である.さらに,SW48, Caco-2, HT29, HCT116にDNAメチル転移酵素阻害剤のDAC(5 µM)を曝露すると,前2者は,DNAのメチル化が外れたが,HT29やHCT116ではもともとDNAメチル化の程度が低いため,特段の変化はみられなかった.SW48のCYP1B1の発現量が20倍強,Caco-2のそれが8倍程度に上昇し,HT29やHCT116のCYP1B1の発現量はほとんど変化がみられないか,むしろ減少傾向になった.これらの結果から,CYP1B1遺伝子の5′-非翻訳領域のCpGアイランドのシトシンのメチル化は少なくとも大腸がん細胞内のCYP1B1の発現レベルを決定する因子の一つであると思われた.1)
ついで,筆者の研究グループは,pregnane X receptor[(PXR), NR1I2]をコードする遺伝子のメチル化に着目した.大腸がん細胞株LS180, LoVo, Caco-2, HCT116, HT29, SW48について,PXR,ビタミンD受容体(vitamin D receptor: VDR),CYP3A4の各遺伝子のプロモーター領域等のDNAメチル化の程度とPXR, VDR, CYP3A4のmRNAレベルをDAC(0.5又は5 µM)曝露群と非曝露群間で比較した.その結果,LS180, LoVo細胞についてDAC(5 µM)曝露により生じたPXR, VDR, CYP3A4の発現レベルの変動(CYP3A4で最大3倍程度)に比較し,Caco-2, HCT116, HT29, SW48の4種の細胞では,CYP3A4の発現レベルの上昇倍率が大きく,SW48では28倍程度,Caco-2(68倍),HCT116(72倍),HT29(116倍)となっていた.Caco-2, HCT116, HT29, SW48細胞のPXR遺伝子のプロモーター領域のメチル化がおこっていて,DAC処理により脱メチル化がおこり,転写調節経路として,PXRの下流に位置するCYP3A4のmRNAレベルの上昇が顕著にみられたと解釈できる.すなわち,大腸がん細胞で,各種遺伝子のプロモーター領域のDNAのメチル化状態により,PXRやCYP3A4遺伝子の発現レベルが変動する場合があることが明らかとなった.また,大腸がんの部位と,周囲の正常部位とが得られている臨床検体の比較では,培養大腸がん細胞でメチル化の差異が認められた部位について,がん組織ではメチル化されておらず,がん組織周囲では,片方の染色体上の当該部位がメチル化,もう片方はメチル化がおこっていなかった.このことから,大腸発がん段階のどこかでPXR遺伝子のプロモーター領域の脱メチル化がおこることが示唆された.6)このように,当研究グループでは,大腸がん細胞を用いて,CYP1B1とPXR/CYP3A4の各遺伝子の特定CpGアイランドのメチル化がこれらの遺伝子のエピジェネティクスによる遺伝子発現調節メカニズムの一部となっていることを示した.以上の結果をTable 1にまとめた.
| Induced CYP | Colon cancer cell line | Fold-elevation by DACa) | Overall DNA methylation statusb) |
|---|---|---|---|
| CYP1B1 | HT29 | (No elevation)c) | Unmethylated |
| HCT116 | (No elevation)c) | Unmethylated | |
| SW48 | 20-fold | Methylated | |
| Caco-2 | 8-fold | Methylated | |
| CYP3A4 | LS180 | 3-fold | Unmethylated |
| LoVo | 3-fold | Unmethylated | |
| SW48 | 28-fold | Methylated | |
| Caco-2 | 68-fold | Methylated | |
| HCT116 | 72-fold | Methylated | |
| HT29 | 116-fold | Methylated |
a)Representative values of fold-elevation by DAC are described. b)Overall, DNA methylation status in various human colon cancer cell lines is described in relation to the effects of the DNA methyltransferase inhibitor, DAC, on CYP1B1 or CYP3A4 expression. In case of the CYP1B1 gene, demethylation of a methylated CpG island located in its 5′-flanking region was shown to elevate expressed levels of CYP1B1 in SW48 and Caco-2 cells by DAC treatments.1) In case of the CYP3A4 gene, demethylation of a methylated CpG island located in a PXR (NR1I2) gene promoter was shown to elevate expressed levels of CYP3A4 in SW48, Caco-2, HCT116, and HT29 cells by DAC treatments.6) c)No elevation means that changes in mRNA levels did not reach statistical significance.
前節に述べたように,岩手医科大学における筆者の研究グループでは,がん細胞のDNAメチル化やヒストン脱アセチル化の阻害剤をヒトがん由来の株細胞に曝露させたところ,主に,抗がん薬の不活性化の役割を果たすと想定されるシトクロムP-450の発現レベルが上昇する結果を得た.このことから,これらエピジェネティクス機構の阻害剤により抗がん薬の効果が低下してしまうことになるのではないか,と当初は考えた.学部学生のころから抗がん薬の殺細胞作用及びその作用機序,並びに感受性機構に興味を持っていた筆者としては,効果が低下してしまっては面白くないのではあるが,万事やってみなければわからない.各種大腸がん細胞株に,既存抗がん薬を曝露する際,エピジェネティクス機構の阻害剤を併用することを試みた.抗がん薬の効果の測定のために,筆者のポリシーとしてコロニー形成率を測定している.コロニー形成率を調べる実験は,コロニーの形成まで7–10日間程度の培養が必要である.播種直後から1日間程度細胞をプラスチックプレートにしっかりと接着させてから薬剤に7–10日間曝露させているので,播種時の個々の細胞はコロニー形成までの間,薬剤曝露に耐えて生存したと判定できる.このような理由から,エピジェネティクス過程の阻害剤による抗がん薬の効果増強の研究では,一貫してコロニー形成法を用いた.殺細胞作用の増強が確認された後,作用増強の機構を調べるという道筋で研究を遂行することとした.ところが,薬物代謝酵素の発現レベルの上昇が明瞭にみられる5 µMのDAC曝露ではもちろんのこと,0.5 µMのDAC曝露でも,7–10日間曝露すると,LS180, Caco-2, HCT116, HT29, SW48といった大腸がん細胞はほとんどコロニーを形成しなくなってしまった.そこで,細胞の生存率に対する影響が最小限になるDAC(用いるがん細胞株により30–75 nM)やDEP(用いる細胞株により0.2–1 nM)の低濃度を設定し,5-fluorouracil(5-FU)やirinotecan(CPT-11)と併用することとした.その結果,以下,少し詳細に述べるように,HT29細胞に対するCPT-11とDACの併用のケースを除き,CPT-11とDAC,7) 5-FUとDEP8)の併用で,5-FU, CPT-11単剤の大腸がん細胞に対する殺細胞作用が増強された.
DNA脱メチル化阻害剤のDACとCPT-11の併用では,HCT116とHT29細胞について,CPT-11の抗腫瘍効果がDACにより増強されるかどうかを調べたところ,HCT116細胞に対しては,31.25 nMのDACと1 nMのSN-38との併用で,SN-38の殺細胞作用の統計学的に有意な増強がみられた.それに対して,31.25 nMのDACは,62.5–500 nMのCPT-11の殺細胞作用を強める傾向にはあったが,統計学的有意差には達しなかった.一方,HT29細胞については,同細胞の生存率の低下があまり認められない75 nM, 100 nMのDAC曝露を試みたが,CPT-11, SN-38ともに殺細胞作用が増強されるどころか,DAC曝露時のCPT-11やSN-38の殺細胞作用はほとんど変動しなかった.
HCT116とHT29細胞のCPT-11やSN-38の殺細胞作用に対するDACの影響の現れ方に大きな差異が認められたことから,この理由を明らかにする実験を行うにあたり,アポトーシス関連タンパク質に着目した.アポトーシス抵抗性因子に分類されているBcl-2は,がん細胞内でWT1タンパクにより正の発現調節を受けている.今回,WT1とBcl-2タンパクのHCT116とHT29における発現レベルがDACの併用によりどのように変動するかをwestern blot法により調べた.その結果,DACの併用により,CPT-11やSN-38の作用の増強がみられたHCT116では,対照や,DAC, CPT-11, SN-38の単独曝露群に比べDAC+CPT-11及びDAC+SN-38の併用群で,WT1, Bcl-2がともに目視でみることができない5%未満に減少した.それに対して,この併用によるCPT-11やSN-38の作用増強がほとんど認められないHT29細胞もWT1タンパクの発現は大きく抑制されたが,HT29細胞では,そもそもBcl-2タンパクの発現レベルが非常に低く,HCT116でBcl-2が検出された実験条件では検出限界未満となっていた.両細胞のBcl-2レベルを量的に比較すると,HT29細胞は,もともとBcl-2タンパクレベルがHCT116細胞に比べて20分の1未満しかない細胞であることが明らかになった.7)併用時におけるBcl-2タンパクレベルの低下につき,実験時の数値をTable 2にまとめるとともに,併用による殺細胞作用の増強へのBcl-2の関与についてFig. 1に描画した.すなわち,併用時にHCT116細胞においては殺細胞作用の増強がみられ,併用の標的と考えられるBcl-2タンパクの発現がその正の発現調節因子であるWT1の大きな低下に伴って低下した.一方,HT29細胞ではそもそも併用の標的であるBcl-2タンパクが存在しないので,併用による効果の変動がほとんど認められなかった.以上,HCT116細胞とHT29細胞間のDACとCPT-11併用に対する反応性の大きな差異を概念的に示した(Fig. 1).
| Levels of Bcl-2 (% of No drug for HCT116) | |||
|---|---|---|---|
| No drug | CPT-11, SN-38, or DAC alone | (CPT-11 or SN-38)+DAC | |
| HCT116 | 100 | 50–70 | <5 |
| HT29 | Bcl-2 protein was below the limit of detection under the present experimental conditions. | ||
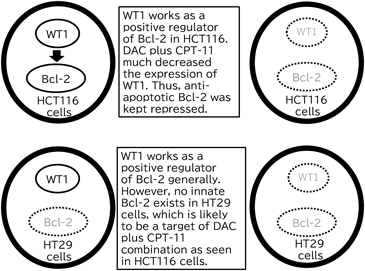
WT1, a positive regulator of Bcl-2, is expressed in both HCT116 cells and HT29 cells. Combination treatments of HCT116 and HT29 with DAC plus CPT-11 resulted in the repression of WT1 proteins. Bcl-2 protein expression in HCT116 cells was repressed by DAC plus CPT-11, which made HCT116 cells very sensitive to the combination treatments accompanied with the Bcl-2 repression. On the other hand, HT29 cells were not sensitized with the combination treatments due to innate deficiency of Bcl-2.
筆者の研究グループは,ヒストン脱アセチル化酵素阻害剤DEPにも興味をひかれ,5-FUとヒストン脱アセチル化酵素阻害剤であるDEPの併用も試みた.8)この研究を始めるにあたり,大腸がん細胞株HCT116, HT29, SW48に対して作用させる5-FUやDEPの濃度作用曲線を作成してから実験に供した.一般的な考え方の道筋としては,5-FUの殺細胞作用,すなわちコロニー形成率の抑制が,ヒストン脱アセチル化酵素阻害剤の併用によって,単剤作用に比較して強く現れるかどうか,そして,そのコロニー形成率の抑制を説明し得る発現変動等がおこる遺伝子を見い出すことであろう.一連の実験は,①対照,②5-FUのみ,③DEPのみ,④両者の併用,の4種の薬物曝露を一つのシリーズとして行った.3種類のがん細胞株に対して4種の薬物曝露であるから,結果を文章で示すと複雑になってしまうので,Table 3にまとめた.このように,用いた3種のヒト大腸がん細胞すべてに対して,5-FUのコロニー形成率の抑制,すなわち殺細胞効果が,DEPの併用により統計学的有意差をもって増強された.HCT116については,薬剤曝露から24時間,48時間経過後のcaspase 3/7の活性化(relative light unitsとして測定され,数値化された)を1.75 µMの5-FU, 1 nMのDEP単剤又は併用処理後に測定した.Figure 2に示すように,5-FU, DEPの単剤曝露に比較し,両者の併用では,24時間,48時間ともに,アポトーシスに陥ったと考えられるHCT116細胞について測定された発光量の相加的な増加,すなわち,caspase 3/7が相加的に増加することを認めた.8)
| Number of colonies (% of No drug control) | ||
|---|---|---|
| 5-FU or DEP alone | Combined use of 5-FU and DEP | |
| HCT116 | 55 (5-FU), 57 (DEP) | 30a) |
| HT29 | 57 (DEP), 60 (5-FU) | 35a) |
| SW48 | 60 (DEP), 70 (5-FU) | 25a) |
Drug concentrations used were: 1.75 µM 5-FU and 1 nM DEP for HCT116, 0.625 µM 5-FU and 0.375 nM DEP for HT29, 0.875 µM 5-FU and 0.2 nM DEP for SW48. a)Results on colony formation after these combination studies are described as an average of three or four separate experiments. Statistically significant reductions in colony forming efficiency were observed in HCT116, HT29, and SW48 cells when treated with 5-FU or DEP alone and in combination.

HCT116 cells (4000 cells) were exposed to either 1.75 µM 5-FU, 1 nM DEP or combination of 5-FU and DEP for 24 and 48 h. Cells were harvested, and cellular activities of caspase 3/7 were measured by using Caspase-Glo™ 3/7 assay (Promega, Madison). Apoptotic cells were quantified as relative light unit (RLU) according to manufacturer’s instruction. The representative experimental results are illustrated.8)
併用でみられた5-FUの効果増強と並行しておこる現象について,5-FUの作用機序に関連する因子,例えば,チミジル酸合成酵素遺伝子(thymidylate synthase gene: TYMS)をはじめ,両薬併用時に最も変動が大きいかどうか,ということを念頭に,網羅的発現解析やリアルタイムPCRにより調べた.併用時に顕著な発現変動を示したものは,がん抑制遺伝子p21であった(Fig. 3).ほかに,腫瘍組織適合性遺伝子複合体(major histocompatibility complex: MHC)のうち,クラスIIに属する遺伝子HLA-DPB1, HLA-DQB1, HLA-DRA, HLA-DRB1の発現レベルが上昇した.網羅的発現解析の結果を,リアルタイムPCR法で確認したところ,5-FU, DEP単独では,高くても対照の2倍程度の上昇に留まったのに対し,両者併用では,3–8倍の上昇を示した(Fig. 4).5-FUとDEPの併用において発現上昇したMHCクラスIIに属する遺伝子発現レベルは,対照群,両薬単独処理群と比較し,統計学的に有意に高かった.このような現象は,全く予想していなかったことであった.8) DEPは,romidepsinという一般名で,ヒストン脱アセチル化酵素阻害作用を有する抗がん薬としてわが国においても承認されている.そのほかにも,ヒストン脱アセチル化阻害薬は,抗がん薬として既に承認されているものや臨床試験が行われているものがあり,この種の薬物に臨床応用が期待されているものがいくつか存在する.9)

HCT116 cells (4000 cells) were exposed to either 1.75 µM 5-FU, 1 nM DEP alone, or combination of 5-FU and DEP. Expression of p21 was evaluated by real-time PCR using p21-specific oligonucleotide primers. Expressions of p21 relative to no drug control are illustrated.8)
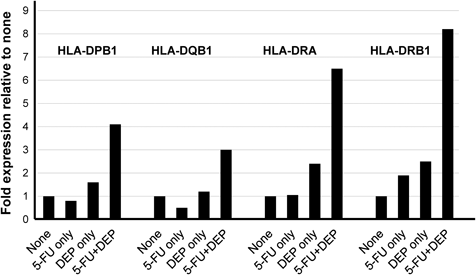
HCT116 cells (4000 cells) were exposed to either 1.75 μΜ 5-FU, 1 nM DEP alone, or combination of 5-FU and DEP. Expressions of MHC class II gene, HLA-DPB1, HLA-DQB1, HLA-DRA, and HLA-DRB1, were evaluated by real-time PCR using oligonucleotide primers specific to each MHC class II gene. MHC class II gene expressions are illustrated relative to no drug control.8)
当室所属教員の寺島らは,肝がん細胞株のHepG2を用い,細胞に低グルコースストレスを与え,特に薬物代謝酵素CYP1ファミリーの発現レベルの変動を調べた.グルコース1.0 g/Lの濃度を低グルコース条件下,グルコース4.5 g/Lの濃度を高グルコース条件と設定し,HepG2細胞を12時間から24時間曝露した.その結果,CYP1A1, CYP1A2, CYP1B1について,低グルコース条件12時間目でも最低でも5倍又はそれ以上の発現亢進をみとめた.4) CYP1ファミリーに属するシトクロムP-450分子種の発現は,多環芳香族炭化水素受容体(aryl hydrocarbon receptor: AhR)により正の調節を受けている.また,2,3,7,8-tetrachlorodibenzo-p-dioxin[(TCDD),ダイオキシン類に属する一化合物]はAhRの典型的リガンドの一つであり,リガンドが結合したAhRは,多環芳香族炭化水素受容体核内輸送体(aryl hydrocarbon receptor nuclear translocator: ARNT)と複合体を形成し,核内に移行し,様々な遺伝子の発現を惹起する.また,トリプトファン,ビリルビン,ビリベルディン,リポキシンA4は内因性のAhRリガンドであることが示されている.実際に2011年の上記論文の公表と相前後してキヌレニンがAhRの内因性リガンドの一つであることが報告された.10)
これらのことから,低グルコースストレス条件は,HepG2細胞内にAhRリガンドとなる物質の合成のひきがねとなり,リガンド–AhR–ARNT複合体が核内に移行してCYP1ファミリーのシトクロムP-450分子種の発現を誘導したと考えられる.
さらに,グルコース欠乏ストレスによるCYP1ファミリーの誘導には,AhRが核内に移行し,AhR–ARNT複合体が核内で形成され,CYP1ファミリーの分子種をコードする遺伝子の上流に存在する生体外異物結合エレメント(xenobiotic responsive element: XRE)に結合することが必須の過程となる.XREに結合するAhR側のモチーフは,AhRのアミノ酸配列50–54の部位であることも明らかにされている.11)
一方,AhRは細胞の悪性化(がん化)に関与することもよく知られている.細胞ががん化して悪性腫瘍組織を形成するためには,腫瘍血管の新生が重要である.このことを背景として,寺島らは,グルコース欠乏ストレスにおいてCYP1A1やCYP1A2の誘導と並行して,血管内皮細胞増殖因子すなわち,vascular endothelial growth factor(VEGF)が誘導されることを示すとともに,VEGFの誘導に,activating transcription factor 4(ATF4)が係わっていることを示した.12)がん組織の起源は単一の正常細胞である.もともとは正常だったはずの細胞が生体からの増殖停止といった制御の命令に従わずに勝手に増殖し,最終的には患者の生命を奪う結果となるのががんという疾病である.がん化した細胞が勝手に増殖するためには酸素や栄養を取り込む必要がある.AhRが関与し,がんの発生につながる過程の中でVEGFが誘導されて腫瘍血管を形成することは,がん細胞の立場からみれば都合のよいことであると思われる.この経験を通じて,岩手医科大学に着任後は,がん細胞を三次元的にプラスチックプレートで培養する系を用いた研究を試みた.
4. 二次元培養環境と三次元培養環境間でのCYP1ファミリー分子種CYP1A1及びCYP1A2の発現調節機構の差異ヒトCYP1A1とCYP1A2は,染色体15q24.1に位置し,両遺伝子は約23 kb離れてhead-to-head,すなわちCYP1A1とCYP1A2遺伝子の5′-非翻訳領域が共通の領域内に逆向きの配置となっている.13)同一サブファミリーに属するシトクロムP-450分子種であるが,両者の生体内での発現組織や基質特異性は大きく異なる.CYP1A1は特に肺などの肝外組織での発現やbenzo[a]pyreneなどの代謝的活性化が特徴的で,肺発がんとの関連でよく研究されてきた.すなわち,発がんのイニシエーションを引き起こす代謝活性化反応を触媒することが特徴である.一方,CYP1A2はほぼ肝内で発現し,caffeine, theophylline, propranolol(N-desisopropylation)など多様な薬物の酸化的代謝の役割を果たしている.CYP1A2について特筆すべきことはもう一つある.それは,肉や魚を焼くといった加熱調理をした食品に生成しているアミノ酸由来のがん原物質であるヘテロサイクリックアミンのN-水酸化反応を触媒する主な代謝酵素として発がんとの関連で膨大な研究がなされてきたことである.14)このように考えていくと,CYP1A1, CYP1A2は,発現組織こそ全く異なるが,発がんのイニシエーションに係わる触媒反応を行う酵素であるという共通点を有していることがわかる.以上が発がんとの関連の側面からみたCYP1A1とCYP1A2の類似点である.
岩手医科大学に着任以前,筆者は,前任地の国立医薬品食品衛生研究所において,ラジアルフローバイオリアクターにより,HepG2細胞を極めて高密度で三次元的に培養し得る系を用いて実験研究を行ってきた.15,16)さらに,プラスチックプレートの平面培養との比較において,PXRやconstitutive androstane receptor(CAR)の発現レベルの統計学的に有意な上昇や,rifampicinによるCYP3A4の誘導倍率が高いことを見い出していた.17)
当研究室の寺島らは,ヒト肝がん由来細胞の三次元培養系を活用し,CYP1A1, CYP1A2分子種の発現調節機構の差異について明らかにし,報告した.ヒト肝がん由来のHepG2, Huh7, JHH1細胞を用い,二次元培養(プラスチックプレート上で細胞を培養する平面培養)と三次元培養(1000個の細胞からなる細胞の凝塊)との比較で,いずれの細胞株もCYP1A1, CYP1A2ともにタンパクレベルで三次元培養時の方が二次元培養時より2–10倍発現が高かった.これらはCYP1Aサブファミリーの酵素であるので,AhRによる正の発現調節が想定される.まず,二次元培養において,基準化のために測定するβ-actinの発現レベルに影響がない条件でのAhRのsmall interfering(si)RNAによるノックダウンにより,CYP1A1, CYP1A2ともにmRNAレベルが5分の1程度に低下した.それに対して,三次元培養においては,AhRノックダウンによるCYP1A1やCYP1A2の発現に対する影響はかなり異なっていた.三次元培養において二次元培養よりも高まっているCYP1A1の発現レベルはAhRノックダウンにより5分の1程度に低下した.一方,AhRノックダウンのCYP1A2の発現に対する影響はずっと小さかった.ヒト肝がん細胞株を用いたAhRノックダウンの実験結果をTable 4にまとめた.三次元培養においてCYP1A2の発現をサポートする因子を明らかにするため,PXRノックダウンの実験を行うことにより,Huh7とHepG2細胞の三次元培養条件では,CYP1A2の発現をより強く支えているのはAhRではなくPXRであることが明らかとなった.5)
| Cancer cell lines | CYP1 family members | ||
|---|---|---|---|
| CYP1A1 | CYP1A2 | CYP1B1 | |
| JHH1, Huh7, and HepG2 | ↓↓ | → | Not determined |
↓↓ means decreased with statistical significance; and → means no change.
さらに,寺島らは,AhRリガンドとなるbenzo[a]pyreneを誘導剤としたシトクロムP-450の誘導に,二次元培養と三次元培養間で差異があるかどうかについて解析した.18)ヒト肺発がんに多かれ少なかれbenzo[a]pyreneの関与があると思われる.19)このことを根拠に,Benzo[a]pyreneをシトクロムP-450の誘導剤とするにあたり,入手可能なヒト肺がん由来細胞株の中から選定してbenzo[a]pyreneに曝露した.
以下に述べるbenzo[a]pyreneを誘導剤とする研究では,ヒト肺がん細胞A549, H520, H1703, H2170細胞株を用いた.肺がん細胞の結果との比較のため,繰り返しになるが肝がん細胞株の三次元培養環境では,CYP1A1, CYP1A2ともに,二次元培養時に比べ,発現レベルが上昇していた.ただし,肝がん細胞の実験においては,benzo[a]pyreneへの曝露は行われていない.上記4種の肺がん細胞株でも三次元培養環境では,もう一つのCYP1ファミリーに属する分子種であるCYP1B1を含め,二次元培養環境に比較して一様に10倍程度の発現レベルの上昇がみられた.ところが,肺がん細胞に対するAhRノックダウンの影響には,肝がん細胞とは若干異なる点があった.三次元培養を行った肝がん細胞においては,AhRノックダウンにより,CYP1A1は極めて効率よくタンパクレベルでダウンレギュレートされていたのに対し,CYP1A2の発現レベルへの影響は小さかった.それに対し,三次元培養された肺がん細胞にAhRノックダウンを行った場合,上記4種の肺がん細胞中H520を除く3つの細胞株では,CYP1A1, CYP1A2,いずれも発現レベルの低下傾向はみられたが,統計学的に有意ではなかった.一方,三次元培養されたH520細胞のみ,CYP1A1, CYP1A2ともに,AhRノックダウン後の発現レベルが約5分の1から10分の1程度まで統計学的にも有意に低下していた.1つの細胞株のみ他の3つとは異なる結果となった理由は不明のままであるが,「がんの個性」の範疇に入る事象かもしれない.また,これら4つの肺がん細胞株を用いた研究においては,CYP1B1についても調べているが,三次元培養環境では,AhRノックダウンにより4細胞株ともにCYP1B1の発現レベルは10分の1程度に低下した.18)以上の結果をTable 5にまとめた.三次元培養系で,benzo[a]pyreneに曝露させたヒト肺がん細胞を用いた一連の研究結果は,肺がん細胞株間で挙動が異なる結果が得られた.がんは1つの細胞,すなわちクローン由来である.したがって,がん細胞の性質は,細胞間で異なることは十分にあり得るため,今回得られた結果は,クローン毎のがん細胞の性質の差異の表れと解釈し得る.
| Cancer cells | CYP1 family members | ||
|---|---|---|---|
| CYP1A1 | CYP1A2 | CYP1B1 | |
| A549, H520, H1703, and H2170 | (Tendency to decrease)a) | ↓↓ | |
a)Among the lung cancer cell lines, H520 showed a clear and significant decrease in CYP1A1 and CYP1A2 compared with the other three cell lines A549, H1703, and H2170.
「はじめに」で述べたように,筆者は,2007年4月1日に岩手医科大学に着任し,薬物代謝動態学講座を主宰して以来,遺伝子上の塩基配列の差異にはよらない薬物代謝酵素の変動要因に着目した研究を念頭におくこととした.縁あって当室の研究の協力者となって下さった教員スタッフの方々がそれぞれの専門性を活かして自由な発想で研究を展開された.筆者の研究グループが最初に携わったのはエピジェネティクス研究であり,岩手医科大学着任当日から薬物代謝酵素のエピジェネティクス機構による薬物代謝酵素の発現変動に関する研究に着手した.エピジェネティクスは,発がんやがんの進展の過程において,増殖している細胞において特に重要であると考えられることから,研究を遂行し易い培養がん細胞を用いることとした.また,エピジェネティクス機構に関する研究は,大腸がん細胞株を用いて展開させたのであるが,岩手医科大学に着任する以前に筆者が従事してきた研究は,なんらかの形でヒト大腸がんとの接点があった.本稿で既に述べたことであるが,筆者の研究の根底には「抗がん薬の効果を高める方法を模索すること」がある.この研究理念に沿って,本稿で紹介させて頂いた研究について考察してみたい.
エピジェネティクス機構の一つであるDNAメチル化の阻害剤DACを4種のヒト大腸がん細胞株に作用させると,0.5 µM及び5 µMでヒトCYP1ファミリーの一員であるCYP1B1の発現の顕著な上昇がみられた細胞株とそうではない細胞株が2系ずつに分かれた.5 µMの作用における発現上昇倍率でいうと,SW48細胞と,Caco-2細胞で,それぞれ約22倍,約8倍であった.それに対し,HT29細胞とHCT116細胞では,CYP1B1の発現上昇は認められなかった.AhRやARNTについては,これらの条件で,発現上昇はみられなかった.CYP1B1の発現を支えるAhRやARNTをコードする遺伝子の5′-上流側に隣接する領域内には目立ったCpGアイランドが存在しない.このことから,AhRやARNTをコードする遺伝子の5′-上流側に隣接する領域の脱メチル化が今回の結果と関連する可能性は少ないと考える.上記4系の大腸がん細胞株で2系ずつメチル化状態が大きく異なっていた箇所は,CYP1B1遺伝子の転写開始点より5′-上流1.5 kb以内の4つの領域に存在するおおよそ20–40ヵ所のCpGアイランド領域である.本研究では,岩手医科大学の倫理委員会の承認,並びに患者の書面による同意を得て40例の大腸がん患者のがん組織とがん組織周囲の非がん部につき,CYP1B1遺伝子のDNAメチル化状態を比較した.その結果,40検体のうちの2検体については,がん組織のみに培養がん細胞株について解析した箇所と同じ箇所でCYP1B1遺伝子のDNAのメチル化がおこっていた.大腸の非がん部組織にはDNAメチル化がおこっていなかった.現時点では全くの推測の域を出ないが,40例中2例のがん組織にのみみられた当該DNAメチル化は,大腸がんという疾患との関連があるのかもしれない.40例の大腸がん患者のうち,今回の研究で2例の患者のがん部にCYP1B1遺伝子のメチル化がみられたことの意義を明らかにするためには今後更なる研究が必要である.
以上の結果により,DACの大腸がん細胞への曝露後,CYP1B1遺伝子の特定の領域のCpGアイランドのシトシンのメチル化の解除によりCYP1B1のmRNAレベルの顕著な上昇がみられる細胞株とそうではない細胞株があることがわかった.すなわち,異なるヒト由来の大腸がん細胞株毎に,当該部位のメチル化がおこっている細胞株とメチル化がおこっていない細胞株があり,後者の細胞株に対しては,DNAメチル転移酵素阻害剤を曝露させても変化がみられなかったということを意味したが,初めてエピジェネティクス研究に携わった筆者にとって,よい意味でのサプライズであった.岩手医科大学の教員となる以前,いろいろなシトクロムP-450分子種の遺伝子多型の研究を行ってきた者には,塩基配列の差異によらない事象がシトクロムP-450の発現レベルに大きく影響することを目の当たりにした訳であり,とても新鮮に映った.一方,DNAメチル転移酵素阻害剤処理されたがん細胞の解毒的な代謝能が高まり,抗がん薬の効果が減少しまうのではないか,と危惧され,内心「そうはなってほしくない」とも感じていた.筆者の研究グループは,CPT-11とDACの併用によるCPT-11の効果への影響を調べる試みを行った.7)この実験研究の対象にした細胞種はHCT116とHT29とした.また,薬物への曝露時,これらの細胞のコロニー形成率をあまり低下させない濃度,すなわち細胞のコロニー形成率が少なくとも対照の50%,望ましくは80%以上になるような濃度から高い濃度へと設定するように努めた.Table 2に示したように,HCT116細胞では,抗がん薬CPT-11とDACそれぞれ単独で作用したときと両薬併用のときとを比較したとき,アポトーシス抵抗因子Bcl-2のタンパクレベルが併用時に大きく低下していた.それに対し,HT29では併用時であってもコロニー形成率の低下が単剤より強いことはなかった.これは,Fig. 1に描画したように,HCT116細胞でみられたCPT-11とDAC併用での殺細胞作用の増強の機序として深くかかわっているはずのBcl-2タンパクの量がHT29細胞では非常に低く,Western blot上検出限界未満であったことと関係していると思われる.HT29細胞そのものは,増殖速度が非常に遅い,あるいはコロニー形成率が悪いといったことは全くなかったので,Bcl-2がHT29細胞のプラスチックプレート上での生存や増殖に必須という訳ではなさそうに思えた.HCT116とHT29両細胞の結果を合わせて考察すると,単剤と比較してHCT116のコロニー形成率が,CPT-11とDACの併用で大きく低下した事象の機序に,Bcl-2タンパク質の大幅な発現低下が深く関連していると思われた(Fig. 1).7)
筆者の研究グループは,ヒストン脱アセチル化酵素阻害剤であるDEPと5-FUの併用による5-FUの効果の増強も見い出した.8) 5-FUの作用は,5-FUが細胞内での核酸代謝経路に乗った代謝を受け,がん細胞のRNAに取り込まれるか,がん細胞のDNA合成に必須なTYMS遺伝子によりコードされるチミジル酸合成酵素の阻害のどちらか,又は両方により,がん細胞はアポトーシスに陥る.当初はいわゆるターゲットジーンアプローチをとり,5-FUの作用と関連すると考えられる様々なアポトーシス関連遺伝子やDNA損傷応答に関連する遺伝子を研究のターゲットと想定した.これら遺伝子の発現レベルをリアルタイムPCR法により測定し,5-FU, DAC単剤よりもこれらの併用時に最も発現に対する影響が顕著となる遺伝子を探した.併用したときの発現変動が最も明瞭だった遺伝子は,がん抑制遺伝子と考えられているp21であった.p21の発現レベルが高いほど,がん抑制遺伝子としての機能が強く現れて細胞は死に至り易いだろうと考えられた.Figure 2に示した通り,5-FUとDEPを併用した際の薬剤の作用により,対照や単剤曝露よりも多くの細胞がアポトーシスに導かれていると思われた.実際,p21の発現上昇は併用において,最も顕著になっていた(Fig. 3).また,Fig. 4に示したように5-FUとDEPの併用時には,クラスIIのMHC遺伝子発現上昇がみとめられた.MHC遺伝子が消化器系の体細胞に発現して重要な働きをしているとは考え難いので,このような結果が得られるとは網羅的発現解析を行う前は全く想定していなかった.今回の結果は,両薬併用による殺細胞作用の増強時にはクラスIIのMHC遺伝子の発現が亢進するような遺伝子発現調節機構が働いていることを示している.筆者の研究グループは,大腸がん細胞にCPT-11とDACの併用時にBcl-2の明瞭な発現上昇を認めたことから,Bcl-2についても調べたが,無処理の場合のBcl-2のレベルを1.00としたとき,5-FU単独で約0.55, DEP単独で約0.75,併用ではほぼ対照と同様の1.00であり,DEP併用による5-FUの効果増強を説明できるような結果にはならなかった.5-FUとDEPの併用におけるMHCクラスIIの発現上昇と,アポトーシスとの関連の観点では,先行研究が存在する.インターフェロン(interferon: IFN)-γでヒト大腸がん細胞WiDr, Colo205, SW480, SW620細胞を処理すると,IFN-γ受容体を発現しているWiDR, Colo205細胞では,IFN-γ濃度依存的にHLA-DR発現細胞の全体細胞数に対する割合が顕著に上昇した.すなわち,HLA-DR発現細胞数の増加とIFN-γによる細胞増殖抑制作用との強い関連が明らかになった.20)細胞増殖抑制の増強とHLA-DRの発現亢進が随伴したことは,筆者の研究グループの殺細胞作用増強とHLA-DR等の発現亢進の結果と方向性の点で一致していた.
当室では,エピゲノミクスの過程を修飾する薬物として,DNAメチル化阻害薬とヒストン脱アセチル化酵素阻害薬を抗悪性腫瘍薬との併用実験に用いた.全く異なる過程を修飾する薬物であるので,がん細胞内でひきおこされる事象は全く異なることは当然であろう.また,エピジェネティクス修飾薬も正常細胞に対する毒性があるので,抗悪性腫瘍薬との併用は実験研究の立場ではともかく,臨床応用を考えると極めて難しいかもしれないが,今後もいろいろな角度から研究する余地があると思われる.
当室で行われた低グルコースストレスの研究は,CYP1ファミリーの発現レベルの亢進やVEGFの発現誘導を明らかにすることにつながった.VEGFはがん組織内の血管新生に必須なものであることも踏まえると,プラスチックプレート上に平面的に細胞を播種・増殖させる二次元培養を用いた研究だけではなく,三次元的な細胞塊を作って研究を行う方向へと進んでいったことは自然の流れであった.研究の流れの中でのもう一つの重要なポイントはCYP1ファミリーに属するP-450分子種の発現を支えるタンパク質AhRである.ヒト肝がん細胞HepG2, Huh7, JHH1を1000個の細胞からなる細胞凝塊の状態の三次元培養した場合,CYP1A1, CYP1A2ともに二次元培養時より発現レベルが上昇した.AhRのノックダウンは興味深い結果をもたらした.それは,三次元培養条件におけるHuh7とHepG2細胞凝塊内でCYP1A2の発現を支えているのはAhRではなくPXRであったという発見につながったことである.生体内で固形がん組織の細胞は言うまでもなく三次元的であり,生体内のがん細胞の状態により近い三次元培養条件の実験を行ったことになる.高密度培養システムの三次元培養系におかれた肝がん細胞は,細胞が高密度になって増殖停止相に達した方がVEGFの生産性が高く,がん組織中のがん細胞に類似した性質を示した.16)これら三次元培養系のがん細胞の性質をふまえ,CYP1ファミリーの誘導剤であるbenzo[a]pyreneを4種類の肺がん由来細胞株に曝露させたところ,一様に10倍程度のCYP1A1, CYP1A2, CYP1B1の誘導がみられた.これらの肺がん細胞についてAhRノックダウンを行った場合,4種類の肺がん由来細胞に対して一様にCYP1Aサブファミリーの発現レベルが有意に低下したというわかり易い結果にはならなかったが,AhRのノックダウンの実験の際,4種類の肺がん細胞株のうち,3つの細胞株のCYP1レベルは低下傾向ではあったが統計学的に有意な変動とはならず,1細胞株のみが統計学的な有意差をもって明瞭な発現低下をみせたことは,がん細胞の多様性を示している事象なのかもしれない.
筆者の研究グループは,岩手医科大学薬学部・薬物代謝動態学講座(現・薬物代謝動態学分野)において,エピジェネティクスの各種過程のうち,DNA脱メチル化酵素阻害薬を用いてシトクロムP-450分子種をはじめ,薬物動態に関係する多様な分子の発現上昇がおこることを明らかにした.また,DNAメチル化阻害薬や,ヒストン脱アセチル化阻害薬と抗悪性腫瘍薬を併用し,大腸がん細胞に対する抗悪性腫瘍薬の効果を高める研究を行った.また,肝がん細胞や肺がん細胞を三次元的に培養し,AhRノックダウンの実験も含め,より生体内に近い条件でのCYP1ファミリーの発現調節機構を再現させた.また,benzo[a]pyreneを作用させた肺がん細胞に対してAhRをノックダウンさせることにより肝がん細胞と肺がん細胞との間の発現抑制のおこり方に差異があることを明らかにした.
本総説にまとめた一連の研究は,遺伝因子によらない薬物動態関連遺伝子等の発現変動をとらえたものである.エピジェネティクス過程はヒトの体内で日常的におこっていることであり,少なくとも生存に必須なものである.ヒトを含め,哺乳動物を構成する細胞はほぼすべてが三次元的な環境におかれている.筆者の研究グループは,実験的に三次元環境に細胞をおくことで,二次元培養すなわち平面的な培養だけではとらえることができなかった現象を解析することができた.本稿で紹介させて頂いた各種遺伝子の発現変動をもたらした現象は,ヒトを含めた哺乳動物細胞の遺伝子発現変動のほんの一面にすぎないであろうが,クラスIIのMHC遺伝子の発現上昇,Bcl-2の発現低下,VEGFの誘導など,実験系を構築して結果が得られてみて初めて明らかになったことがいくつかあった.例えば5-FUとDEPを併用によるMHCクラスIIのmRNAレベルの上昇は,mRNA発現変動を網羅的に測定して初めてわかったことであり,網羅的発現解析を行うまでは全く予想していなかった.一連のin vitroの研究で観察していることは,お互いにかなり異なる観点での解析であるが,肝臓がんや大腸がんの細胞内でのシトクロムP-450等の発現変動機構の解析である点は共通しており,これらを一本の総説としてまとめる大変よい機会を頂いたと考える.
岩手医科大学薬学部・薬物代謝動態学分野において,本総説で紹介させて頂いた研究の実行に協力くださった教授・幅野 渉先生,講師・寺島 潤先生に厚く御礼申し上げます.また,臨床検体を用いた研究において多大なご協力を賜った本学医学部病理診断学分野教授・菅井 有先生に深く感謝申し上げます.
開示すべき利益相反はない.
本総説は,2022年度退職にあたり在職中の業績を中心に記述されたものである.