2023 年 143 巻 9 号 p. 729-744
2023 年 143 巻 9 号 p. 729-744
Cellular aging is one of the most extraordinary phenomena that mammalian cells undergo in vivo and in vitro. We have been observing their behavior for approximately 4 decades and here would like to summarize some of our salient findings. Normal cells such as human diploid cells exhibit finite growth potential in vitro as well as a set of senescent cell phenotypes. Those changes appear probabilistic and irreversible. In the search of the factor(s) to evoke the features we have observed that cellular glycosaminoglycan molecules plays significant roles in the cell physiology. Besides, CCAAT-box binding transcription factor NF-Y relates to the aging-coupled changes in gene expression, and aging of gastric mucosal cells may relate to a decrease in cytoprotection. As to the intracellular signaling, we have confirmed that the breakdown of phosphatidylinositol bisphosphate is critical for mitogenesis by using micro-injection of its antibody. Subsequently, we have discovered a novel, pivotal adaptor protein Grb2/Ash, a missing link between the receptor tyrosine kinases and their downstream target Ras. The limiting factors for the cellular life span have been considered as telomere shortening and accumulation of cellular and genomic damages. We have observed that telomerase-expressing cells exhibit expanded division potential; yet oxidative stress similarly induces senescent cell phenotypes. Herein we have demonstrated that the treatment of senescent cells with nicotinamide or related reagents elicits unique cellular responses, which might indicate the capability of the cells to recover from the aging.
1974に薬学部を卒業して以来,2022年の今日までいくつかの研究場面に身を置き,細胞というものに触れてきた.振り返ればいつのまにか40年以上が過ぎたことになる.かつては薬学部といえば化学系の研究が中心だったと思われるが,東京都に設置されて間もない老人総合研究所(老人研)に配属されたことによって私には馴染みの少なかった細胞とのお付き合いが始まることになった.配属されたのは室田誠逸先生,三井洋司先生,腰原康子先生などが動かしていた薬理学部で,室田先生・腰原先生はエイコサノイドを,三井先生は細胞老化を研究されていた.私は主に三井先生の指導を受け,右も左もわからない細胞生物学,細胞老化の研究を齧ることになった.その後の組織の改変によって当研究室は竹縄忠臣先生主宰の生体情報研究部門となり,追って古川 清先生主宰の糖鎖生物学の研究室となったが,私は主にヒト培養細胞を用いた細胞老化の検討を続けていた.その間,豪州ニューサウスウェールズ大学病理学部でGarry J. Smith博士主宰の発がん研究ユニットで細胞の化学発がんと遺伝子工学を学び,米国ラトガーズ・ニュージャージー州立大学化学・化学生物学科,K. Y. Chen教授の研究室で細胞老化の研究を行う機会を頂いた.ラトガーズ大学では,細胞老化におけるNF-Y転写調節因子,テロメア,レスベラトロール関連化合物の係わりについて調べ,引き続いて,千葉科学大学薬学部にて佐々木啓子教授と細胞老化・分化におけるスチルベン新規類縁体・ニコチンアミド類,ホスホイノシチド3キナーゼ(phosphoinositide 3-kinase: PI3K)の作用の分析を行ってきた.今思い起こして何をなし得たかと考えてみて,きちんとした結果にまとめられたものがほとんどないのが残念であるが,細胞老化を巡る現象について断片的ながら多少の知見を付け加えてきたとは言えるかもしれない.ここにその一端を紹介させて頂く.なお,以下の文章では,論文等で発表した内容のあれこれをある程度引用したが,部分的に省略したり,順不同なところがあったりしてわかり難い部分があると思われるが,御寛容頂きたい.
よく知られているHeLa細胞の場合のように,細胞は適切な環境で維持されれば人為的な培養系内で無限に生存できると考えられている.4)私が老人研で最初に接したのはWI38, IMR90, TIG-1などの正常ヒト2倍体細胞だった.正常細胞とよばれる細胞株の特徴のひとつは,(シャーレの表面のような)2次元培養系内では細胞どうしが密に接触する(コンフルエントになる)と増殖が止まる[Figs. 1(a)–(c)].1–3,5)増殖の接触阻害とよばれる.悪性腫瘍由来細胞などのようにがん化すると程度の差はあるが接触阻害から逸脱した細胞増殖が観察される[Figs. 1(b),(c)].もうひとつは,培養系内で加齢変化をみせることである[Figs. 1(a),(d)–(f)].1–3)有限の増殖,細胞分裂の後に増殖を停める,ヘイフリック限界と呼ばれる性質を持っている.4,6)

(a) Normal cells at higher PDLs become more gigantic in the cellular and nuclear sizes.1) (b, c) Normal cells (b: left panel; c: ○) exhibit contact inhibition, while transformed cells (b: right panel; c: ●) do not. (d) When normal cells age, the growth rate (□) and saturation cell density (●) decrease.2) (e–g) When normal cells age, the cell growth and DNA synthesis rates decrease.2,3) (h) Schematic diagrams of early passage (young) cells and late passage (aged) cells. Aged cells are heterogenous, comprising small and gigantic cell populations. (i) When WI-38 cells are fractionated by the cell size (fr.1, largest; fr.10, smallest; control, unfractionated) and cultured up to senescence, they exhibited similar life spans, irrespective of the cell sizes. Parts of this figure are adapted from Refs. 1–3 and modified/abridged for this review article.
適切な培養条件下では,これらの細胞は概略18時間程度で分裂して細胞数が倍加する[Figs. 1(c),(e)].2,3)細胞株を培養系内に導入してから平均的に何回分裂したかをもって細胞の「齢」と考え,population doubling level(PDL)と表現する.ヒト胎児由来線維芽細胞の例では約50–70 PDLで増殖能力がほぼ失われ,飽和細胞密度,細胞分裂速度がほぼ直線的に低下する[Fig. 1(d)].2)このときの細胞の形態をみると,細胞全体や細胞核が大きくなること,サイズの大きさが不均一になることがわかる[Figs. 1(a),(h)].1,3)その細胞の増殖の様子をタイムラプス観察で記録すると継代早期細胞(便宜的に早期細胞,若い細胞とする)はほとんどが小さい細胞からなるのに対して継代が進むと次第に大きい細胞,巨大な細胞(便宜的に後期細胞,老化細胞とする)が現れてくる[Figs. 1(a),(h)].場合によってはDNA含量からみて4倍体,8倍体になっているものがある.このような細胞は増殖が止まることが多いが,小さい細胞の集団と大きい細胞の集団それぞれを分離して継代培養するとほとんど同じ分裂回数を示したので,分裂寿命は細胞集団の確率的な挙動と考えられる[Fig. 1(i)].それを反映しているとみられるのは増殖刺激を与えてS期に入る細胞の割合をプロットすると対数的に直線グラフになっていることである[Fig. 1(g)].2)以上の観察によって,培養系内の加齢に伴う変化は細胞集団が時間の経過,あるいは分裂の繰り返しにおいて被る確率的な現象であることが示された.
昨今の老化研究の進捗により細胞が「年をとる」という現象の分析が進んできた.ここでは,私が細胞老化に興味を惹かれて調べ始めた頃の研究によって報告されていた知見に関連する実験について記したい.上に述べたように細胞には若い細胞と老いた細胞があるが,何がどう違うのかというのが私の素朴な疑問であった.接触阻害については先駆的なAbercrombieの研究5)などから細胞間の相互作用が注目されていたが,その現象から細胞どうしの接触が増殖の調節に関与していることが疑われた.ならば,そこに関係しているのは細胞表面に露出している分子だと考えられる.そこで,細胞どうしを接触させてその影響をみたところ,早期細胞と共培養した後期細胞はDNA合成する細胞が増加した[Fig. 2(a)].3)そこでどんな分子かを決めるための試みとして,シャーレ上に播いて密に増殖した(コンフルエント)細胞層をグルタルアルデヒド(glutaraldehyde: GA)で固定してシートを作り,そこに生きた細胞を播いた.7)早期細胞,後期細胞を用いて固定された細胞層をそれぞれ作製し,それぞれに早期細胞,後期細胞を播種して影響をみると,GA固定細胞は増殖に抑制的に作用した.しかも,早期細胞より後期細胞で作ったシートの方が作用が大きかった[Fig. 2(b)].一方で,後期細胞シート上で培養した細胞に対しては早期細胞と後期細胞は同程度の増殖低下がみられた.つまり,細胞シート上の増殖抑制因子は老化細胞でより富んでおり,それに対する感受性は早期細胞,後期細胞で大きな差はないということであった.細胞表面の生理活性分子については糖脂質,糖タンパク質など種々の複合糖質が候補として挙げられていたが,当時の私たちの研究室で分析されていたグリコサミノグリカン(glycosaminoglycan: GAG)について調べることにした.まずは除いてみようということで,各GAGの消化酵素や分解試薬を用いて,その影響をみると,GAGのうちのヘパラン硫酸(heparan sulfate: HS)除去の効果が最も大きかった[Fig. 2(c)].7)細胞シートによる増殖抑制はGA固定でははっきりみられるが.過塩素酸処理ではほとんど失われる.このときの細胞シート上のGAGのうち,80%以上のHSがなくなっていたので,HSがここにおける増殖抑制作用の主な分子であると当たりをつけた.実際,いくつかの生体材料からHSを調製して細胞に作用させると.細胞の形態,移動度,増殖様態に変化がみられた[Fig. 2(d)].その際,電気泳動による分析で調べて硫酸基含量の多いサンプルの方が増殖の抑制が大きく,また,いわゆる正常細胞では増殖抑制がみられるのに対し,形質転換したがん細胞では増殖はむしろ促進されることが観察された[Figs. 2(e),(f)].8)
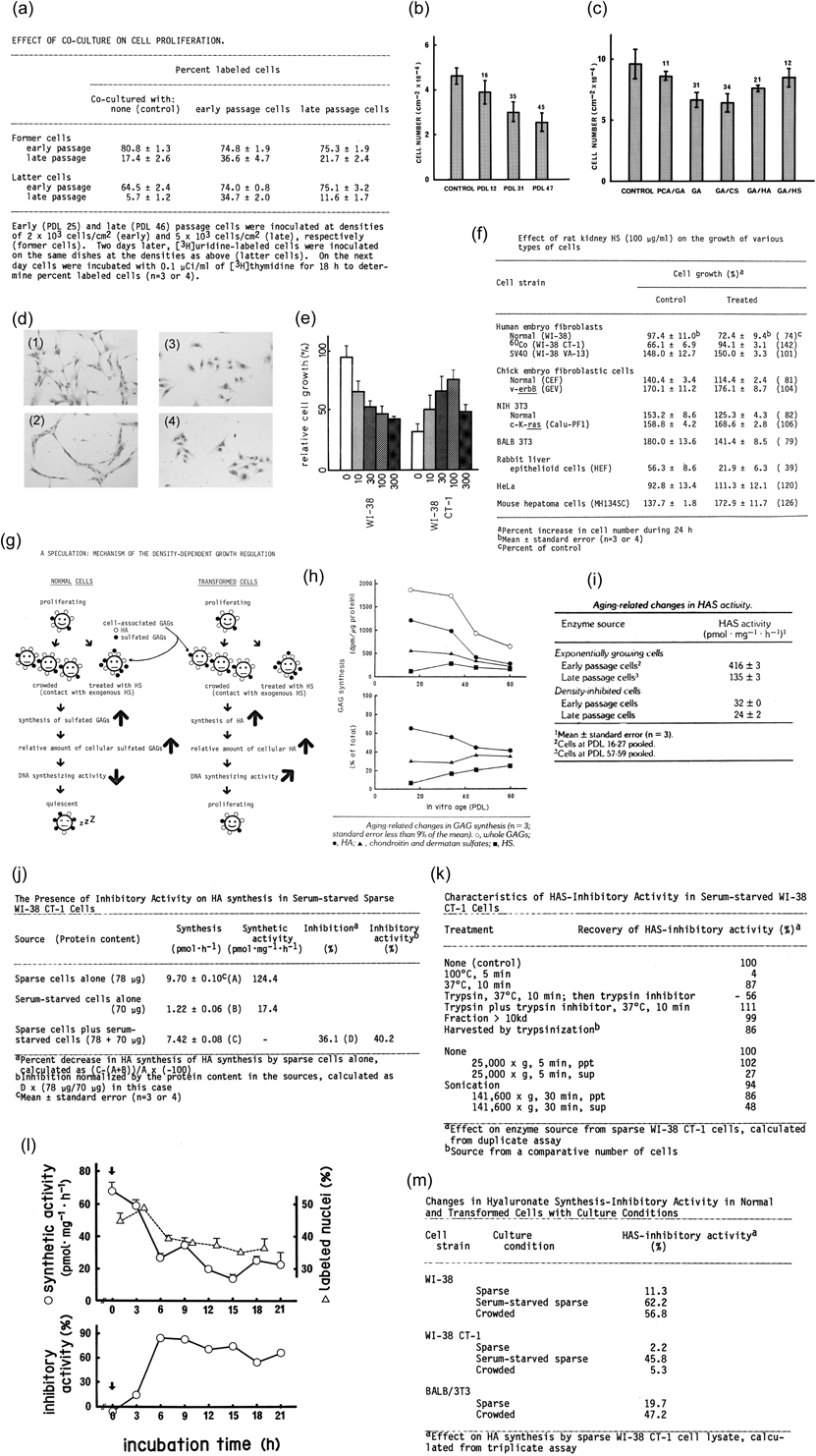
(a) Proliferation of late passage (aged) cells (WI-38 normal human fibroblasts) is substantially enhanced by co-culture with living early passage (young) cells.3) (b) Fixed cell sheets prepared with aged cells are more efficient in suppressing cell growth.7) (c) Fixed cell sheets subjected to glycosaminoglycan-degrading treatments. HS removal is more efficiently reduced growth suppression.7) (d) WI-38 cells (normal: 1, 2) and (CT-1, transformed: 3, 4) are exposed to exogenous HS (2, 4). HS-treated normal cells exhibit aberrant morphology/motility. (e, f) When treated with exogenous HS, normal cells are growth-suppressed, while transformed or tumor cells are growth-enhanced.8) (g) A speculated mechanism for growth reduction in aged or density-inhibited cells. (h, i) Aging-related changes in GAG synthesis. Hyaluronic acid synthesis (HAS) activity is reduced in aged cells and in density-inhibited cells.2) (j, k) Presence of HA synthesis-inhibitorary activity (HASI) in serum-starved WI-38 CT-1 cells.9) The HASI is inactivated by heat or trypsin. (l) When WI-38 CT-1 cells are serum-deprived at 0 time (arrow), HASI is induced several hours later, concomitantly with a decrease in DNA synthesis and HAS activity.9) (m) HASI is expressed in serum-deprived normal and transformed cells and density-inhibited normal cells, but not in dense transformed cell culture.9) Parts of this figure are adapted from Refs. 2, 3, 7–9 and modified/abridged for this review article.
ここで働いている要素のひとつが細胞密度である.細胞密度が低く,細胞どうしの接触が密になっていないときには,正常細胞はHS処理によって増殖抑制がみられ,一方,上記のように形質転換した細胞株の場合はHS処理は増殖促進的な作用を示した.ところが,細胞密度が高い培養系では正常細胞,がん化細胞はどちらも増殖の変化が起らなかった.8)ひとつの可能性としてはHSとの接触は細胞どうしの接触を模倣した反応を引き起こすのかもしれない[Fig. 2(g)].しかも,それは増殖だけでなく,細胞の運動でもみられるようだ[Fig. 2(d)].図にあるように,正常細胞は添加HS存在下では細胞の運動が制限されているようにみえるが,がん化細胞ではそのような変化は目立たなかった.
以上の観察はHSの生理活性を示すものであるが,細胞の複合糖質といってもGAGだけでもHS以外に多様な分子種が存在する.大まかな分類でみるとhyaluronan(HA),chondroitin sulfate(CS),そしてHSとなる.これらの合成量の変化をみると,加齢に伴い全GAGのうちのHSの割合が大きくなること,逆にHAの割合が小さくなることがわかった[Fig. 2(h)].2)このことが増殖活性の変化を引き起こしているのではないかと推測された[Fig. 2(g)].これを合成活性(細胞タンパク質あたりの合成速度)という表現にするとHA合成は細胞が早期から中期に進んだ段階で急速に落ち込むことがみられ[Fig. 2(i)],2)ここにはHA合成に係わる要素に何か特別な変化が起こっていると考えられた.HA合成活性の低下は正常細胞WI-38だけでなく,形質転換したWI-38 CT-1でも血清濃度を下げて増殖を抑制するとみられたので[Fig. 2(i)],その正体(HA合成阻害活性)を知りたいと思い,cell-free系HA合成システムをつくり,そこに分画したり,熱,酵素,阻害剤等の処理をした各細胞成分を加えてみてHA合成抑制活性があるかどうかを調べてみた[Fig. 2(j)].9)この活性は細胞サンプルを加熱したり,トリプシン消化をしたりすると失われる[Fig. 2(k)].また,actinomycin D, cycloheximide等,RNA合成阻害,タンパク質合成阻害により低下した.ひとつの現象として,HA合成阻害活性が大きいとDNA合成が低下した[Fig. 2(l)].このことからHA合成は細胞増殖と密接に関連していることが明らかになったが,この時点では具体的な正体の解明には至らなかった.ただ,WI-38 CT-1では細胞密度が高くなってもHA合成抑制活性は上がらず[Fig. 2(m)],9)接触阻害からの逸脱を示す現象に細胞表面複合多糖が関係していることが確認できた.
なお,これら複合多糖の生理的な働きについてはいろいろと分析する必要があると思われるが,GAG/プロテオグリカンは骨基質の成分としても重要である.例えば,私たちが調べたものでは,重度の骨粗鬆症患者の海綿骨では健常者に比べてchondroitin 4-sulfateの量・割合が少なく,HA, dermatan sulfateは増加しており,この変化が骨粗鬆症の進行に関係している可能性がある.10)このように,複合糖質は細胞生理において無視できない機能を担っていることがうかがわれる.
ご存知のように,胃は強烈な酸と消化液に不断に曝されており,極めて傷害を受け易い環境下に置かれている.しかし,その表面の胃粘膜はムチン等の粘液物質を含み,より中性~アルカリ性の胃粘液に覆われており,その働きにより傷害の程度を小さく抑えることが可能になっている.14,15)今日ではその胃粘膜の保護に働く防御因子としてプロスタグランジン(prostaglandin: PG)などのエイコサノイドが重要であることが明らかになっているが,1980年代初頭に遡ると,エイコサノイドの生合成の研究が進み,1982年のノーベル賞はPGの研究者たちが受賞した.当時都老人研の当研究室ではPGの生合成を調べており,生体組織で合成される新規なPG分子6-ketoprostaglandin F1α(6kPGF)という分子種を検出していたが,のちにこれは不安定なprostaglandin I2(prostacyclin)の代謝産物であることが明らかにされた.私は細胞老化という観点からの仕事で,隅っこで関係させて頂いただけだが,当時の研究室の共同研究で使用していたウサギの胎児の胃組織[Fig. 3(a)]から粘膜上皮細胞を単離して培養することを試みていた.結合組織あるいは平滑筋由来とみられる間葉系細胞の増殖の勢いが強かったが,試行錯誤して胃粘膜表皮細胞とみられる上皮系細胞をなんとか培養系に移すことができた[Figs. 3(b),(c)].11)種々の染色法で調べると,これは胃粘膜を構成する主細胞,壁細胞,頸部粘液細胞,表層粘液細胞等が混在した細胞集団であった[Fig. 3(d)].この細胞層をエタノールで洗うと不溶化した成分が剥離してきて,細胞表面が粘液様物質で覆われていることがわかり[Fig. 3(e)],ムチカルミン染色でも粘液様物質がみられた.この細胞を培養系内で継代を行っていくと接触阻害を示す単層を形成したが[Fig. 3(f)],約20代でいわゆる老化形質を発現して増殖しなくなった[Figs. 3(g),(h)].また,維持する培地に加える牛胎児血清を子牛血清に変えても同様に老化した.当時,胃粘膜ではPGを産生して組織が保護されていると考えられていたので,この分離細胞について調べると,強いPG合成活性をもっており,主にプロスタグランジンE(prostaglandin E: PGE),6kPGFが作られていた[Fig. 3(i)].ということで,PGと粘液様物質を産生する胃粘膜細胞が得られたので,今度はこの細胞は胃酸に対する抵抗性を示すのだろうかということを調べることにした[Fig. 3(i)].12)細胞をカバースリップ全面に培養し,洗ってからpH 3に合わせた培地に変えて,一定時間インキュベートした.ついでクリスタルバイオレットで染色,洗浄して標本を得た.この条件下では細胞の核と細胞質はごく薄くピンクに染まる.pH 3での処理を長くすると細胞は完全に固定され,核と細胞質の染色が濃くなって変性が顕著に観察されるようになるので,時間を追って固定された細胞の割合が測定できる[Figs. 3(i),(j)].継代中期PDL8の胃粘膜細胞の例では,実験回によって変動はあるが,酸性処理18分頃から固定される細胞が現れ,24分を過ぎると多くの細胞が固定された.ちなみに,老化した胃粘膜細胞では18分を過ぎると多くの細胞が固定された.また,継代中期のヒト線維芽細胞は酸性処理12分あたりで固定されたので,明らかに胃粘膜細胞よりも酸に対する抵抗性が小さかった[Fig. 3(j)].次に,胃粘膜に傷害を起こすことが知られているアセチルサリチル酸(acetylsalicylic acid: ASA),また胃粘膜保護作用のあるPG類(PGE2+PGI2)で細胞をあらかじめ処理しておいてその影響を調べると,ASAは対照群より7分程度,ASA+PGは対照群より4分程度短い酸抵抗性を示したので,ASAは耐酸性を低下させること,PG類はASAの作用を一部回復させることがわかった[Figs. 3(k)–(m)].また,このときの細胞内のcyclic AMPの濃度をみると,ASAによる低下,PG類による上昇がみられ,これが胃粘膜細胞の酸抵抗性に関係していることが窺われた[Fig. 3(m)].13)以上,胃粘膜細胞の培養系を用いることにより,老化,薬物処理による胃粘膜の酸に対する抵抗性を可視化することができ,薬物治療に向けた材料として利用できる可能性が示された.

(a) A rabbit embryonic stomach specimen. (b) A primary culture of gastric mucosal cells (phase-contrast image). (c, d) Purified epithelial cell fractions (c: Giemsa stain; d: Azan stain). (e) The cells produce mucous materials, visualized upon ethanol treatment. (f, g) Established gastric cells (f: early passage, young; g: late passage, aged). (h) Saturation cell density decreases during aging. (i) Bottom: The cells produce PGs (mainly PGI and PGE). Top: Cells are fixed and stained with crystal violet, when treated at pH 3 for varying time intervals. (j) Young gastric cells are more resistant to the acid treatment than old cells or fibroblastic cells. (k) ASA treatment turns the cells vulnerable. (k–m) Treatment with PGs, cyclic AMP derivatives and a gastric protectant exerts cell protection. PGs stimulate cyclic AMP production. Parts of this figure are adapted from Refs.11–13 and modified/abridged for this review article.
都老人研の組織替えにより,所属している研究室は竹縄先生主宰の生体情報研究部門となり,私は細胞老化について分析を続けていたものの,PIを材料として進めることとなった.PI代謝には,主なところではホスファチジルイノシトールPI,ホスファチジルイノシトール4-リン酸PI(4)P,ホスファチジルイノシトール4,5-ビスリン酸PI(4,5)P2(あるいはPIP2)という修飾(便宜的にA経路とする)と,PI,ホスファチジルイノシトール3-リン酸PI(3)P,ホスファチジルイノシトール3,4-ビスリン酸PI(3,4)P2,ホスファチジルイノシトール3,4,5-トリスリン酸PI(3,4,5)P3という修飾(便宜的にB経路とする)がある[Fig. 4(a)].コンフルエントで細胞増殖が抑制されたとき,及び細胞が老化したときの各種PIの量を比べると,PI(4)P, PI(3)Pの相対量はあまり変化していなかったが,リン酸化が進んだ分子種,PI(4,5)P2,PI(3,4)P2の割合は相当低下していて,細胞増殖とPI代謝がつながっていることが窺われた[Fig. 4(b)].16)

(a) Major inositol phospholipid species (IPs). Their main metabolic turnover is serial phosphorylation and breakdown into the second messengers IP3 and DG. (b) Changes in the IP contents during aging and cell growth. Declines in PI(4,5)P2, PI(3)P and PI(3,4)P2 are distingushed in growth-reduced (aged and confluent) cells.16) (c) Effects of anti-PI(4,5)P2-antibody on metabolic breakdown of PI(4,5)P2. A: preimmune antiserum, B: low dose antibody, C: high dose antibody. Incubation with the anti-PI(4,5)P2-antibody effectively suppressed PI(4,5)P2 breakdown, with no effect on PI(4)P breakdown.17) (d) Micro-injection of anti-PI(4,5)P2-antibody (●) into fibroblasts suppressed cell proliferation. ○, non-immune immunoglobulin G (IgG). (e) Effect of injection of the anti-PI(4,5)P2-antibody into growth-unstimulated cells (○), PDGF-stimulated uninjected cells (●) and PDGF-stimulated antibody-injected cells (▲).17) (f) Injection of the anti-PI(4,5)P2-antibody abolishes mitogenic effects of PDGF and bombesin to the control unstimulated level, but has no effect on serum, insulin, EGF or FGF. There is no difference between the antibody injection 2 h before and the injection after PDGF treatment.17) Parts of this figure are adapted from Refs.16–19 and modified/abridged for this review article.
まず,A経路について調べたことをみると,当時分析が進んできたPI代謝研究の結果から,増殖因子などで刺激をすると細胞内のPI(4,5)P2がホスホリパーゼC(phospholipase C: PLC)の働きによってジアシルグリセロール(diacylglycerol: DAG)とイノシトール1,4,5-トリスリン酸(inositol trisphosphate: IP3)に開裂(加水分解)し,これらがそれぞれ細胞内シグナル伝達分子として機能することが示唆されていた.私たちはそれを確認するためにPI(4,5)P2の抗体を用いてPLCの作用を阻害したらどうなるかを調べた[Figs. 4(c)–(f)].17)その結果,種々の増殖刺激因子のうち,PIP2を開裂させる作用を示す血小板由来増殖因子PDGF,ボンベシンによる増殖促進作用は抗PI(4,5)P2抗体によって抑えられ,PIP2を開裂させる作用のない血清,EGF, FGF,インスリンの増殖促進作用は抑制されなかったことから,PIP2の開裂が増殖促進作用と深く連動していることがはっきり示された.なお,増殖誘導に関してはIP3よりはDAGの方が主に働いていた.18)また,血清存在下の正常細胞に対しては抗PI(4,5)P2抗体の増殖抑制はみられなかったが,ある種のがん遺伝子で形質転換した細胞株に対しては抑制的に作用した.19)これもPI代謝が亢進している状態と細胞増殖の連動を示唆している.ではPI代謝が活性化されているというのはどういうことなのか,ということが次の実験の方向となる.
一方,B経路では,PIの3位をリン酸化するPI3Kの働きが注目されていた.PI3Kは多様なサブタイプを持つ酵素ファミリーをなしているので,それらの働きの個性が気になるところである.20,21)今日調べられている結果に則っておおまかに述べると,クラスIAはPKB/AKTを活性化して細胞増殖に関連が強く,クラスIBは免疫機能に,クラスII,クラスIIIの働きは十分に明らかにはなっていないが,細胞内小胞輸送やオートファジーで働いているとみられている.細胞の状態による各タイプのメッセージの相対比を比べてみたところ,多くのサブタイプはがん細胞において発現が亢進していた.老化に関しても,やや発現が増加する傾向がみられた.16) PI3Kサブタイプの発現変化が老化等の細胞機能に関係している可能性はあるが,現時点でわかっている知見では細胞増殖・がん化との係わりが中心のように思われる.
上記のPI代謝ではPIP2のPLCによる分解が中心的な反応となっている.これがどのように活性化され,調節されるのかという研究が世界的に急速に進行している時期で,私たちもそれを明らかにしたいと考えていた.22)ここで鍵となっているのが「ドメイン」である.タンパク質などの分子は機能を持った構造物が組み合わさって働いている.PI代謝や増殖に係わる因子を調べると特徴的なドメインをもっていることがわかってきた.23)例えば,ラウス肉腫ウイルスなどのがんウイルスをみるとよく似たがん遺伝子を持っていて,チロシンキナーゼがコードされている.この配列をsrc homology 1(SH1)ドメインとして,その周囲の配列を比較すると別のタイプのドメインを持つことがわかり,src homology 2(SH2)ドメインと呼ばれるようになり,またPLCのサブタイプPLCγにはSH2の他のドメイン,SH3がみつかった[Fig. 5(a)].SH1の働きはわかるが,SH2, SH3は何をしているのかという疑問がおこる.1990年前後にはsrc homologyを調べても10–100論文が検索される程度だった[Fig. 5(b)].そもそも増殖因子の刺激はどうやって細胞内へ,それから核へと伝わっていくのかさえわからない時期であった.私たちはPI代謝研究の流れから増殖因子からPLCへとシグナルが伝わる仕組みを調べることにしたが,がん遺伝子の周辺のあちこちにあるSH2ドメインを持つ分子が怪しいと思われた.そこで,SH2含有分子の配列を並べてみて,類似性の大きさの目立つ部分から28塩基,8アミノ酸,縮退度432の配列のプローブを作り,ヒト線維芽細胞,ラット線維芽細胞,ラット脳のcDNAライブラリーをスクリーニングした[Figs. 5(c),(d)].得られたポジティブシグナルを選別して,共通の配列をクローニングしてシークエンスを調べたところ,みつかったもののひとつは新規な分子でSH2ドメイン1つ,SH3ドメイン2つからなる25 kDaの小さなタンパク質であった[Figs. 5(e),(f)].22)私たちはabundant src homology(ASH)という名前をつけたが,1992年のほぼ同じ時期に他のグループからも線虫(SEM-5),ヒト(GRB2)の分子が報告された.24)この発見の価値は,この分子がこれまでわからなかった増殖因子受容体からRasタンパク質をつなぐミッシングリンクだったことである.これによって細胞増殖を制御している細胞内シグナル伝達系の姿がかなりはっきりみえてきた.私たちはGrb2/Ashに対する抗体を作って細胞に注入する実験によって,この分子がEGF, PDGFによる増殖刺激を阻害すること,低分子量GTP結合タンパク質Ras, Racのシグナルに働いているが,Rhoには働いていないことを示した[Figs. 5(g),(h)].25)今日では,ここで発見されたアダプタータンパク質Grb2/Ashはどんな細胞内シグナル伝達マップにもみられる,様々なシグナルを細胞膜受容体から下流につなげる重要な中継分子であることが明らかになっている[Fig. 5(i)].26)なお,そのほかに私たちは他の関連分子を探す目的で酵母two-hybrid法により別のアダプター分子NCKのSH3ドメインに結合する分子の検索も行ったが,ここでみつかったNAP4はサイトカインシグナルに関係するSOCS7と同じ分子種であった.27)
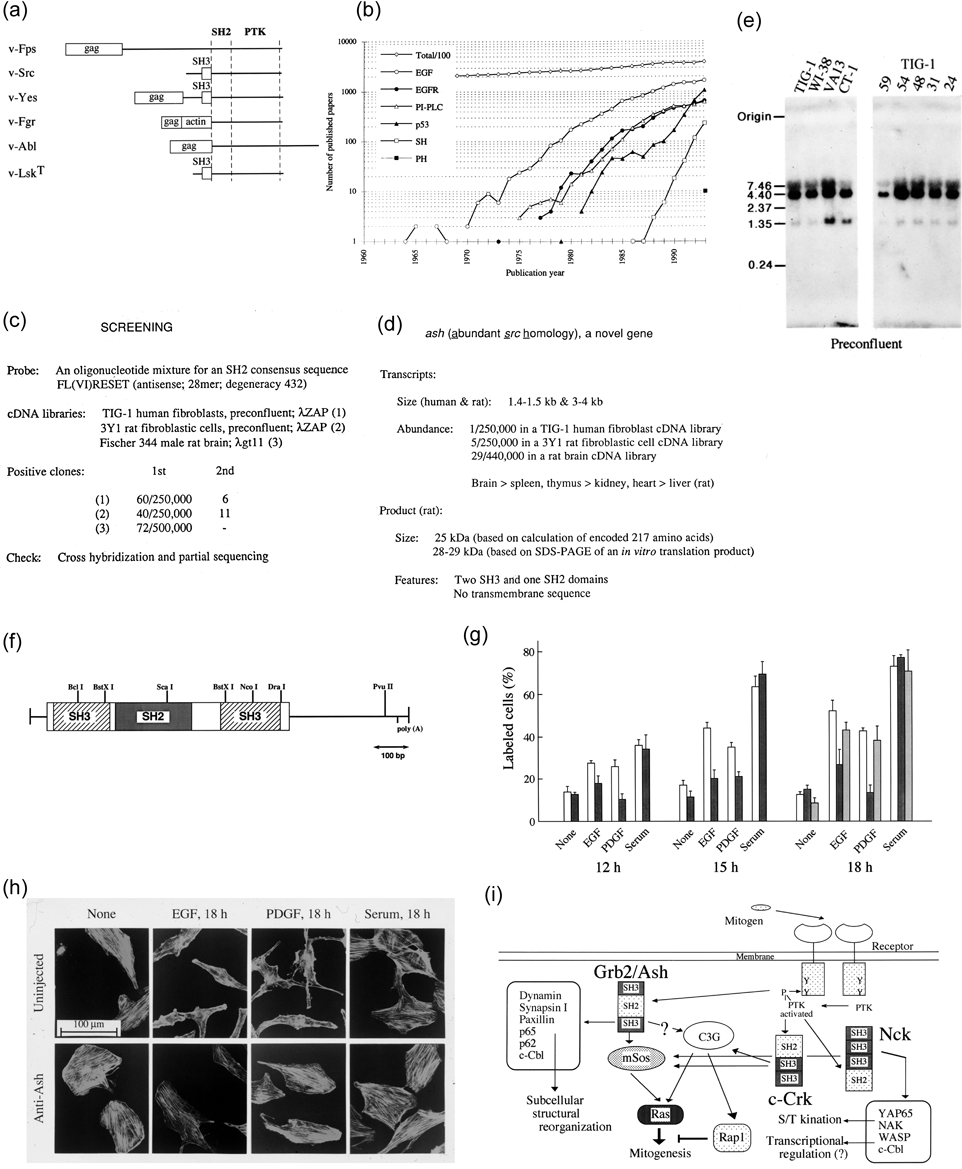
(a) Presence of SH domains in oncogenic viral proteins.23) Besides the catalytic tyrosine kinase domain, SH2 is localized in most of them and SH3 is in some of them. (b) SH is recognized in the literature first in 1988 and the number of related papers increases to 100–200 in several years. (c, d) Screening of phage cDNA libraries with consensus SH2 sequence FL(VI)RESET resulting in finding of several positive clones. (e, f) They encode 1.4–1.5 kb and 3–4 kb transcripts, comprising 217 amino acid with one SH2 and two SH3 domains.22) (g, h) Injection of anti-Ash antibody into NRK49F fibroblasts abolishes mitogenic effects of EGF and PDGF, but does not affect that of serum.25) (i) A schematic diagram of intracellular signaling networks involving SH-baring adaptor proteins Grb2/Ash, Nck and Crk. Parts of this figure are adapted from Refs. 22, 23 and 25 and modified/abridged for this review article.
その後,細胞老化と転写制御因子NF-Yの解析を進めていたラトガーズ・ニュージャージー州立大学のChen教授の研究プロジェクトに参加する機会を頂いた.NF-YはCCAAT boxを認識するヘテロ3量体タンパク質で,数々の遺伝子の発現に関与している[Figs. 6(a),(b)].28)特に細胞増殖の進行に係わるG1/S遺伝子の相当数がCCAAT boxを持ち,NF-Yの調節を受けている.その中でも重要なのはE2F1遺伝子で,種々のG1/S遺伝子はE2F部位を有し,E2F1により調節されている.したがって,G1/S遺伝子はCCAAT boxを介してNF-Yに,そしてE2F部位を介してNF-Y → E2F1という調節を受けている[Fig. 6(f)].29) NF-Yの発現は,細胞老化に伴い,タンパク質レベルでNF-YAの減少がみられた.また,Cockayne, Wernerという早老症でもNF-YAタンパク質は減少していた[Figs. 6(c),(d)].一方,NF-YBとNF-YCには顕著な変化はみられず,NF-YAのメッセージの変化もわずかだった.30)このような変化によってNF-Y三量体の働きはどうなるのか,という点については次の仮説が考えられる[Fig. 6(e)].早期細胞においては細胞内の状態は「還元的」であり,NF-YBとNF-YCがヘテロ二量体を作り,そこにNF-YAが結合したヘテロ三量体がプロモーターに結合して転写因子として働く.もしNF-YAの量が減少していると三量体,つまり転写因子が作られない.老化細胞では細胞内の状態は「酸化的」なので,NF-YBは分子内ジスルフィド結合ができてしまうためNF-YCとヘテロ二量体を作れない.NF-YAはNF-YB·NF-YCに結合できないので分解されてしまう.老化細胞でNF-YAが減少する理由のひとつはこういうことなのかもしれない.
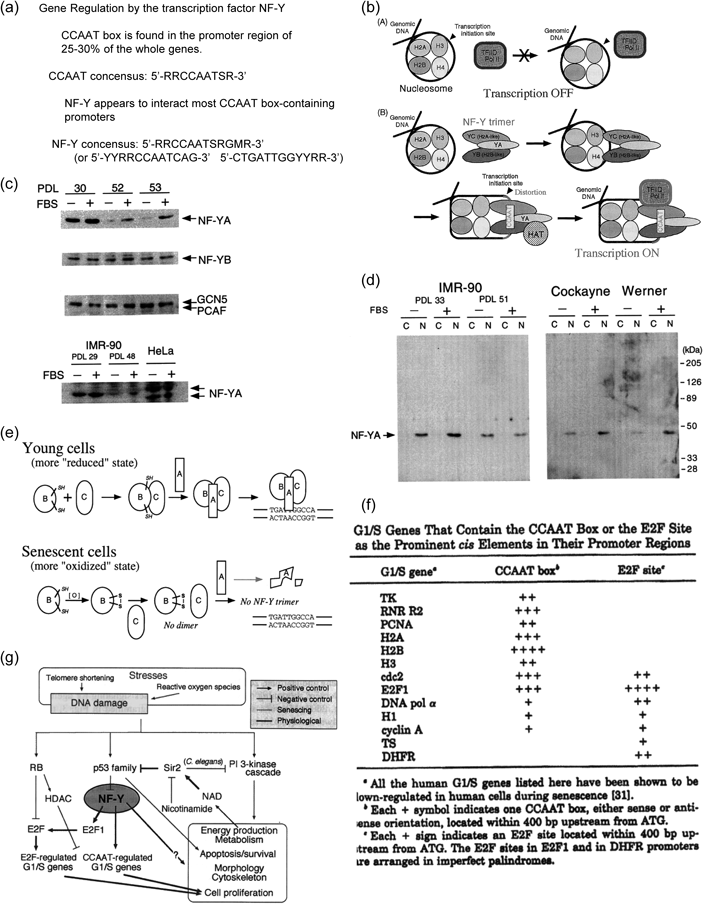
(a) Consensus motifs for NF-Y.28) (b) Schematic interaction of NF-Y with the nucleosome. (c, d) Changes in NF-Y protein expression in aging and progeria cell strains. NF-YA expression increases upon growth stimulation with serum and is lowered in aged cells and progeria cells.30) (e) Speculative diagram for the decrease in NF-YA protein. (f) A number of important cell cycle-related genes contain CCAAT boxes and E2F sites. As E2F1 itself has CCAAT boxes, E2F-regulated genes are also controled under NF-Y.29) (g) Hence, NF-Y plays pivotal roles in the regulation of cell growth, survival and aging. Parts of this figure are adapted from Refs. 28–30 and modified/abridged for this review article.
細胞の老化を引き起こす要因として広く受け入れられているものに酸化ストレスなどによる細胞/ゲノム傷害の蓄積,そして細胞分裂を繰り返すたびに起こるテロメアの短縮がある[Fig. 7(a)].31,32)プロジェリアなど早老症の場合はゲノム修復関連遺伝子の変異が関与している場合が多いので,前者の範疇になろう.さて,これまで積み重ねてきた実験の結果を合わせてみると,正常細胞について,早期細胞を低濃度の過酸化水素に晒すと,後期細胞と類似の細胞形態を示すようになる[Figs. 7(e),(g)].33) MAPキナーゼ活性化剤C6-ceramide,ヒストン脱アセチル酵素阻害剤trichostatin Aについても同様な変化がみられた.一方,テロメラーゼを発現している正常細胞は分裂寿命が顕著に延長した[Fig. 7(b)].通常50–70 PDLで増殖速度の低下,細胞形態の肥大,老化細胞特異的βガラクトシダーゼ(senescence-associated beta-galactosidase: SA-gal)活性等の老化形質が発現するところであるが,ある実験例では,テロメラーゼ発現細胞は400 PDLになっても形態,増殖能など一見早期細胞のような状態を維持していた.では,テロメラーゼ発現細胞を過酸化水素に晒すとどうなるかというと,テロメラーゼを発現していない細胞と同様な老化変化を示した.しかし,テロメア長を調べてもはっきりした短縮は起こっていなかった[Figs. 7(c),(d)].33)ちなみに,テロメラーゼ発現細胞は細胞増殖能が亢進している訳ではない[Fig. 7(f)].
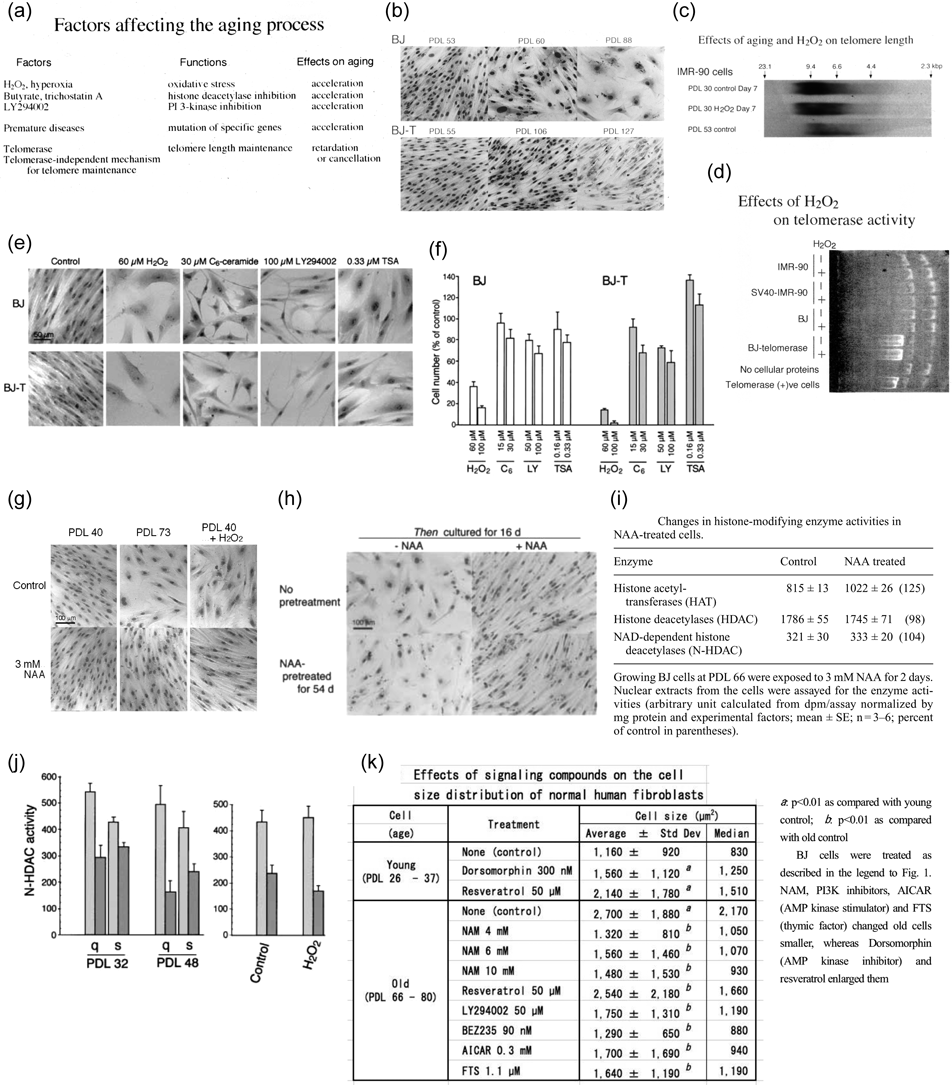
(a) Factors affecting the aging phenomena.31) (b) Morphology of young and aged, normal (BJ) and telomerase-positive (BJ-T) fibroblasts. (c, d) Effects of age and oxidative stress on the telomere.33) Telomere is shorter in aged (PDL 53) cells, but H2O2 treatment does not change its length, nor telomerase activity. (e, f) Effects of several chemicals on cell morphology and proliferation.33) H2O2, C6-ceramide (MAP-kinase activator) and trichostatin A (HDAC-inhibitor) induce senescent cell phenotype, whereas LY294002 (PI3K inhibitor) does not. Their actions do not seem to distinguish normal and telomerase-positive cells. (g, h) NAA suppresses the senescent phenotypes in aged and H2O2-treated cells, whose effect is reversible.37) (i) NAA stimulates HAT to some extent, but does not affect HDAC or N-HDAC (sirtuins).37) (j) N-HDAC activity is lowered in aged and H2O2-treated cells.37) (k) Changes in cell size and motility upon treatment with various bioactive reagents.1) Chemicals acting on cellular signaling affect cell morphology as well as other aging-related phenotypes, cell motility, aging-marker SA-gal, autophagy marker MAP-LC3 and Akt phosphorylation. Parts of this figure are adapted from Refs. 1, 31, 33 and 37 and modified/abridged for this review article.
以上の観察は,老化現象を制御しているイベントはなんらかの遺伝子等の変化がトリガーになって惹起されることを示唆するが,それをピンポイントで探り当てるのは容易ではないと思われる.ひとつの事例を挙げると,ラットの再生肝において発がん物質ジエチルニトロサミンで処理すると発現が顕著に低下するメッセージ(mRNA)がみつかった.34)調べるとα2u-globulin(major urinary protein)だった.In situ hybridizationによるとジエチルニトロサミン投与,あるいは部分肝切除で細胞増殖が亢進している部位でこの分子の発現が低下しており,一見関係のなさそうなこのような分子からも細胞の増殖・分化の調節に係わる機能の一端がうかがわれて,細胞機能を巡る現象の奥深さを感じる.
細胞老化を律する分子が何なのかは最も興味を惹かれるテーマのひとつである.21世紀に入って関心の高まってきた現象はヒストンなどクロマチンの修飾による老化,寿命のコントロールである.酵母の研究からそこにはSir2, Sirt1などのsirtuinタンパク質が係わっていること,しかもsirtuinはニコチンアミドアデニンジヌクレオチド依存性ヒストン脱アセチル化酵素(nicotinamide adenine dinucleotide: NAD+-HDAC)で,酸化状態/エネルギー欠乏状態において活性化されることがわかってきた.35,36)逆に,エネルギー代謝の亢進では活性酸素種などによるストレスが上昇するので,細胞,ミトコンドリアでのゲノム傷害をもたらし,ひいては寿命の短縮/老化につながる.老化細胞におけるNAD+-HDAC活性を調べてみると継代早期細胞よりやや低下していることがみられた[Fig. 7(j)].また,ヒストンアセチル基転移酵素(histone acetyltransferase: HAT)の活性は老化細胞でやや低く,過酸化水素処理によって低下したので,老化との関連が窺われる.37) Sirtuinはアセチル化タンパク質を脱アセチル化するときにニコチンアミド[nicotinamide(NAM)あるいはNAA]を生成し,また,タンパク質をADPリボシル化するポリADPリボシルポリメラーゼ[poly(ADP-ribose)polymerase: PARP]反応によってもNAMを生成するので,NAMはエンドプロダクトとしてsirtuinの阻害活性を持つ.NAD+はsirtuinにとって補酵素なので,種々のNAD+関連分子,PARP阻害剤,抗酸化剤によって細胞がどう影響を受けるかを調べてみた.37)結果としてほとんどの場合目立った変化はみられなかったが,老化細胞を5–10 mMというかなり高濃度のNAMで処理すると継代後期細胞に特徴的な老化形質が消失するという変化に気づいたので[Figs. 7(g),(h)],この現象について分析を進めた.37)ヒストン修飾酵素に関しては,NAM処理によってヒストンアセチル基転移酵素だけがある程度上昇していた[Fig. 7(i)].老化形質としてはっきりしているものとして細胞増殖速度の低下,飽和細胞密度の低下,細胞のサイズの拡大,細胞核の拡大,細胞運動の低下,SA-β-galの発現,など様々なものがある.1,3,4,6)今回NAMの作用としてそれらの老化形質の抑制が観察されたことから,一般に不可逆的と考えられている老化現象が一定程度回復する可能性のあることが示されたといえる[Figs. 7(g),(h)].37)その後いくつかの研究グループから同様な現象を確認する報告が出されたので,38,39)私たちも心強いところである.種々の薬物を用いて老化形質発現に対する作用を調べると,NAMのほかには,LY294002, BEZ235等のPI3K阻害剤,sirtuin活性化剤のrapamycin, AMPキナーゼ活性化剤のAICARは老化形質抑制的に,sirtuin阻害剤のchloroquine, AMPキナーゼ阻害剤のdorsomorphinはむしろ老化形質誘導的な作用を示した.一方,細胞内エネルギー代謝を促進するシグナルは細胞増殖の促進,そして老化の誘導に働いているといえる[Fig. 7(k)].1)既に触れたようにNAMはsirtuinの阻害剤なので,NAM処理は本来細胞老化を引き起こすはずのものと考えられ,逆説的な現象となっている.40)その意味については,NAMが代謝されて生じる誘導体やnicotinamide mononucleotide(NMN)が細胞内での代謝,例えばSIRT1の亢進を調節する可能性,あるいは,NAD+生成を促進することで逆にsirtuinを活性化することなども示唆されているので,慎重な検討が必要であり,今日でも多くの研究者による分析が進められている.41)ちなみに,PI3K阻害剤は全体として老化形質抑制的な作用がみられたが,これら阻害剤はPI3Kファミリーの各サブタイプに対する働きに差があり,その特徴によって老化に対する作用も影響されると考えられる.例えば,クラスIのPI3Kはmammalian target of rapamycin(mTOR)を活性化し,オートファジーを抑制するので,PI3K阻害剤がこれを抑制すると老化誘導が抑えられることになるが,逆にPI3KクラスIIIはオートファジーを促進するので,生存シグナル増強的に働いていることも考えられ,阻害剤がこれを抑制すると老化誘導を引き起こすこともあり得る.42)老化形質を調節するこれらのイベントについてはさらなる研究が求められている.
細胞というものと付き合いを始めてからかれこれ40年以上になる.以上記してきたように私はずっと細胞を眺めてきた.細胞は生きているので,働きかけるといろいろな反応をみせてくれるが,そこにみえているもの,あるいは隠れているものをしっかり捉えられたかというと,ほとんどが思うようにできなかったというのが正直な感想である.もう少し気の利いた発見をすることができなかったことについては,協力してくれた彼らには申し訳なく思っている.
以上記した研究結果は,東京都老人総合研究所薬理学研究室,豪州ニューサウスウェールズ大学病理学部発がん研究ユニット,東京大学医科学研究所腫瘍分子医学部門,米国ラトガーズ・ニュージャージー州立大学化学化学生物学科,千葉科学大学薬学部分子細胞生物学研究室など,いくつもの研究組織で実験を行う機会を頂いて進めてきたものです.それらの現場においては本文中に記した諸先生,共同研究者の皆様のご指導とご協力を頂きました.お名前を挙げられなかった方々についてはそれぞれの拙著論文の中に共著者として挙げさせて頂いております.ここに報告させて頂いた研究結果はすべて皆様のお力添えの賜物です.謹んでお礼申し上げます.
開示すべき利益相反はない.
本総説は,2021年度退職にあたり在職中の業績を中心に記述されたものである.