2024 年 144 巻 1 号 p. 57-60
2024 年 144 巻 1 号 p. 57-60
AB5 toxins of pathogenic bacteria enter host cells and utilize the retrograde trafficking pathway to translocate to the cytoplasm and exert its pathogenesis. Cholera toxin and Shiga toxin reach the endoplasmic reticulum (ER), and the A subunit undergoes redox regulation by ER proteins to become active fragments, which pass through the ER membrane and translocate to the cytoplasm. By acting on molecular targets in the cytoplasm, the normal function of host cells are disrupted, causing diseases. ER chaperone proteins such as protein disulfide isomerase (PDI) and binding immunoglobulin protein (BiP) induce conformational changes triggered by the reduction of disulfide bonds in the A subunit. This is thought to be dependent on cysteine thiol-mediated redox regulation, but the detailed mechanism remains unclear. On the other hand, subtilase cytotoxin (SubAB), produced by enterohemorrhagic Escherichia coli (EHEC), localizes to the ER without translocating to the cytoplasm and cleaves BiP as a substrate. Therefore, it is thought that ER stress-based cytotoxicity and intestinal bleeding occur without translocating to the cytoplasm. We reported that PDI is involved in BiP cleavage through SubAB localization to the ER. Like other AB5 toxins, this indicates the involvement of redox regulation via chaperone proteins in the ER, but also suggests that SubAB does not translocate to the cytoplasm because it cleaves BiP. Although there are few reports on the redox state of ER protein thiols, it is suggested that polysulfidation, which is discussed in this symposium, may be involved.
これまで,病原細菌が産生するタンパク質毒素の病原性発現にレドックス調節が関与するという報告がある.本シンポジウムでは,細菌のAB5毒素のレドックス調節について,先行研究及びわれわれの知見について紹介した.病原細菌のAB5型毒素は1個のAサブユニットと5個のBサブユニットから構成される外毒素である.両サブユニットはそれぞれ特徴的な役割を持ち,互いに巧妙に機能分担をして一つの毒素を形成している.Aサブユニットは主に毒性に直接関与する特異的な酵素活性を有する.一方,Bサブユニットは標的細胞のレセプターに対する結合能を有し,AB5型毒素を標的細胞に吸着させる役割を担っている.1)ここでは毒性が全く異なるAB5型毒素であるコレラ毒素(Cholera toxin: CT)と志賀毒素(Shiga-toxin: Stx)を例に,その毒性発現メカニズムや細胞内レドックス関連因子について紹介する.またAB5毒素としては比較的新しく同定されたsubtilase cytotoxin(SubAB)の病原性調節についても,これまで得られた知見を基に議論したい.
AB5毒素には代表的なものとしてコレラ菌が産生するCT,赤痢菌が産生するStxなど複数のタンパク質毒素が分類される.わが国の病原細菌のAB5毒素としては,毒素原性大腸菌がCTと相同性の高い易熱性エンテロトキシン(heat-labile enterotoxin: LT)を産生することや,腸管出血性大腸菌がStxと同一のStx1及び抗原性の異なるStx2(相同性約56%)を産生することが知られている.2)これらは毒性が異なっているが,基本構造などにおいていくつかの共通点がある.ここで紹介するStx(Stx1とStx2も含む)やCT, LTのAサブユニットのアミノ酸配列をみると,およそ200–300番目の領域に2個のシステイン残基が存在し,一対の典型的なジスルフィド結合を形成している(CT: 205–217, Stx1: 264–283, Stx2: 263–282, LT: 223–235).AサブユニットはA1及びA2フラグメントで構成され,ジスルフィド結合がこれらのフラグメントをつなぐ役割を持つと考えられている.
CTやStxは細胞外から宿主受容体に結合後,逆行性輸送経路(retrograde trafficking pathway)を利用して,細胞質に到達する.1,3)そしてAサブユニットの酵素活性ドメインが分子標的に作用することで細胞に異常を来し病気を引き起こす.これらの毒素はエンドサイトーシスにより取り込まれると,ゴルジ体を通って小胞体(endoplasmic reticulum: ER)に到達する.AサブユニットがER膜を越えて細胞質の分子標的に作用するには,宿主のERシャペロンタンパク質などの働きによりA1フラグメントへと変化し,sec61複合体などER transloconを通って膜を通過し細胞質に移行すると考えられている(Fig. 1).AB5毒素が宿主細胞の逆行性輸送やER-associated degradation(ERAD)を巧みに利用して病原性を発揮していることは驚くべきである.in vitroにおける解析から,protein disulfide isomerase(PDI)がA1とA2フラグメントをつなぐジスルフィド結合を還元し,放出されたA1フラグメントが膜を通過することが提唱されている.3,4)これらの知見は,AB5毒素のAサブユニットの病原性亢進においてレドックス調節が深く関わることを示唆している.
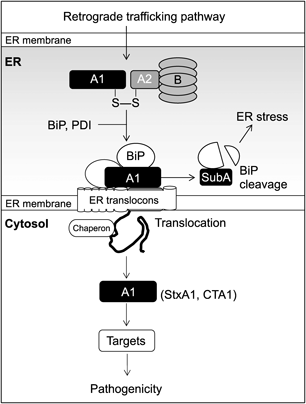
SubABは,オーストラリアで集団食中毒を引き起こした腸管出血性大腸菌O113株から新規のAB5毒素として同定された.5)SubABのAサブユニットはセリンプロテアーゼ活性を持ち,ERでシャペロンタンパク質binding immunoglobulin protein(BiP)を切断することで宿主細胞にERストレス性の細胞死を誘導する.6)SubABはマウスに腸管出血を伴う致死を誘導することから,本菌の重要な病原因子と考えられる.7)他のAB5毒素と同様にSubABも宿主細胞に侵入すると逆行性輸送を利用してERに到達するが,そこから膜を越えて細胞質に移行するかどうかは不明である.少なくともこれまでの知見からSubABが積極的にERに集積することが知られており,その過程でPDIやBiPなど宿主タンパク質との相互作用が重要ではあるが,他の毒素の場合とは機序が異なる可能性が考えられた.筆者らは,siRNAによる遺伝子ノックダウンを用いてSubABのBiP切断を評価した結果,PDIをノックダウンしたHeLa細胞ではBiPの切断が抑制されることを見い出した[Fig. 2, ref. 8)より引用・改変].またPDIのノックダウンは,SubABの細胞毒性を減弱した.これはPDIがSubABのBiP切断を起因とするSubABの病原性に関わることを示唆している.また,コントロール細胞では蛍光標識したSubABが核周辺に集積したが,PDIをノックダウンした細胞ではその集積が減少したことから,SubABのER局在にPDIが関わることが示唆された.SubABのAサブユニットの288番目と331番目のシステインは典型的なジスルフィド結合を形成しており,9)他のAB5毒素のようになんらかのレドックス調節が関与するのではないかと考えられる.憶測ではあるが,初期にPDIがAB5毒素の逆行性輸送やER局在に係わり,その下流でBiPの作用が加わることでAサブユニットの活性化や細胞質への移行につながるが,SubABに限ってはBiPを切断することで細胞質に移行できないと考えることができる.
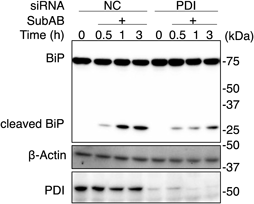
HeLa cells were transfected with control (NC)-siRNA or PDI-siRNA. Cells were then treated with or without SubAB for indicated time. Cells were solubilized and proteins were subjected for SDS-PAGE and Western blotting (WB) using antibodies as indicated. (Figure reprinted with modification from Tsutsuki et al., Biochem. Biophys. Res. Commun., 525, 1068–1073, 2020.8) Copyright 2020 Elsevier Inc.)
SubABが他のAB5毒素と異なる細胞内局在や基質特異性を示すメカニズムはほとんど明らかではないが,レドックスタンパク質の関与を調べることで詳細なメカニズムが明らかになると考えられる.筆者らはPDIやBiP以外にも,様々な宿主のレドックスタンパク質が細胞内輸送や局在,Aサブユニットの活性化などに関与するのではないかと仮説を立て,現在そのような宿主タンパク質のレドックス調節機構に注目している.本シンポジウムのセッションではアミノ酸やタンパク質のシステインのチオール基(Cys-SH)に更に硫黄が付加したシステインパースルフィド(cysteine persulfide: Cys-SSH)やポリスルフィド(cysteine polysulfide: Cys-S[S]nH)に代表される関連分子,10,11)すなわち超硫黄分子の生体内機能について最新の研究成果が紹介された.特に最近では分析技術の発展によりポリスルフィド化タンパク質が次々と同定されている.これまでにポリスルフィド化の報告があるタンパク質のなかで,ERの機能にも関わることが知られているものにPDI,グルタチオンS-転移酵素(glutathione S-transferase: GST)の一種であるGSTP1などがある.12,13)これらのタンパク質はレドックス応答性システインのポリスルフィド化がAB5毒素の細胞内輸送や活性化などERにおける毒性調節に関わる可能性もある.また,protein tyrosine phosphatase 1B(PTB1B),peroxiredoxin 2(Prx2),alcohol dehydrogenase 5(ADH5),glyceraldehyde-3-phosphate dehydrogenase(GAPDH),ethylmalonic encephalopathy 1(ETHE1),dynamin-related protein 1(Drp1)など細胞内及びミトコンドリアシグナルに関わる多くのタンパク質がポリスルフィド化を介して酸化ストレスや親電子物質の代謝を制御していることが示唆される.11,14,15)これらレドックスタンパク質や親電子シグナルはERの外において毒素の活性化を間接的に制御するかもしれない(Fig. 3).近年のレドックス研究の進展に鑑み,病原微生物と宿主の相互作用においてこれまで未解明であったレドックス調節機構を明らかにすることができれば,それを標的とした新しい切り口の感染制御法の確立につながる.今後,研究グループ内外で様々なポリスルフィド化タンパク質が発見されることで超硫黄分子の新しい生理機能が明らかになると思われる.その成果は毒素や感染症研究のみならず広く生命科学研究の大きな発展につながることが期待される.

開示すべき利益相反はない.
本総説は,日本薬学会第143年会シンポジウムS29で発表した内容を中心に記述したものである.