2024 Volume 144 Issue 11 Pages 983-989
2024 Volume 144 Issue 11 Pages 983-989
Interindividual differences in the expression and activity of drug-metabolizing enzymes, including cytochrome P450, UDP-glucuronosyltransferase, and esterases, cause variability of therapeutic effectiveness and side effects during drug treatment. Conventional research has focused on transcriptional regulation by transcription factors and nuclear receptors such as aryl hydrocarbon receptor, pregnane X receptor (PXR), constitutive androstane receptor, and hepatocyte nuclear factor 4α, as the major mechanisms causing the differences in the expression of drug-metabolizing enzymes. Recently, we have revealed that adenosine-to-inosine RNA editing and methylation of adenosine at the N6 position on RNA, two major types of posttranscriptional modification, play a pivotal role in the regulation of drug metabolism. In addition, switch/sucrose non-fermentable complex, a chromatin remodeler, is required for PXR-mediated transcriptional regulation of drug-metabolizing enzymes. This review article introduces the significance of these epitranscriptomic and epigenetic regulations as factors in determining drug metabolism potency. Further research on this link is expected to lead to a deeper understanding of interindividual differences in the therapeutic effectiveness and side effects of medicines.
薬物治療における薬効や副作用の発現には大きな個人差が認められる.それは,薬効成分の血中濃度や反応性代謝物の生成といった薬物動態の個人差が原因となる場合が多い.薬物動態を規定する薬物代謝酵素や薬物トランスポーターの発現量や機能には50–100倍の大きな個人差が認められ,特に肝臓に発現するシトクロムP450(cytochrome P450: P450)やUDP-glucuronosyltransferase(UGT),加水分解酵素などの薬物代謝酵素の活性や発現量の差が薬物動態に与える影響が大きい.薬物代謝酵素の発現制御メカニズムについて,従来の研究では転写因子や核内受容体による転写制御に焦点が当てられてきた.筆者は,これまでにadenosine-to-inosine(A-to-I)RNA編集,RNA上のN6位メチル化(m6A修飾),クロマチンリモデリングを介した薬物代謝酵素の新規発現調節機構を解明する研究に取り組んできた.本総説ではその成果について紹介する.
A-to-I RNA編集は,ヒト転写産物において高い頻度(450万ヵ所)で認められる転写後修飾であり,adenosine deaminase acting on RNA(ADAR)1若しくはADAR2による加水分解的脱アミノ化反応によってアデノシンがイノシンへと置換される.mRNA上のイノシンは生体内においてグアノシンとして認識されることから,A-to-I RNA編集は遺伝子の発現量や機能を左右する可能性がある.例えば,A-to-I RNA編集が翻訳領域上で起こった場合,アミノ酸配列が変化し,コードされているタンパク質の機能が変化する可能性がある.また,イントロン上でA-to-I RNA編集が起こるとスプライシングに異常が生じる可能性,そして,3′-非翻訳領域(3′-untranslated resion: 3′-UTR)は,転写後発現抑制因子であるmicroRNAの主要な標的であることが知られているが,3′-UTR上にA-to-I RNA編集が起こるとmicroRNAの認識性が変化し,遺伝子発現量の変化につながる場合がある(Fig. 1).1)

Adenosine deaminase acting on RNA (ADAR) enzymes convert adenosine to inosine by hydrolytic deamination. Inosine is recognized by the cellular machinery as if it were guanosine. Through the nucleotide conversion, amino acid sequence, splicing, and miRNA targeting can change. UTR: Untranslated region.
筆者が所属する研究グループは,個人肝臓におけるADAR1の発現量に200倍以上の個人差が存在することを見い出した.2)このADAR1の個人差が薬物代謝能の個人差の一因となっているか解明するために,A-to-I RNA編集がヒト肝細胞における薬物代謝酵素の発現量を規定する可能性を明らかにする研究に着手した.3)
2-1. ADARによる薬物代謝型P450発現制御ADARがヒト肝における薬物代謝型P450の発現を制御するか調べるために,P450の発現を高く保持するヒト肝由来HepaRG細胞におけるADAR1若しくはADAR2の発現を,small interfering RNA(siRNA)を用いてノックダウンした.その結果,ADAR1若しくはADAR2のノックダウンにより薬物代謝酵素CYP2C8の発現量は低下した.この発現変動は,CYP2C8 mRNA上のA-to-I RNA編集が直接CYP2C8の発現を制御したことによるものではなく,CYP2C8の転写を制御する核内受容体であるhepatocyte nuclear factor 4α(HNF4α)の発現量が,翻訳効率の抑制を介して減少した結果である.さらに,CYP2C8と同様にHNF4αによって制御されるP450分子種であるCYP2A6, 2C9, 2C19, 2D6及び2E1の発現量もADAR1若しくはADAR2のノックダウンによって減少したことから,ADARによるHNF4α発現制御は薬物代謝酵素の発現量を広範に制御することが示された.一方,主要薬物代謝酵素の一つであるCYP3A4の発現量はADAR1のノックダウンによって増加したことから,ADAR1はCYP3A4の発現を抑制することが明らかになった.4)この発現制御メカニズムを含めてA-to-I RNA編集による転写因子・核内受容体発現制御について,以下に詳述する(Fig. 2).

ADAR1 and ADAR2 positively regulate hepatocyte nuclear factor 4α (HNF4α) expression by promoting translation, leading to upregulation of CYP2C8 expression. ADAR1 negatively regulates aryl hydrocarbon receptor (AhR) expression by creating a miRNA binding element, leading to downregulation of CYP1A2 expression. ADAR1 negatively regulates constitutive androstane receptor (CAR) expression by attenuating splicing, leading to downregulation of CYP2B6 and CYP3A4 expression. ADAR1 and ADAR2 downregulate pregnane X receptor (PXR) expression by facilitating mRNA degradation, leading to downregulation of CYP3A4 expression. ADAR1 positively regulates dihydrofolate reductase (DHFR) expression by destroying a miRNA binding element. CYP: Cytochrome P450.
AhRはリガンド応答性の転写因子であり,CYP1A1, CYP1A2, CYP1B1, UGT及びglutathione S-transferasesなどの異物代謝酵素の転写を制御する.筆者らは,サンガーシークエンス法によってAhR mRNAの3′-UTR上にアデノシンとグアノシンが重複している箇所,すなわちA-to-I RNA編集サイトが38ヵ所存在することを見い出した.そして,このA-to-I RNA編集によってmicroRNAの1種であるmiR-378の結合配列が形成されることで,AhRの翻訳が抑制され発現が負に制御されることが示された.さらに,この負の発現制御はAhRによるCYP1A分子種の発現誘導にまで影響を及ぼした.本研究は,A-to-I RNA編集が異物代謝関連遺伝子の発現を制御することを初めて明らかにしたものである.2)
2-1-2. ADAR1がもたらすconstitutive androstane receptor(CAR)mRNAのスプライシング異常核内受容体CARは医薬品化合物などによって活性化され,CYP2B6, CYP2C9, CYP3A4, UGT及びsulfotransferasesなどの薬物代謝酵素の転写を調節する.筆者らは,ADAR1がCARの発現を抑制すること,この発現制御が下流のCYP2B6やCYP3A4の発現抑制につながることを明らかにした.この発現制御メカニズムとして,ADAR1がA-to-I RNA編集非依存的にCAR mRNAのスプライシングを抑制することによるものであることが示され,ADAR1の新たな機能の提唱につながった.5)
2-1-3. ADAR1によるpregnane X receptor(PXR)mRNAの分解促進CARと同様に,PXRもまたP450やUGT, sulfotransferases, glutathione S-transferasesなどの異物代謝酵素の発現を制御する核内受容体の1種である.筆者らは,HepaRG細胞においてADAR1若しくはADAR2をノックダウンすると,PXR mRNAの分解抑制を介してPXRタンパク質発現量の増加が起こり,2-1節において述べたCYP3A4の発現増加につながることを示した.6)
2-2. タバコ煙が引き起こすADAR1タンパク質分解筆者らは,タバコ煙がADAR1発現量に変化をもたらす外的要因となることを明らかにした.タバコ煙抽出物をヒト肺由来A549細胞に処置した際にADAR1タンパク質発現量の減少が,タバコ煙をマウスに暴露した際に肺におけるAdar1タンパク質発現量の減少が認められた.この発現減少はオートファジーを介して引き起こされることが明らかになった.さらに,ADAR1はタバコ煙抽出物誘導性酸化ストレスに対して防御的に働くことが示された.ADAR1は外的要因によるストレスに対する防御機構として機能することが,本研究によって初めて明らかになった.7)
2-3. 乳がんにおけるADAR1によるdihydrofolate reductase(DHFR)発現制御DHFRはDNA合成に係わる葉酸代謝経路の鍵酵素であり,がんの増殖において重要な役割を果たす.筆者らは,乳がん由来MCF-7細胞においてDHFR mRNAの3′-UTR上に26ヵ所A-to-I RNA編集サイトが存在することを見い出した.このA-to-I RNA編集によってmiR-25-3p並びにmiR-125a-3pが3′-UTRに結合できなくなることで,DHFR mRNAが安定化しDHFR発現量が亢進することが示された(Fig. 2).さらに,この発現制御はMCF-7細胞の増殖促進をもたらすことから,ADAR1が乳がんに対する治療標的となることが期待される.8)
A-to-I RNA編集同様にヒトRNA上において高頻度(48万ヵ所)で認められるRNA修飾の一つに,アデノシンのN6位メチル化(m6A修飾)である.この塩基修飾は,methyltransferase-like(METTL)3, METTL14などからなるRNAメチルトランスフェラーゼ複合体によって触媒され,fat mass and obesity-associated protein(FTO)やAlkB homolog 5, RNA demethylase(ALKBH5)によって脱メチル化される可逆的な塩基変化である.m6A修飾は,スプライシングを受ける前のpre-mRNAにおいて,主にストップコドン周辺や5′-UTR,イントロン中のDRACH(D=A/G/U; R=A/G; H=A/C/U)モチーフで起こる.m6Aを含むmRNAは,YT521-B homology(YTH)containing proteinsなどの種々のreaderタンパクによって認識されることで,スプライシング,核外移行,mRNA安定性や翻訳効率などが変化する(Fig. 3).9)筆者は,ヒト肝臓におけるm6A修飾の機能的意義を明らかにするためにm6A研究に着手し,個人正常肝試料においてMETTL3のタンパク質発現量に100倍以上の大きな個人差が存在することを見い出した.以下において,薬物代謝酵素の発現や機能の個人差に対するm6A修飾の寄与を明らかにした研究成果を詳述する(Fig. 4).3)

m6A is installed by a methyltransferase complex such as methyltransferase-like 3 (METTL3) and METTL14, which are called “m6A writers,” whereas the methyl group can be removed by RNA demethylases including fat mass and obesity-associated (FTO) and AlkB homolog 5 (ALKBH5), RNA demethylase, which are called “m6A erasers.” As an “m6A reader,” YTHDF1 promotes the translation efficiency of m6A-modified mRNA. YTHDF2 and YTHDC2 enhance the degradation of m6A-modified mRNA. YTHDC1 mediates splicing of m6A-containing mRNA. YTH: YT521-B homology.

CYP2C8 mRNA is subjected to m6A modification, leading to YTHDC2-mediated degradation of its mRNA. m6A modification negatively regulates UGT2B7 expression by downregulating HNF4α. YTHDC2 promotes the degradation of CES2 mRNA by recognizing m6A in the 5′-UTR. m6A modification positively regulates CYP2B6 expression by modulating chromatin structure. CES: Carboxylesterase; CYP: cytochrome P450; UGT: UDP-glucuronosyltransferase.
m6A修飾がP450の発現を制御するか明らかにするために,HepaRG細胞に3-deazaadenosine(DAA)を処置したところ,CYP1A2, CYP2B6及びCYP2C8 mRNA発現量が増加した.さらに,DAA処置によってCYP2C8タンパク質発現量並びにCYP2C8が触媒するアモジアキンN-脱エチル化酵素活性が増加した.また,CYP2C8発現量はm6A修飾酵素であるMETTL3のノックダウンにより増加し,脱メチル化酵素であるFTOのノックダウンにより低下した.以上の結果から,CYP2C8の発現量はm6A修飾により抑制されていることが明らかになった.ヒト肝臓組織とHepaRG細胞について抗m6A抗体を用いたRNA免疫沈降法を行ったところ,CYP2C8 mRNA上のラストエクソンにおいて高いm6Aレベルが認められた.そして,リーダータンパク質であるYTHDC2はこのm6Aを認識し,CYP2C8 mRNAの分解を促進することが示された.本研究は,m6A修飾が薬物代謝酵素の発現を制御することを初めて明らかにしたものである.10)
3-2. m6A修飾による第II相薬物代謝酵素UGT2B7発現制御主要第II相薬物代謝酵素であるUGTの発現がm6A修飾によって制御される可能性を明らかにするために,DAAを処置したHepaRG細胞におけるUGT各分子種のmRNA発現量を評価したところ,UGT2B7において顕著な発現増加が認められた.また,UGT2B7発現量はMETTL3のノックダウンにより増加し,FTO若しくはALKBH5のノックダウンにより減少した.このとき,UGT2B7の発現を制御する転写因子であるHNF4αの発現量も同様の変動を示していた.以上の結果から,m6A修飾は,HNF4αの発現制御を介してUGT2B7の発現を抑制していることが明らかになった.11)
3-3. m6A修飾による薬物・脂質代謝酵素CES2発現制御Carboxylesterase 2(CES2)は,薬物やトリグリセリドなどの内因性化合物を代謝する加水分解酵素である.m6A修飾がCES2の発現を制御するか,m6A修飾関連酵素をノックダウンしたHepaRG細胞におけるCES2発現量を評価したところ,CES2 mRNA及びタンパク質発現量は,METTL3とMETTL14のダブルノックダウンにより増加し,FTO若しくはALKBH5のノックダウンにより低下した.このとき,CES2が触媒する7-ethyl-10-[4-(1-piperidino)-1-piperidino]carbonyloxycamptothecin(CPT-11)の加水分解酵素活性も同様の変動を示したことから,m6A修飾はCES2の発現を抑制し,その制御は薬物代謝酵素活性にまで影響することが示された.また,m6A修飾によるCES2発現制御は遊離脂肪酸処置による脂質蓄積にまで影響することが明らかになった.この発現制御は,YTHDC2がCES2 mRNAの5′-UTRを認識しCES2 mRNAの分解を促進したことによるものである.本研究により,m6A修飾が薬物代謝のみならず脂質代謝にまで影響を及ぼすことが明らかになった.12)
3-4. m6A修飾によるクロマチン構造変化を介したCYP2B6発現制御m6A修飾がCYP2B6の発現量を制御する可能性を詳細に明らかにするために,METTL3とMETTL14の発現をダブルノックダウンしたHepaRG細胞におけるCYP2B6発現量を評価したところ,CYP2B6 mRNA発現量の低下並びにCYP2B6が触媒するブプロピオン水酸化酵素活性の低下が認められたことから,m6A修飾はCYP2B6の発現を正に制御することが明らかになった.このとき,CYP2B6 mRNAの安定性は変化しなかったことから,m6A修飾は転写後レベルでCYP2B6の発現を制御しないことが示された.クロマチン免疫沈降法によって転写抑制性のヒストンマーカーであるH3K9me2レベルを評価したところ,METTL3及びMETTL14のノックダウンによるCYP2B6上流領域のクロマチン構造の凝集が確認された.以上より,m6A修飾はクロマチン構造の制御を介してCYP2B6の発現を制御することが明らかになった.13)
核内受容体PXRは,リファンピシンやシンバスタチン,エファビレンツなどの医薬品化合物によって活性化されると,核内に移行しCYP3A4などの薬物代謝酵素の転写を促進する.その結果,薬物代謝酵素の発現量が増加し併用薬物の代謝が促進され,薬効や副作用発現の変化,すなわち臨床において問題となる薬物間相互作用が起こる可能性がある.このような薬物間相互作用を回避するためには,PXRの機能を阻害することが有効であると考えられるが,臨床使用可能なPXR阻害剤は見い出されていない.筆者らは,PXRの転写制御機能をコントロールする方法を見い出すことを目的として,PXRと相互作用する新規co-regulatorの探索を行った.
PXRを安定発現するヒト肝由来HepG2細胞であるShP51細胞14)にリファンピシンを処置し,PXRに対する共免疫沈降を行ったあと,PXRと相互作用するタンパク質を質量分析によって同定した.その結果,リファンピシン処置によってPXRはクロマチンリモデラーであるswitch/sucrose non-fermentable(SWI/SNF)複合体の構成因子と相互作用するようになる可能性が示された.SWI/SNF複合体はその構成因子の違いから,canonical brahma-related gene 1-associated factor(cBAF),polybromo-associated BAF(PBAF),non-canonical BAF(ncBAF)の3タイプに分類される(Fig. 5).共免疫沈降法により,PXRはbromodomain containing protein(BRD)9という構成因子を介してncBAFと相互作用することが明らかになった.リガンドによってPXRが活性化すると,PXRがCYP3A4遺伝子上流に結合しその周辺のクロマチン構造の弛緩が起こった結果,CYP3A4の発現誘導が起こる.BRD9に対する低分子阻害剤であるiBRD9を共処置すると,このリガンド依存的な転写活性化プロセスの進行が抑制された.したがって,PXR活性化による遺伝子発現誘導においてBRD9を含むncBAFが必要であることが示された.このncBAFによるPXR機能制御は,ヒト培養細胞のみならずヒト化CYP3A/PXRマウス15)を用いたin vivo実験においても認められた.
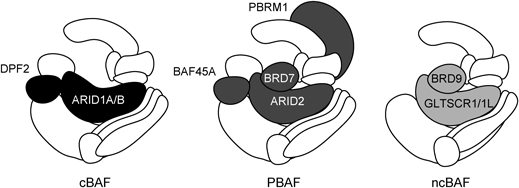
Black and gray colors show the components specific to each sub-complex.
エファビレンツはPXRを活性化することで肝臓におけるコレステロール合成酵素であるsqualene epoxidase(SQLE)や脂肪酸取り込みトランスポーターであるcluster of differentiation 36(CD36)の発現を誘導し,肝脂質蓄積を引き起こすことが報告されている.16)このエファビレンツ誘導性の肝脂質蓄積をBRD9の阻害によって抑制することができるか,マウスにエファビレンツとiBRD9を共投与した.その結果,エファビレンツ投与によるSqle並びにCd36の肝臓中発現誘導はiBRD9の共投与によって認められなくなり,肝脂質蓄積の抑制も認められた.以上より,クロマチンリモデラーncBAFの構成因子の阻害によってPXRを介した医薬品の有害作用を抑制できることが明らかになった(Fig. 6).17)

iBRD9, an inhibitor of ncBAF, can suppress PXR-involved adverse reactions.
以上の研究により,薬物代謝関連遺伝子の発現が転写・転写後レベルにおいて様々なメカニズムによって制御されることが明らかになった.これらの基盤情報は,将来的に薬効や副作用の個人差の最小化に寄与するものと期待される.
本稿において紹介した研究を遂行するに当たり,National Institute of Environmental Health Sciences/ National Institutes of Health根岸正彦先生,鳥取大学医学部 香月康宏先生,明治薬科大学 小林カオル先生に御協力頂きました.ここに厚く御礼申し上げます.また,御指導を賜りました金沢大学医薬保健研究域薬学系薬物代謝安全性学研究室 中島美紀先生並びに深見達基先生に心より感謝申し上げます.そして,本研究にともに取り組んだ当研究室の学生並びに卒業生に深謝いたします.
開示すべき利益相反はない.
本総説は,2023年度日本薬学会北陸支部学術奨励賞の受賞を記念して記述したものである.