2025 Volume 145 Issue 1 Pages 7-14
2025 Volume 145 Issue 1 Pages 7-14
Notable advances have recently been achieved in drug therapies for renal cell carcinoma (RCC). Several tyrosine kinase inhibitors (TKIs) and immune checkpoint inhibitors (ICIs) have been approved for metastatic RCC (mRCC). The current first-line treatment for mRCC involves combination therapies using TKIs and ICIs. However, there is no consensus on which TKI+ICI therapy is best or how to select the appropriate therapy for individual patients with RCC. The kidney expresses various metabolic enzymes, including CYP and uridine diphosphate glucose (UDP)-glucuronosyltransferase (UGT). Although information on CYP and UGT expression in the kidney is limited compared to our understanding of liver expression, the main CYP and UGT subtypes expressed at high levels in the kidney are estimated to be CYP2B6, CYP3A5, CYP4A11, CYP4F2, UGT1A6, UGT1A9, and UGT2B7. In RCC, the expression profiles and levels of these enzymes are somewhat altered compared with normal kidney. The main known subtypes of CYP and UGT in RCC are CYP1B1, CYP3A5, CYP4A11, UGT1A6, UGT1A9, UGT1A10, and UGT2B7. High CYP expression has been reported in several cancers, possibly conferring resistance to anti-cancer drugs including TKIs, due to extensive drug metabolism. Additionally, CYP and UGT expression levels may possibly affect cancer prognosis by metabolizing endogenous substrates, regardless of their role in anti-cancer drug metabolism. In this review, I discuss CYP and UGT expression level profiles in RCC based on previously published papers, including ours, and examine possible relationships between these enzyme expression profiles and treatment outcomes for patients with RCC.
腎に発生するがんは,約90%が腎細胞がん(腎がん,renal cell carcinoma: RCC)である.1)腎がんの罹患数は,わが国のみならず世界的に年々増加している.2,3)近年,腎がんに対する薬物治療の発展が目覚ましく,新規チロシンキナーゼ阻害剤(tyrosine kinase inhibitor: TKI)や免疫チェックポイント阻害剤(immune checkpoint inhibitor: ICI)など,複数の薬物が承認されている.現在では,ICIの2剤併用療法や,TKIとICIを組み合わせた新しい併用療法が,腎がんに対して一次治療から使用される.しかしながら,その組み合わせは様々で,現時点では最新のガイドラインにおいても第一選択薬が複数存在している状況である(Table 1).4–7)従来,腎がんに対する薬物療法の選択には,Memorial Sloan Kettering Cancer CenterやInternational Metastatic RCC Database Consortiumなどの予後予測分類法が活用されてきたが,これらは現在の薬物療法の選択には不十分であり,各患者への最適な治療法の提供のためには,より精度の高い予後予測分類法やバイオマーカーの確立が望まれる.本総説では,腎がんにおける薬物代謝酵素の発現に着目し,治療の個別適正化に対する有用性について考えたい.
| IMDC risk groups | Standard of care |
|---|---|
| Favorable risk | Lenvatinib/Pembrolizumab |
| Cabozantinib/Nivolumab | |
| Axitinib/ Pembrolizumab | |
| Intermediate and poor risk | Lenvatinib/Pembrolizumab |
| Cabozantinib/Nivolumab | |
| Axitinib/ Pembrolizumab | |
| Ipilimumab/Nivolumab |
IMDC: International Metastatic RCC Database Consortium.
「腎」という言葉を聞いて薬学関係者がまず思い浮かべることは,ADME(A; absorption, D; distribution, M; metabolism, E; excretion)のEを担い,物質を排泄するための臓器ということであろう.事実,腎は物質の排泄において極めて重要な役割を担っており,種々の輸送担体,いわゆるトランスポーターが高発現し,多種多様な物質が輸送・排泄されていることは広く認識されている.一方,ADMEのM,すなわち物質の「代謝」を担う臓器としては,恐らく肝が挙がることであろう.肝にはCYPやuridine diphosphate glucose(UDP)グルクロン酸転移酵素(UDP-glucuronosyltransferase: UGT)などの薬物代謝酵素が大量に発現しており,薬物や生体内基質の代謝において重要な役割を果たしていることは言うまでもない.一方,認知度は低いが,実は腎にも薬物代謝酵素が発現しており,全般的な発現量は肝と比較すると低いことが示唆されているが,肝と同等レベルで発現するものも報告されている.8,9)さらに,特定の基質に対しては,腎による代謝活性は肝に匹敵し,むしろ腎で代謝活性が高い基質も報告されている.例えば,ミコフェノール酸のグルクロン酸抱合反応において,腎ミクロソームによる抱合活性は肝ミクロソームの約1.6倍であることが報告されている.10)同様に,プロポフォールのグルクロン酸抱合反応においても,腎ミクロソームによる抱合活性は肝ミクロソームの約2倍であることが報告されている.11)これらの事実は,肝のみならず,腎における薬物代謝酵素の発現についても基質の代謝に重要であり,薬物及び生体内基質のクリアランスや腎に対する暴露量などに影響を及ぼす可能性を強く示唆している.以後,本総説では,ヒトにおける主要な薬物代謝酵素であるCYP及びUGTに着目し,腎がんに対する治療の個別適正化との関連を述べる.
腎がんにおける薬物代謝酵素の発現に話を進める前に,まずは正常腎における薬物代謝酵素の発現を考えたい.腎における薬物代謝酵素の発現については,肝と比較し圧倒的に報告数が少ない.しかし,腎においてもCYP及びUGTの発現については少なからず解析されており,それらの発現様式は肝とは大きく異なる.腎におけるCYP及びUGTの発現についてはKnightら及びMinersらの総説が詳しいが,12,13)近年に至るまでの知見を含め,特にヒトでの主要な分子種について,タンパク質レベルでの発現に着目しつつ以下に概説する.
まず,われわれが薬物代謝酵素として真っ先に思い浮かべるCYP3A4については,腎における発現の有無は報告間で異なってはいるものの,多くの報告で発現は認められておらず,筆者の解析においてもタンパク質レベルでの発現は認められていない.一方,遺伝子多型の保有の有無で肝における発現の可否(若しくは発現量の高低)が大きく左右されるCYP3A5については,腎においてもその遺伝子型に従い明確な発現が認められている.14,15)これらの腎におけるCYP3A4及びCYP3A5の発現に関する事実は,腎ミクロソームによるシクロスポリンの代謝物の生成量によっても支持される.16)シクロスポリンは,CYP3A4によって代謝物AM1及びAM9が,一方でCYP3A5によってはAM9のみが生成する.腎ミクロソームによるシクロスポリンの代謝物としてはAM9のみが生成し,またその生成量はCYP3A5の遺伝子型よって17倍以上異なることからも,腎にはCYP3A4ではなくCYP3A5が発現していることは間違いないであろう.そのほかのCYP3A分子種としては,CYP3A7及びCYP3A43が知られているが,筆者の知る限りこれらの分子種が腎で発現しているという明確なエビデンスは存在しない.
CYP1及びCYP2ファミリーについて,特にCYP2ファミリーには多くの分子種が存在するが,そのほとんどが腎での発現は認められない,若しくは報告間で異なっている.ただし,CYP2B6については,ターゲット・プロテオミクスにより腎に発現することが明らかとなっている.9) CYP4ファミリーについては,腎においても複数の分子種が発現していることが報告されている.例えば,CYP4A11及びCYP4F2については,腎においても肝と同等レベルで発現することが示されている.8)そのほかのCYP4分子種についても腎に発現することが示唆されているが,例えばCYP4F11はノーザンブロッティングによる解析のみが報告されていることなど,17)タンパク質レベルで発現するかについては明確でない.
腎におけるUGTの発現については,特定の基質に対しての腎によるグルクロン酸抱合活性は肝を凌ぐことからも特に重要であろう.腎に発現するUGT分子種については,特異的プローブを用いた解析や,ターゲット・プロテオミクスにより比較的明確化されている.9,18,19)肝と腎におけるUGTの発現様式を比較すると,肝では複数のUGT分子種がある程度バランスよく発現しているが,腎では特定の分子種が高発現しており,大きく偏っている.腎に高発現するUGT分子種はUGT1A9及びUGT2B7であり,ついでUGT1A6が挙げられる.そのほかのUGT分子種についても腎での発現が認められてはいるものの,これら3つの分子種と比較すると,少数の腎検体のみで発現が認められる,若しくは発現量が低い.
以上より,腎に発現する主要な薬物代謝酵素として考えられるものは,CYPについてはCYP2B6, CYP3A5, CYP4A11及びCYP4F2が,UGTについてはUGT1A6, UGT1A9及びUGT2B7が挙げられる[Fig. 1(A)].そのほかの分子種についても腎に発現する可能性はあるが,これらの分子種と比較し発現量が低いことや,発現の有無に関する結果が報告間で異なっていることなどが理由で,現時点では明確でない.報告間での結果の相違については,恐らく検出方法や抗体の特異性の違いに加えて,発現量を変化させる遺伝子多型の影響なども考えられる.しかしながら,先に述べた主要な分子種と比較し,ほかの分子種が腎において基質代謝に及ぼす影響は比較的小さいことが考えられる.
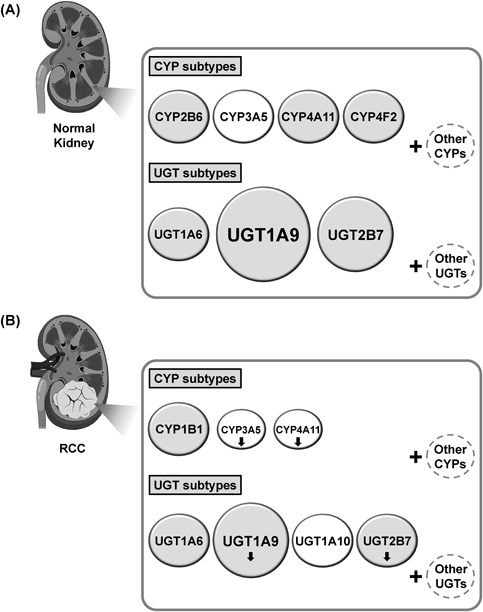
Illustrated expression patterns are based on previous studies which provided evidence of protein expression levels. White circles represent subtypes whose protein expression levels are strongly dependent on genetic variants or possibly on cell environment conditions. Down arrows indicate that expression levels of these proteins are decreased in RCC compared to those in normal kidney.
正常腎におけるCYP及びUGTの発現を把握した上で,腎がんにおける両薬物代謝酵素の発現について考える.しかしながら,腎がんにおけるCYP及びUGTの発現については驚くほど報告数が少なく,筆者の知る限り総説などについても存在しないことが現状である.
まず,腎がんにおけるCYPの発現については,既報のほとんどがノーザンブロッティングやreal-time PCR法,また米国国立生物工学情報センターのGene Expression Omnibus(GEO)や米国国立衛生研究所のThe Cancer Genome Atlasなどのデータベースを活用した遺伝子レベルでの解析である.このような中,正常腎に発現する4種類のCYP分子種をタンパク質レベルで解析した例は,筆者の報告を含めてCYP3A5及びCYP4A11の2分子種のみである.15,20,21) CYP3A5については,腎がんにおいても基本的に遺伝子型に依存して発現が認められるものの,その発現量は正常腎と比較して低下することが示されている.15) CYP4A11についても,約半数程度の腎がん検体で発現が認められているが,その発現量は正常腎と比較して低下する.20,21)一方,古い報告にはなるが,正常腎で発現は認められないが,腎がんにおいて発現が認められる分子種としてはCYP1B1が挙げられる.22)そのほかの分子種については,例えばCYP3A4については正常腎のみならず腎がんにおいても発現しないことを筆者は確認しているが,そもそもタンパク質レベルで解析されていない分子種が多いことが現状である.
腎がんにおけるUGTの発現については,正常腎と同様にターゲット・プロテオミクスによって解析されており,ある程度明確化されている.18)腎がんに発現するUGT分子種は基本的には正常腎と共通しており,UGT1A6, UGT1A9及びUGT2B7である.ただし,腎がんにおけるUGT1A9及びUGT2B7の発現量は,正常腎と比較して低下することが示されており,特にUGT2B7については,筆者の解析においても腎がんで劇的な発現量の低下が認められている.23)一方,正常腎で発現は認められないが,腎がんにおいて発現が認められる分子種としてはUGT1A10が挙げられる.18)しかしながら,UGT1A10の発現が認められたのは11検体中わずか2検体であったことから,大多数の腎がんにおいては発現しないことが考えられる.
以上より,腎がんにおいて発現する主要なCYP分子種としてはCYP1B1, CYP3A5及びCYP4A11が挙げられるが,CYP3A5及びCYP4A11については腎がんで発現量が低下する[Fig. 1(B)].また,UGT分子種としてはUGT1A6, UGT1A9, UGT1A10及びUGT2B7が挙げられるが,UGT1A9及びUGT2B7については腎がんで発現量が低下し,UGT1A10については多くの腎がんで発現しない[Fig. 1(B)].そのほかの分子種についても発現する可能性はあるが,現時点では明らかでない,若しくは先に述べた分子種と比較し発現量が低く,基質代謝に及ぼす影響は比較的小さいことが考えられる.
腎がんに発現するCYP及びUGT分子種を踏まえた上で,両薬物代謝酵素と腎がんの治療との関連について考える.薬物代謝酵素という名の通り,CYP及びUGTとがん治療との関連でまず思い浮かぶのは,これらの薬物代謝酵素が抗がん剤の代謝に及ぼす影響であろう.しかしながら,CYP及びUGTは,がん細胞の増殖・進展に影響を及ぼすことが報告されている生体内基質の代謝にも関与することから,これらの発現は抗がん剤の代謝のみに影響する訳ではないことが考えられる.そこで,腎がんに発現するCYP及びUGTについて,「抗がん剤の代謝」と「生体内基質の代謝」の2つに大別し,治療の個別適正化との関連について述べる.
「抗がん剤の代謝」と聞いて多くの薬学関係者が連想することは,肝における代謝を通じて全身循環中及びがん部位に到達する抗がん剤の量が変化し,結果として抗腫瘍効果若しくは有害事象の発現に個人差が生じることであろう.一方,本総説で焦点を当てているのは,腎がん自体の薬物代謝酵素の発現である.膵がんでの例にはなるが,がん細胞自体のCYP3A5の発現が,抗がん剤を過剰に代謝することで薬剤耐性につながることが報告されている.24)そこで,以後は腎がん部位に到達した抗がん剤の代謝について考える.腎がんに対しては従来の抗がん剤,いわゆる殺細胞性・細胞障害性の抗がん剤の効果は極めて限定的であることが古くから知られている.そのため,これらが腎がんの治療に使用されることはなく,TKIであるスニチニブが長らく第一選択薬として,また近年はアキシチニブ,カボザンチニブ若しくはレンバチニブなどのTKIとICIの併用療法が一次治療から使用される.4–7)これらのTKIは,すべてCYP3Aが代謝に関与することが考えられている[Fig. 2(A)].例えば,CYP3Aにより活性代謝物にもなるスニチニブについては,CYP3A5による代謝活性はCYP3A4と比較し低いものの,CYP3A5の遺伝子型によって患者の予後に差が認められるなど,CYP3A5の代謝への関与が示唆されている.25,26)スニチニブ以外のTKIにおいては,CYP3A5と臨床的な関連についての報告に乏しいが,in vitroにおける解析からCYP3A5が一部代謝に関与する可能性が示唆されている.27–29)したがって,CYP3A5が発現する腎がんにおいては,これらのTKIの抗腫瘍効果がCYP3A5の発現量によって変化する可能性がある.ただし,腎がんにおけるCYP3A5の発現量は正常腎と比較し低下することもあり,15) CYP3A5の発現がTKIの治療成績にどの程度影響を及ぼすかは明らかでない.また,アキシチニブについてはUGT1A1が代謝に関与するものの,27) UGT1A1は腎がんに発現する主要なUGT分子種ではなく,さらにそのほかのTKIについては,想定される代謝経路からはUGTが影響を及ぼす可能性は低いことが考えられる.いずれにしても,「抗がん剤の代謝」という観点から,腎がんに発現するCYP及びUGTがTKIの抗腫瘍効果に影響を及ぼす可能性はあるが[Fig. 2(B)],治療の個別適正化における有用性については現時点ではエビデンスに乏しく,今後の解析が待たれる.

(A) Metabolism of tyrosine kinase inhibitors, which are clinically used against RCC, by CYP3A. The metabolite of N-de-ethylated sunitinib retains inhibitory activity against tyrosine kinases as are exhibited by the unchanged form. (B) A schematic image of the relationship between CYP and UGT expression and anti-cancer drug levels in RCC cells. Excessive metabolism by CYP and UGT might potentially confer drug resistance by metabolizing a drug into an inactive form.
続いて,「生体内基質の代謝」について考える.腎がんにおける薬物代謝酵素の発現については,正常腎と比較して発現量が低下する分子種が多いことから,抗がん剤の代謝という観点よりは,こちらの観点の方が重要であることを筆者は想定している.まず,肝細胞がんでの例にはなるが,CYP3A5の発現量の低下が患者の予後不良に関わり,その機序としてはCYP3A5による生体内基質の代謝を介した活性酸素種の生成が挙げられている.30)本報告では,CYP3A5の発現量の低下が活性酸素種の生成量を減少させ,これにより哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin: mTOR)C2の作用が増強し,結果としてmTORC2が作用するAktのSer473のリン酸化が促進されることを通じて,がんが進展することが示されている.腎がんにおいても,CYP3A5の発現量の低下が患者の予後不良に係わり,CYP3A5の発現量が腎がん患者の予後予測因子となり得ることを筆者は明らかにしている.15)また,CYP4A11の発現量は腎がんのグレードと正の相関が認められており,CYP1B1については,遺伝子レベルでの解析にはなるものの,高発現が患者の予後不良に関連することが報告されている.21,31) UGTについては,UGT2B7の発現量の低下が患者の予後不良に係わり,UGT2B7の発現量が腎がん患者の予後予測因子となり得ることを筆者は明らかにしている.23) UGT2B7は,in vitro及びin vivoの双方で腎がん細胞の増殖を促進することが確認されている20-ヒドロキシエイコサテトラエン酸などの代謝に関与することが知られており,32,33)このような生体内基質の代謝を通じて腎がん患者の予後に影響を及ぼす可能性が考えられる.そのほかのUGT分子種については報告に乏しいが,real-time PCR法による遺伝子レベルでの解析において,UGT1A6及びUGT1A9の発現量は腎がん患者の予後に関連しないことを筆者は明らかにしている.23)以上より,腎がんに発現するCYP及びUGTについて,分子種には依存するものの,生体内基質の代謝を介して腎がん細胞の増殖・進展に関与する可能性は比較的高いことが考えられる(Fig. 3).特に,発現量が腎がん患者の予後と関連するCYP1B1, CYP3A5及びUGT2B7については,これらの発現情報を考慮することで,より高精度に各患者の予後を予測できる可能性がある.CYP4A11については,腎がん患者の予後との関連は明らかでないが,腎がんのグレードとの関連が示唆されていることから,本分子種についても患者の予後予測に有用な可能性がある.ただし,例えば発現量が高いもしく低いことが患者予後に関連するなど,これらの発現が腎がんに及ぼす影響については各分子種によって異なることが予想され,またそれらの基質や詳細な機序についても現時点では不明な点が多い.そのため,今後は各分子種の発現と,生体内基質の代謝並びに腎がん細胞の増殖・進展との直接的な関係性を解明する必要がある.

Endogenous substrates are converted by CYP and UGT into their active or inactive forms. During the metabolism of these substrates, various converted products or by-products, such as reactive oxygen species (ROS), might potentially affect RCC cell proliferation, migration, and invasion, ultimately influencing the prognosis in patients with RCC. mTOR: Mammalian target of rapamycin, 20-HETE: 20-hydroxyarachidonic acid, G: glucuronide.
本総説では,腎がんにおける薬物代謝酵素の発現と,治療の個別適正化との関連を概説した.本総説で取り扱った薬物代謝酵素は従来広く研究されてきたものも多いが,肝以外で,特に腎においてこれらの薬物代謝酵素が果たす役割についてはいまだ不明な点が多い.現在,腎がんに対する薬物治療ではTKIとICIの併用療法が主流であり,今後もICIのみならず,その代謝に薬物代謝酵素が深く関与するTKIが重要な位置付けを有することは当面の間変わらないだろう.一方,TKIとICIの併用による有害事象の増強・複雑化も認められているが,34,35)数ある第一選択薬から各患者に適した療法を選別することは,現時点では困難である.今後,腎がんにおける薬物代謝酵素の発現及びその役割に関する知見が向上し,ほかの予後予測因子やバイオマーカーと併せて,薬物代謝酵素の発現情報を加味することで,腎がん患者の治療の個別適正化が推進されることを願う.
学生時代より終始丁寧な御指導御鞭撻を賜り,現在所属する研究室の主宰である岡山大学学術研究院医歯薬学域 有吉範高教授に心より感謝申し上げます.また,日々の研究活動において多大な御支援を賜りました岡山大学病院薬剤部 座間味義人教授,岡山大学病院泌尿器科 荒木元朗教授,鳥取大学医学部附属病院薬剤部 藤吉正哉准教授を始め,研究を通じて係わらせて頂いたすべての先生方・学生の皆様に,この場をお借りして深く感謝申し上げます.
開示すべき利益相反はない.
本総説は,2023年度日本薬学会中国四国支部奨励賞の受賞を記念して記述したものである.